超声支气管镜引导下经支气管针吸活检对纵隔恶性肿瘤的病理诊断
谭旭艳, 李 明
支气管内超声引导针吸活检术(endo-bronchial ultrasound-guided transbronchial needle aspiration)简称EBUS-TBNA,是近年来发展起来的一项新技术,在明确纵隔肿瘤的诊断及判断纵隔和肺门肿大淋巴结的良恶性方面,以其高敏感性、特异性和准确性正日益受得临床关注。EBUS-TBNA是指支气管镜前安装超声探头,在实时超声监测下确认纵隔肿块及淋巴结的位置,规避血管,准确性好,诊断率高,安全及创伤小的活检新技术。我们自2011年8月以来,对CT检查发现为纵隔肿瘤的148例患者行EBUSTBNA,并经手术、纵隔镜或胸腔镜等病理学检查进一步的验证。现就病理证实的129例纵隔肿瘤阳性(恶性肿瘤)病例的EBUS-TBNA诊断结果及敏感性和安全性总结和初步探讨如下。
1 资料与方法
1.1 一般资料
本研究自2011年8月1日至2013年2月28日,共入组129例,男性101例,女性28例,年龄26~78岁,平均年龄56.8岁。门诊患者25例,住院患者104例。129例均为胸部CT扫描提示纵隔肿瘤患者,肿瘤性质未能明确,全身情况可,无检查与手术禁忌证。全部患者术前签署知情同意书,同意进行 EBUS-TBNA。
1.2 EBUS-TBNA 实施
1.2.1 设备准备 将超声支气管镜(BF-UC260FOL8,Olympus Ltd,Tokyo,Japan)通过一个凸面的超声探头(EU-C2000,Olympus,探头 7.5 MHz)相连接,实现常规支气管镜图像与超声图像在同一屏幕上实现可视化转换。
气管镜的直径和凸面超声探头的外周直径分别是6.2 mm和6.9 mm。超声支气管镜能够扫描气管镜插入的部位视图方向前方35°的倾斜面。通过安装一个可充水的气球球囊紧贴气管可清楚获得所选取的纵膈肿瘤的图像。系统配备多普勒模式,可以识别血管及其位置,避免穿刺误伤血管(图1)。EBUS-TBNA采用专门的22号穿刺针(NA-201SX-4022,0lympus Ltd),活检针配备一个内部鞘,在穿透支气管壁后可以被抽回,避免在EBUS-TBNA操作中被污染,活检针可在超声图像上实时显示(图2)。
1.2.2 患者准备 术前晚禁食8 h,禁饮6 h。术前给予阿托品1 mg、安定10 mg肌肉注射。患者取仰卧位,神志始终处于清醒状态,丁卡因咽部局醉,必要时术前半小时给予利多卡因0.1 g+0.9%氯化钠溶液20 mL含漱2~3次,减少口咽部反应。操作过程中注意患者生命体征变化,持续心电(心电图、血氧饱和度、血压)监护。
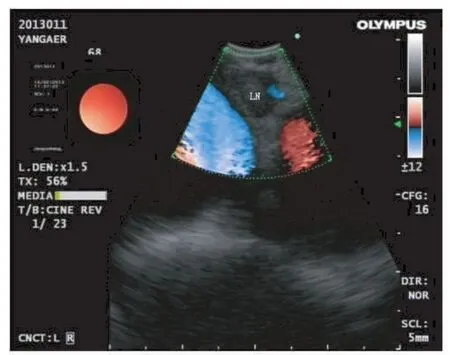
图1 EBUS-TBNA纵隔肿大淋巴结(LN),彩色显示周围血管
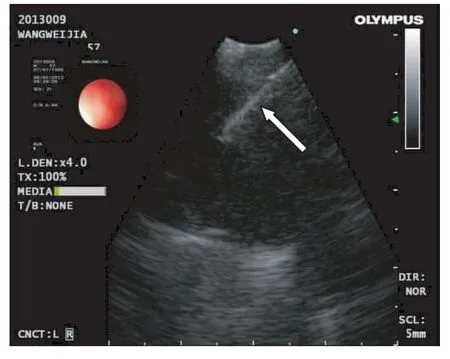
图2 EBUS-TBNA穿刺针(箭头指向处)在纵隔肿大淋巴结内实时穿刺
1.2.3 EBUS-TBNA操作 经口插入搭载电子凸阵扫描的气管内超声支气管镜,结合CT影像针对性扫查目标肿瘤及周围血管,淋巴结检查根据 AJCC(1997年)淋巴结分组标准。对目标肿瘤进行声像观察、直径测量;使用多普勒模式排除血管,同时了解周围血管情况。定位后在超声实时监测下穿刺。当确认穿刺针进入目标肿瘤后,退出穿刺针内导丝,同时在穿刺针末端接上带有20 mL负压的注射器,在超声实时监测下来回移动穿刺针进行负压抽吸,每一个穿刺取材部位来回提插15~20次。穿刺后内部刀鞘清洗,获得组织学标本,并用福尔马林固定,送病理科染色观察和诊断。同一部位根据取得的组织标本多少,可酌情进行1~3次的穿刺检查,以便获得足够的组织学标本。
1.3 结果判断与评价
标本涂片中见到明确的恶性肿瘤细胞,均认为EBUS-TBNA结果阳性;涂片中见到高度可疑的恶性肿瘤细胞时,且临床表现高度怀疑肺癌,或其他组织学或细胞学检查证明为肺癌,则认为EBUS-TBNA结果阳性;涂片标本中见淋巴样细胞,但无肿瘤细胞判断为阴性;仅见细胞质判断为不肯定,再以纵隔镜或胸腔镜的病理结果验证EBUS-TBNA诊断结果阳性率,并计算其穿刺成功率及诊断敏感性。
2 结果
2.1 EBUS-TBNA纵隔肿瘤及淋巴结分布
本组纵隔肿瘤129例,EBUS-TBNA显示7个纵隔淋巴结分组区域的肿大淋巴结(见表1)。

表1 本组129例纵隔肿瘤及淋巴结分布
2.2 EBUS-TBNA纵隔肿瘤淋巴结显像
本组纵隔肿大淋巴结129例,EBUS-TBNA显示大小及声像:14例直径>25 mm,边缘分叶状,内部回声不均匀;107例直径25 mm~10 mm,圆形或椭圆形,边缘不规则,内部低回声,欠均匀;8例直径<10 mm,圆形,内部低回声,均匀。
2.3 并发症
无1例发生出血、气胸、乳糜胸等严重并发症。
2.4 EBUS-TBNA穿刺成功率及诊断敏感性
129例CT影像学检查诊断纵隔淋巴结肿大的患者行EBUS-TBNA检查,129例均取材满意(其中126例1次穿刺活检成功,3例需2次穿刺活检),穿刺取材准确性100%。118例取得阳性的病理诊断;11例阴性或不肯定者9例加做纵隔镜,2例加做胸腔镜后获得阳性诊断。本组EBUS-TBNA诊断敏感性 91.47%。
3 讨论
如何准确快速地明确纵隔肿瘤的病理性质一直是临床工作中亟需解决的关键问题之一。对于可能手术的肺癌患者,术前明确其纵隔淋巴结有无转移更加重要。美国胸科医师协会把EBUS-TBNA作为临床纵隔淋巴结分期指南的其中一个重要手段(1B)[1]。EBUS-TBNA是在支气管镜检查的基础上实时超声引导下的经支气管针吸活检术,对气管周围纵隔肿大淋巴结的定性诊断率明显优于盲法TBNA[2],近来应用在对肺癌的准确分期及新辅助治疗方案的制定和疗效评价方面有突破性和实用性的临床意义[3]。
既往纵隔镜是直接获取纵隔肿瘤及淋巴结标本的金标准[4]。对不明原因的纵隔肿瘤及淋巴结肿大实施纵隔镜可以获得病理学诊断,纵隔镜能获取L1、2R、3R、4R、4L 区域的纵隔肿瘤及淋巴结标本,评估淋巴结是否受侵[4]。本组EBUS-TBNA患者除在 L1、2R、3R、4R、4L 发现纵隔肿瘤及淋巴结外,对位于7组、10组区域的肿瘤及淋巴结也得到很好的声像显示、标本获取和病理诊断(表1),显示EBUSTBNA的优势之一是在超声支气管镜的直接视觉下实时扫描能够清晰显示纵隔肿瘤及淋巴结(图2)。并在实时引导下准确的组织取材,不但可以对隆突前及气管旁的纵隔肿瘤及淋巴结取样,而且可以取到纵隔镜都难以取材的气管后及纵隔下部位,明显扩大了纵隔镜下纵隔肿瘤及淋巴结的可活检范围,使纵隔肺门肿瘤、淋巴结及分期以及初级诊断方面的临床确诊意义更大。
目前临床中常用的检查方法包括纵隔镜检查术(mediastinoscopy)、传统的经气管支气管针吸活检术(transbronchial needle aspiration,TBNA)以及食管超声内镜引导下穿刺活检术(endoscopicult rasoundguidedfine-needle aspiration,EUS-FNA)等,但这些方法都存在一定的局限性:纵隔镜检查创伤相对较大,需要全身麻醉;EUS-FNA在纵隔肿瘤及淋巴结诊断中虽具有较高的准确性,但其应用范围有限,无法对气管前的纵隔肿瘤及淋巴结进行探查活检;传统TBNA的应用范围与纵隔镜检查相似,其在进行纵隔肿瘤及淋巴结的穿刺活检时,只能根据胸部CT扫描判定相对的解剖部位,进行盲穿,难度较大,准确性及成功率有限。EBUS-TBNA是近年来推出的新技术,与传统的TBNA相比,EBUS可清楚地显示纵隔占位性病变,并且在EBUS实时监测下进行经支气管针吸活检,解决了传统 TBNA只能进行盲穿的问题,有效避免了对周围大血管的损伤,极大地提高了这一技术的安全性和准确性。安全性方面:EBUS-TBNA检查仅需局麻,微创,所以相对安全。本组129例EBUS-TBNA无1例发生并发症,与Gu等[5]报道的1 299例患者中并发症仅0.15%(2例出现并发症)的荟萃分析研究结果相一致。EBUSTBNA明显降低了纵隔镜或胸腔镜检查中包括气胸、乳糜胸、出血等并发症的发生率。准确性方面:EBUS-TBNA操作更简便,患者耐受性好,医疗费用更低,患者能够接受其重复性的检查,在新辅助化疗后纵隔肺门肿瘤及淋巴结的再评估中有独特意义,是肺癌治疗效果评价的重要方面。Herth等[6]等报道的1组124例被证实ⅢA-N2的肺癌患者化疗后行EBUS-TBNA再评估,其敏感性、特异性、PPV、NPV及诊断准确率分别为76%、100%、100%、20%和77%。表明EBUS-TBNA的另一个优势是EBUSTBNA作为一种临床可推行的准确微创的再评估手段,能够提供反复多次的纵隔肺门肿瘤及淋巴结活检,确保达到再评估的目的,指导临床治疗方案的评价和调整。Yasufuku等[7]报道,应用 EBUS-TBNA对70例患者纵隔和肺门肿瘤及淋巴结穿刺,良恶性纵隔淋巴结诊断的敏感性为95.7%;Herth等[8]报导502例纵隔肺门肿瘤及淋巴结肿大患者,经EBUS-TBNA穿刺572次肿块及淋巴结,诊断敏感性为94%;本组资料显示EBUS-TBNA的诊断敏感性为91.47%(118/129),这一结果表明 EBUS-TBNA的临床应用有较高的诊断敏感性,可减少或部分替代纵隔镜或胸腔镜在纵隔肿瘤及淋巴结确诊和疗效评估中的作用[9]。本组129例患者中11例假阴性,其中5例因淋巴结较大,中心有变性坏死,另6例为开展此项技术的初期,操作者手法不够熟练,未能准确定位或穿刺不到位导致假阴性诊断。Groth等[10]报道经过10次训练之后,EBUS-TBNA诊断的敏感性可以从50%上升到96%,表明熟练的操作技术可以保证和明显提高EBUS-TBNA的活检诊断敏感性。
综上所述,EBUS-TBNA作为一种微创诊断方法,在明确诊断纵隔肿瘤及淋巴结方面具有很高的敏感性和准确性,仅需局麻,且微创、安全、经济,尤其是可重复性的实施,是近来较科学的纵隔肿大淋巴结明确诊断及评估肿瘤分期的实用性技术,尤其对肺癌的新辅助治疗方案的制定及疗效再评价方面意义重大。
[1]Detterbeck FC,Jantz MA,Wallace M,et al.Invasive mediastinal staging of lung cancer.ACCP evidence-based clinical practice guided-lines(2nd edition)[J].Chest,2007,132(3 Suppl):202S-220S.
[2]Wallace MB,Pascual JM,Raimondo M,et al.Minimally invasive endoscopic staging of suspected lung cancer[J].JAMA,2008,299(5):540-546.
[3]Nakajima T,Yasufuku k,Suzuki M,et al.Assessment of epidermal growth factor receptormutation by endobronchial ultrasound-guided transbronchial needle aspiration[J].Chest,2007,132(2):597-602.
[4]汪金林,李时悦.支气管内超声的应用进展[J].临床肺科杂志,2011,16(10):1579:1582.
[5]Gu P,Zhao YZ,Jiang LY,et al.Endobronchial ultrasound-guided transbronchial needle aspiration for staging of lung cancer:a systematic review and meta-analysis[J].Eur J Cancer,2009,45(8):1389-1396.
[6]Herth F,Ernst A,Yasufuku K,et al.Endobronchial ultrasound with transbronchial needle aspiration for restaging the mediastinal[J].Thorac Oncol,2007,2:361S-362S.
[7]Yasufuku K,Chiyo M,SekineY,et al.Real-time endobronchial ultrasound-guided transbronchial needle aspiration of mediastinal and hilar lymph nodes[J].Chest,2004,126(1):122-128.
[8]Herth FJ,Eberhardt R,Vilinann P,et al.Real-time endobronchial ultrasound guided transbronchial needle aspiration for sampling mediastinal lymph nodes[J].Thorax,2006,61(9):795-798.
[9]Yarela-Lema L,Fernadez-Villar A,Ruano-Ravina A.Effectiveness and safety of endobronchial ultrasound-transbronchial needle aspiration:a systematic review[J].Eur Respir J,2009,33(5):1156-1164.
[10]Groth SS,Whitson BA,D'Cunha J,et al.Endobronchial ultrasound-guided fine-needle aspiration of mediastinal lymph nodes:a single institution's early learning curve[J].Ann Thorac Surg,2008,86(4):1104-1109.

