T-bet、GATA-3、FoxP3 及 CDCD调节性T细胞在AA发病机制中的作用
沈红石,陈海飞,任传路,李征洋,唐杰庆,王 静,吴天勤
(中国人民解放军第100医院,江苏苏州215007)
再生障碍性贫血(AA)是一种以全血细胞减少与骨髓造血功能衰竭为特征的骨髓造血系统疾病。其发病机制尚不十分清楚,免疫介导的造血抑制是AA最常见、目前研究最多的发病机制。已有研究表明,AA发生造血功能衰竭与细胞免疫功能异常、大量寡克隆淋巴细胞及/或自然杀伤细胞局部浸润、多种细胞因子分泌失调及造血微环境受损等因素有关[1~3],因此进一步了解AA的免疫发病机制对AA的临床诊断及治疗等方面有着重要的意义。T-bet、GATA-3分别为Th1、Th2细胞特异性的转录因子,FoxP3为调节性T细胞特异性的转录因子。本研究通过检测AA患者外周血单个核细胞(PBMC)中转录因子 T-bet、GATA-3、FoxP3 mRNA的表达、血浆中Th1类细胞因子IFN-γ和Th2类细胞因子IL-4水平及AA患者外周血调节性T细胞水平,从转录因子水平为AA的临床诊断和治疗提供理论和实验依据。
1 资料与方法
1.1 临床资料 选择2008年1月~2011年5月我院血液科门诊就诊及病房中的患者27例(AA组),其临床骨髓细胞形态学、生化及细胞遗传学检查符合AA诊断标准[4]。其中男17例、女10例,年龄19~58(33±9.8)岁,病程5~235(20±17.6)个月。对照组选择健康体检者25例,其中男16例、女9例,年龄20~59(32±8.3)岁。
1.2 标本采集 AA组与对照组均抽取外周静脉血8 mL,其中EDTA抗凝6 mL,肝素钠抗凝2 mL。后者经培养16~20 h后用于T细胞亚群的检测。EDTA抗凝外周血6 mL分离PBMC,提取总mRNA,-80℃低温冻存备用。用于 T-bet、GATA-3和FoxP3的测定。
1.3 检测方法
1.3.1 T-bet、GATA-3、FoxP3 mRNA的检测 通过实时荧光定量PCR方法检测这3种转录因子水平。TRIzol、FQPCR试剂盒均购自美国 Gibco-BRL,ABI7300型Real Time PCR检测仪购自美国公司。通过美国生物技术中心GeneBank数据库检索T-bet、GATA-3、FoxP3、GAPDH mRNA 序列,利用美国Whitehead生物医学研究所Primer3程序设计探针,参考文献方法设计上下游引物,由上海申友生物技术有限公司合成。探针及引物序列见表1。实时定量FQ-PCR总反应体系25 μL,其中含2×Quanti Tect SYBR Green PCR Master Mix 12.5 μL,上下游引物各 1 μL,样品 cDNA 1.5 μL。反应条件:50 ℃2min,95 ℃15min;94 ℃15 s,55 ℃30 s,72 ℃30 s,50次循环。采用RG-3000实时监测定量RT-PCR仪。利用溶解曲线进行产物的特异性分析,采用Relative Quantification Software 1.0分析软件进行分析,结果判断以同时扩增的内参照GAPDH的表达强度为基准,表达强度以转录因子/GAPDH的基因拷贝数的比值来表示。

表1 T-bet、GATA-3、FoxP3及GAPDH探针及引物序列
1.3.2 T细胞亚群的检测 抗体有FITC标记的鼠抗人 CD4、CD25、CD3抗体,PE 标记的 CD25,同型对照抗体为PE标记的鼠抗人IgG1免疫球蛋白、FITC标记的鼠抗人IgG1免疫球蛋白均为美国 BD公司产品。流式细胞术检测人细胞。采静脉血2 mL,肝素抗凝,两倍体积的PBS稀释,采用淋巴细胞分离液分离出外周血单个核细胞(PBMNC),调整细胞密度至1×107/mL,各取PBMNC悬液10 μL于标本试管中,分别加入FITC标记的CD4和PE标记的CD25各20 μL,阴性对照管加入 FITC标记的CD4和PE标记的鼠 IgG1各20 μL,室温避光孵育20min,加冷PBS洗涤1次,重新悬浮细胞后上流式细胞仪检测。
1.3.3 血浆IFN-γ和IL-4的检测 血浆IFN-γ和IL-4的测定,采用ELISA双抗夹心法,操作按试剂盒说明,检测试剂盒购自美国R&D systems公司。
1.4 统计学方法 采用SPSS13.0统计软件,计量资料以±s表示,组间比较用双t检验,组间计数资料比较用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组转录因子T-bet、GATA-3、FoxP3 mRNA表达量比较 与对照组相比,AA组的T-bet mRNA相对表达量升高(P<0.01),GATA-3、FoxP3 mRNA相对表达量降低(P<0.05,P<0.01)。见表2。
表2 两组转录因子T-bet、GATA-3、FoxP3 mRNA相对表达量比较(±s)
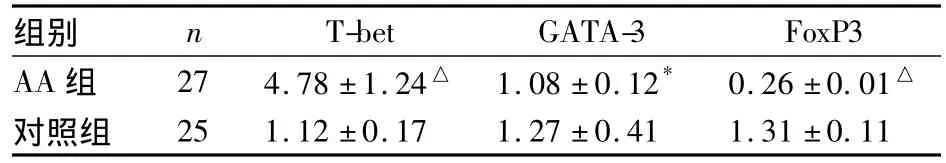
表2 两组转录因子T-bet、GATA-3、FoxP3 mRNA相对表达量比较(±s)
注:与对照组比较,*P<0.05,△P <0.01
组别 n T-bet GATA-3 FoxP3 AA组 27 4.78±1.24△ 1.08±0.12* 0.26±0.01△对照组25 1.12±0.17 1.27±0.41 1.31±0.11

注:与对照组比较,*P<0.05,△P <0.01
2.3 两组血浆IFN-γ和IL-4水平比较 AA组血浆中IFN-γ水平及IFN-γ/IL-4高于对照组(P均<0.01)。见表4。
表4 两组血浆IFN-γ和IL-4水平比较(±s)
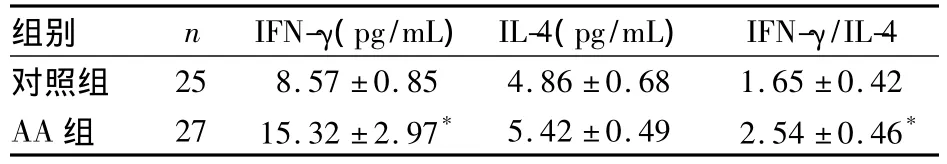
表4 两组血浆IFN-γ和IL-4水平比较(±s)
注:与对照组比较,*P<0.01
组别 n IFN-γ(pg/mL)IL-4(pg/mL) IFN-γ/IL-4对照组25 8.57±0.85 4.86±0.68 1.65±0.42 AA组 27 15.32±2.97* 5.42±0.49 2.54±0.46*
3 讨论
AA的发病机制除与造血干细胞本身缺陷、造血微环境损伤有关外,免疫异常是一个绝对不可忽视的因素。现有学者认为,大多数患者发病与自身免疫反应导致的造血干细胞受损有关。国内外研究结果表明,AA患者外周血中Th1细胞及Th1/Th2均明显高于正常对照人群[5],即 AA患者 Th1、Th2之间的分化平衡被打破,并发展为Th1型优势的免疫应答,存在Th1细胞的过度分化和Th1型细胞因子的过度分泌。研究发现,T-bet是Th1特异的转录因子[6],不仅控制 Th1细胞特征性细胞因子 IFN-γ的表达,且抑制Th2细胞特征性细胞因子IL-4的合成[7]。GATA-3则是Th2细胞特异性转录因子,能抑制IFN-γ的表达,促进Th2细胞特征性细胞因子IL-4等的产生。FoxP3(叉状头/翅膀状螺旋转录因子P3)是调节性T细胞特异性的转录因子,目前被公认为是调节性T细胞最具有特异性的分子标志物调节性T细胞能独立表达Foxp3 mRNA。Foxp3对调节性T细胞是一正向调节蛋白,可以调节调节性T细胞的发育和功能效应,参与了免疫耐受的分子机制[8]。因此,细胞特异性转录因子T-bet、GATA-3与FoxP3共同调节Th细胞的极性分化。本研究结果显示,与对照组相比,AA组的T-bet显著升高,表明AA组患者PBMC中T-bet mRNA相对表达水平显著高于对照组表达水平。GATA-3和FoxP3降低,表明AA组患者外周血单个核细胞GATA-3和FoxP3 mRNA相对表达水平显著低于对照组表达水平。
本研究结果表明,AA存在T淋巴细胞亚群的功能紊乱及B淋巴细胞增殖活化;表现为调节性T细胞的减低,其特异性的转录因子FoxP3 mRNA表达下调,调节性T细胞的减少并由此引起免疫抑制效应不足可能是AA发生的重要原因之一,但AA发生、发展的详细分子机制尚需进一步深入研究。
[1]Kakagianni T,Giannakoulas NC,Thanopoulou E,et al.A probable role for trail-induced apoptosis in the pathogenesis of marrow failure,implications from an in vitro model and from marrow of aplastic anemia patients[J].Leuk Res,2006,30(6):713-721.
[2]邵宗鸿,袁烨.再生障碍性贫血免疫发病机制及免疫治疗[J].中国实用内科杂志,2006,26(4):16-19.
[3]Solomou EE,Keyvanfar K,Young NS.T-beta Th1 transcription factor,is up-regulated in T cells from patients with aplastic anemia[J].Blood,2006,107(10):3983-3991.
[4]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:19-21.
[5]张强,翟志敏,李庆,等.再生障碍性贫血患者外周血Th1/Th2水平测定及其临床意义[J].实用医学杂志,2008,24(18):3176-3178.
[6]Szabo SJ,Kim ST,Costa GL,et al.A novel transcription factor,T-bet,directs Th1 lineage commitment[J].Cell,2000,100(6):655-669.
[7]Rengarajan J,Szabo SJ,Glimcher LH.Transcriptional regulation of Th1/Th2 polarization[J].Immunol Today,2000,21(10):479-483.
[8]Wuest TY,Willette-Brown J,Dururn SK,et al.The influence of IL-2 family cytokines on activation and function of naturally occurring regulatory T cells[J].J Leukoc Biol,2008,84(4):973-980.

