超声在评价大鼠酒精性脂肪肝模型中的应用
李晓娟,张大鹍,隋丽华,白冰珂,李瑞生
(1.解放军第302医院实验技术研究保障中心,北京 100039;2.解放军第302医院医学影像中心,北京 100039;3.军事医学科学院实验动物中心,北京 100071)
酒精性肝病(alcoholic liver disease,ALD)[1]是一种由于长期过度饮酒引起的中毒性肝脏疾病。其中酒精性脂肪肝属于一种可逆转的良性肝脏疾患,但若不及时治疗则可向酒精性肝炎、肝硬化进展[2]。研究表明平均每年约有12%的酒精性脂肪肝患者转变成肝硬化[3]。虽然国内外已经对酒精性脂肪肝的发病机制进行了大量的研究,但其发病机制及病理过程尚不完全清楚,因此建立可重复、简单易行且稳定的动物模型显得尤为重要。目前临床上公认的脂肪肝诊断的金标准是肝穿刺病理学诊断,但由于其具有创伤性,很难作为临床和筛查的有效方法[4]。而体外超声具有无创伤、操作简便、可控性好等优点,可以作为诊断和筛查酒精性脂肪肝的有效方法。本实验通过酒精灌胃来建立SD大鼠酒精性脂肪肝模型,利用超声技术来实时监测造模进展,成模后取肝组织进行病理学模型鉴定,旨在建立一种简单易行、稳定可靠、实时监控的大鼠酒精性脂肪肝模型的鉴定方法,为今后研究酒精性脂肪肝的发病机制以及药物治疗提供了良好的模型动物。
1 材料与方法
1.1 实验动物
实验动物选择军事医学科学院实验动物中心SPF级SD大鼠40只,雄性,单鼠体质量190~200 g,实验动物生产许可证【SCXK(军)2007—004】;本实验室具有SPF级实验动物使用许可证【SYXK(军)2007—010】。
1.2 试剂及饲料
乙醇(分析纯,纯度 >99.7%),北京化工厂(批号:20120201);生理盐水来自解放军第302医院制剂室;大鼠饲料由军事医学科学院实验动物中心饲料室提供。
1.3 动物分组及模型制备
SD大鼠在本中心SPF级屏障环境饲养,动物自由饮水、采食正常饲料,1周后随机分为两组:正常对照组(n=20)和模型组(n=20)。模型组造模方法:按每周测定的体重计算剂量(10 g/kg),每日早晚各1次乙醇灌胃,2次灌胃时间需间隔8 h。第1周乙醇灌胃浓度为40%,第2和3周分别递增为45%和50%,第4周开始乙醇浓度为55%持续灌胃直至12周(2次/d),而正常对照组给予等量生理盐水灌胃。
1.4 大鼠肝脏超声监测
造模后第4、8和12周分别对模型组和对照组大鼠进行超声监测。方法是采用速眠新(0.5 mL/kg)将SD大鼠麻醉后仰卧,固定四肢,腹部被皮,涂上耦合剂进行超声监测,在肋间横切面分别测量大鼠的肝左叶厚度及左叶长度。诊断脂肪肝的超声标准为[5]:①肝区近场弥漫性点状高回声,回声强度高于脾脏和肾脏,少数表现为灶性高回声;②远场回声衰减,光点稀疏;③肝内管道结构显示不清;④肝脏可轻至中度肿大,肝前缘变钝。根据超声图像检测结果进行对比,以分析酒精性脂肪肝模型的动态发展进程。
1.5 大鼠肝脏病理学检查
每次超声监测后从模型组和对照组动物中各选取3只大鼠,处死后采其肝脏组织。12周后两组剩余大鼠全部采其肝脏组织,于4%甲醛溶液中固定,常规脱水、石蜡包埋、切片和HE染色,光学显微镜下行组织形态学观察,以确诊酒精性脂肪肝模型的病理学变化。
1.6 分析超声与病理检查结果的关系
将第4、8和12周模型组与对照组动物的超声影像结果与同期病理学诊断结果进行对应分析,以确定超声与病理检查结果是否具有一致性。
2 结果
2.1 肝脏超声检查结果分析
第4、8和12周时超声检查对照组大鼠肝脏均出现包膜光滑,显影清晰,肝脏实质回声稍低,分布均匀,肝脏与肾脏对比明显,无脂肪变性。而模型组大鼠第4周时肝脏比对照组大鼠的超声图像表现为近场回声稍增强,远场衰减不明显,显示稍有脂肪变性。第8周时肝脏肿大,肝前缘变钝,可见条状、线状中强回声,门脉管壁回声增强,声像图表现近场回声增强,远场明显衰减,提示已有脂肪病变。而至12周时肝脏脂肪病变更加明显,提示酒精性脂肪肝模型已造模成功,14只大鼠有12只成模,死亡2只。在造模过程中其肝脏实质回声逐渐增强,与肾脏回声的对比逐渐变得不明显,甚至肝脏回声高于肾脏回声(图1)。
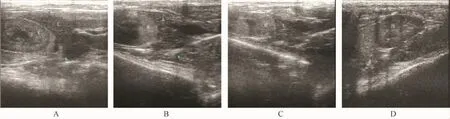
注:A:对照组第4周超声图;B:模型组第4周超声图;C:模型组第8周超声图;D:模型组第12周超声图;L:肝脏;K:肾脏。图1 不同时期超声监测结果Note:A:Ultrasonogram of a control rat at the forth week;B:Ultrasonogram of a model rat at the forth week;C:Ultrasonogram of a model rat at the eighth week;D:Ultrasonogram of a model rat at the twelfth week;L:Liver;K:Kidney.Fig.1 Results of ultrasound observation in different periods

表1 两组不同周龄肝组织超声与病理检测结果对比分析Tab.1 Comparative analysis of the results of ultrasonic and pathological examination at different weeks between the control and model groups
2.2 肝脏病理学检查结果分析
对照组大鼠第4、8周时肝组织病理学分析无脂肪病变,第12周时偶见有散在脂肪滴。模型组大鼠第4周时肝组织出现少量圆形空泡,略有脂肪病变。第8周时脂肪变性的肝细胞明显增多,汇管区域出现炎症细胞浸润,显示为轻度脂肪肝。第12周时肝小叶轮廓出现模糊,肝细胞体积变大,细胞浆内有大量大小不等的圆形空泡,汇管区伴有大量炎性细胞浸润,脂肪变性的肝细胞占大部分,呈现重度脂肪病变(图2见封二)。
2.3 肝组织超声与病理检查结果对比分析
对照组和模型组大鼠第4、8、12周时肝组织的超声监测结果与对应同组同期大鼠肝组织病理切片检测结果对比分析显示:超声可以监测到模型组大鼠肝脏脂肪病变从轻度到重度的演变过程以及对照组大鼠无脂肪病变过程,且与肝组织的病理学诊断结果相一致(表1)。
3 讨论
体内摄入的酒精主要是在肝脏中进行分解代谢,马晓茜等[6]研究证实长期大量饮酒有10% ~20%可发生不同程度的酒精性肝病。为了了解酒精性脂肪肝的发病原因研究者建立了许多动物模型来研究其发病机制,Tsukamoto H等[7]利用胃造瘘持续给Tsukamata-French大鼠注入含乙醇的液体饲料方法建立了ALD动物模型,但由于其手术操作复杂,价格昂贵,限制了其推广应用。古赛等[8]建立了大鼠慢性酒精性脂肪肝动物模型,符合人类的饮酒方式,避免了大鼠对酒精的排斥性,并且可以维持酒精在血液中的高浓度,与人类发病过程比较相似。刘莉等[9]利用 Wistar大鼠证实了茶多酚通过抑制酒精性肝病核因子 κB和环氧合酶2表达水平,对肝损伤起到了一定的保护作用。薛晓伟等[10]实验证实了槲芪散对小鼠的酒精性肝损伤也具有一定的干预作用。Song BJ 等[11]、李巍等[12]、楼琦等[13]对酒精性脂肪肝和非酒精性脂肪肝的发病机制、病理学观察及疾病预防等进行了深入的探讨与分析。
目前实验室诊断脂肪肝的标准是肝穿刺病理学检测,但由于其具有一定的创伤性和动物福利的制约受到了限制。因此,本实验通过酒精性脂肪肝动物模型来研究超声检查技术在动物脂肪肝诊断方面的应用。刘云霞等[14]认为增强CT难以区分轻度脂肪肝和正常脂肪肝;而超声诊断脂肪肝的灵敏度、特异性和安全性较高,该方法方便、经济、快速、无创等优点已在人脂肪肝诊断中得到了大量的验证[15]。实验通过酒精灌胃的方法持续12周来建立大鼠酒精性脂肪肝模型,在造模过程中利用超声技术来实时监测:模型组4周时肝脏脂肪变性不明显;8周时形成轻度脂肪肝,12周时已出现了明显的脂肪变性,在整个造模过程中显示脂肪病变从无到有,可动态地观察到酒精性脂肪肝形成的渐变过程,而对照组动物均无脂肪病变。为了验证其诊断的准确性,分别对模型组和空白组4、8和12周大鼠进行了病理学分析,模型组4周时肝细胞内脂肪滴少,8周时肝细胞中脂肪滴逐渐增多,至12周时已出现典型的脂肪变性,提示造模成功。这与超声诊断结果具有一致性,说明了超声检测技术可以对大鼠酒精性脂肪肝病变进行有效地监测。
总之,本实验利用超声技术来实时监测酒精灌胃法造模进展,成功地建立了大鼠酒精性脂肪肝动物模型,并利用病理学方法验证了其检测结果的准确性和可靠性,从而证实了超声技术能够很好的反映出脂肪肝的动态变化进程,该方法对酒精性脂肪肝造模过程可以进行实时监控,方便快捷,避免了在造模过程中对活体动物采样所造成的损伤以及处死动物进行病理学检测等缺点,影响了模型的进一步研究。该技术的应用为今后酒精性脂肪肝动物模型的建立提供了一种更方便的鉴定方法,同时也为进一步研究酒精性脂肪肝动物模型的发病机制和药物筛选提供了保障。
[1]张伟,洪汝涛,田图磊.大鼠酒精性脂肪肝模型的建立[J].安徽医药,2012,16(7):885-887.
[2]张文缓,张国顺,田广利,等.超声在评价牛磺酸保护酒精性脂肪肝中的应用[J].中国超声医学杂志,2010,26(3):207-210.
[3]Bugianesi E,bLeone N,bVanni E,bet al.Expanding the natural history of nonalcoholic steatohepatitis:from cryptogenic cirrhosis to hepatocellular carcinoma[J].Gastroenterology,b2002,b123(1):134-140.
[4]陈焕永,陈晓红,周慧,等.脂肪肝和病毒性肝炎 B超影像学特点分析 [J].哈尔滨医科大学学报,2001,35:369-370.
[5]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪肝病诊断标准[J].中华肝脏病杂志,2003,11:71-73.
[6]马晓茜.大鼠酒精性肝损伤模型的制备及观察[J].山东医学高等专科学校学报,2011,33(2):81-83.
[7]Tsukamoto H,Towner SJ,Ciofalo LM,et al.Ethanol induced liver fibrosis in rats fed with high fat diet[J].Hepatology,1986,6(5):814.
[8]古赛,蒋小黎,何琳,等.大鼠慢性酒精性脂肪肝模型的建立[J].重庆医科大学学报,2006,31(1):81-84.
[9]刘莉,管小琴,李芬,等.茶多酚对酒精性肝病大鼠核因子κB及环氧合酶2表达的影响[J].中国实验动物学报,2008,16(3):209-213.
[10]薛晓伟,丰平,董坤,等.槲芪散对小鼠酒精性肝损伤的干预作用[J].实验动物科学,2010,27(4):27-32.
[11]Song BJ,Moon KH,Olsson NU,et al.Prevention of alcoholic fatty liver and mitochondrial dysfunction in the rat by long-chain polyunsaturated fatty acids[J].J Hepatol,2008,49(2):262 -273.
[12]李巍,石巧娟,郭红刚,等.三种啮齿类动物非酒精性脂肪肝形成及机制探讨[J].中国实验动物学报,2012,20(1):76-80.
[13]楼琦,石巧娟,郭红刚,等.非酒精性脂肪肝大鼠脂质代谢及病理变化的动态观察[J].中国比较医学杂志,2012,22(3):5-11.
[14]刘云霞,王洁贞,刘建平,等.脂肪肝影像学诊断性试验的系统评价[J].中国医学科学院学报,2004,26(5):580-584.
[15]林江莉,汪小毅,李德玉,等.脂肪肝B超图像特征提取研究[J].四川大学学报,2005,37:130-134.

