滁菊活性成分的低温浸提及其对α-葡萄糖苷酶活性的抑制作用
孙艳辉,李京皖,贾小丽,龚建国
(1.滁州学院生物与食品工程学院,安徽滁州239012;2.滁州市金玉滁菊生态科技有限公司,安徽滁州239000)
滁菊(Chuju Chrysanthemum morifolium)是菊科菊属的一个栽培种,是安徽省滁州的传统特产,又名“甘菊”、“白菊”等,为中国“四大名菊”之一,已通过中国名牌农产品和地理标志产品认证。滁菊性温和,气味清香,既可入药,又可作清凉饮料[1]。滁菊富含黄酮类化合物和多酚类化合物等有效成分[2]。黄酮和多酚类物质多具有抑制α-葡萄糖苷酶活性的作用,在治疗餐后高血糖症、提高糖耐量和缓解高胰岛素血症等方面具有潜力[3]。已有的报道多集中在对滁菊总黄酮的提取分离纯化等方面[4-6],而对以制备滁菊饮料为目的提取工艺研究及其对α-葡萄糖苷酶活性的抑制作用尚未见报道。高温浸提可提高生产效率和提取率,是活性成分提取过程中经常采用的工艺。高温浸提条件下,有益物质大量溶出的同时,一些在低温下不易溶出的蛋白质、果胶等杂质也被大量溶出,增加提取液过滤难度,并且更容易引起茶饮料的冷后浑浊。另外,高温浸提不但增加了能耗,而且不利于浸出茶汁色泽保持[7-8]。低温浸提可以避免这些问题的发生,同时减少了生产成本[9]。因此,本研究采用单因素及正交实验设计方法,探讨滁菊低温浸提工艺,同时考察滁菊浸提液对α-葡萄糖苷酶活性的抑制作用,为滁菊饮料产业化提供技术支持。
1 材料与方法
1.1 材料与仪器
滁菊 由滁州市金玉滁菊生态科技有限公司提供,4℃保存;α-葡萄糖苷酶 上海佳和生物科技有限公司;pNPG 美国Sigma公司;芦丁 标准分析品,中国药品生物制品检定所;焦性没食子酸、亚硝酸钠、硝酸铝、氢氧化钠、酒石酸钾钠、七水硫酸亚铁、磷酸氢二钠、磷酸二氢钠均为分析纯 天津市科密欧化学试剂有限公司。
JJ200型电子天平 美国双杰兄弟(集团)有限公司;721型可见分光光度计 上海佑科仪器表有限公司;数显恒温水浴锅 金坛市瑞尔电器有限公司;玻璃仪器气流烘干器 长城科工贸有限公司。
1.2 实验方法
1.2.1 滁菊的低温浸提 滁菊干燥粉碎过40目筛,准确称取一定质量的滁菊,按比例加入纯水,在一定温度下振荡提取一定时间,抽滤,将滤液定容,得到提取液。
1.2.2 滁菊总黄酮及总多酚得率的测定
1.2.2.1 总黄酮及总多酚标准曲线的绘制 总黄酮含量测定[10-11]采用亚硝酸钠-硝酸铝比色法,以芦丁为标样,在510nm处测定,绘制得到标准曲线为:A1=0.1876C1-0.014,R2=0.9998,式中 A1为样品在510nm处的吸光度,C1为样品浓度(mg/mL)。
总多酚含量测定[12-13]采用酒石酸亚铁比色法,以焦性没食子酸为标样在540nm处测定,绘制得到标准曲线为:A2=0.3208C2-0.0154,R2=0.9992。式中A2为样品在540nm处的吸光度,C2为样品浓度(mg/mL)。
1.2.2.2 总黄酮及总多酚得率的测定 对1.2.1中的提取液按1.2.2.1方法进行测定,计算总黄酮类物质、总多酚含量,并按式(1)、式(2)计算得率。

式中,V1为供试液体积(mL),C1为样品浓度(mg/mL),m为滁菊粉末质量(g),2.5为测定时吸取提取液的体积(mL)。

式中,V2为供试液体积(mL),C2为样品浓度(mg/mL),m为滁菊粉末质量(g),5为测定时吸取提取液的体积(mL)。
1.2.3 滁菊活性成分浸提工艺的优化
1.2.3.1 浸提时间的影响 称取7份2.00g干燥粉碎的菊花置于7个烧杯中,加40mL水,50℃恒温振荡浸提,每20min取出一个烧杯,抽滤得滤液定容至100mL。按1.2.2.2方法测定得率。每个实验重复3次。
1.2.3.2 浸提温度的影响 称取9份2.00g干燥粉碎的菊花置于9个烧杯中,加40mL水,分别在30、35、40、45、50、55、60、65、70℃水浴中,恒温振荡浸提 1h,抽滤,滤液定容至50mL,按1.2.2.2方法测定提取率。每个实验重复3次。
1.2.3.3 液固比的影响 称取5份2.00g干燥粉碎的菊花置于5 个烧杯中,依次加20、40、60、80、100mL 水,50℃恒温振荡浸提1h,抽滤得滤液定容至100mL。按1.2.2.2方法测定提取率。每个实验重复3次。
1.2.3.4 正交实验优化浸提工艺 以滁菊总黄酮及总多酚含量为考察指标,选择浸提温度、浸提时间和液固比作为考察的三个影响因素,在不考虑交互作用情况下进行正交实验设计,因素水平见表1。
1.2.4 α-葡萄糖苷酶抑制活性研究 α-葡萄糖苷酶抑制活性测定参照张丽的研究方法略有改进[14]。1mL 0.2U/mL α-葡萄糖苷酶溶入磷酸钾缓冲液(pH6.8)5mL,1mL 样品溶液,37℃ 恒温 15min,加入2.5mmol/L PNPG 0.2L,37℃恒温反应 15min,再加入0.2mol/L Na2CO3终止液 2mL,稀释至 10mL测定405nm处的吸光度。每个实验重复3次。
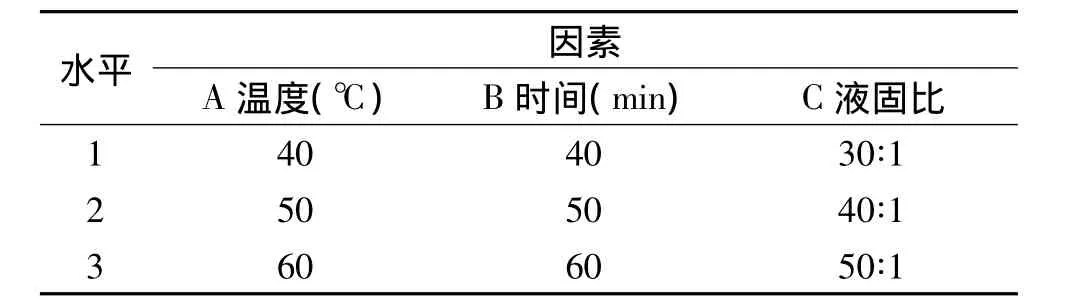
表1 正交实验因素及水平表Table 1 Factors and levels of orthogonal experiments
1.2.5 数据统计分析 采用Microsoft office Excel 2003软件绘制表格和图形,采用正交设计助手3.1进行显著性方差分析。
2 结果与分析
2.1 浸提时间对提取效果的影响
浸提时间对滁菊活性成分浸提效果的影响如图1所示。随浸提时间的增加黄酮类物质及多酚类物质的得率先增加后减少,60min时二者的得率相对较高。这可能是在浸提初始时细胞内外存在溶质浓度差,浸提一段时间后,细胞内外溶质达到平衡;浸提时间过长溶质分解导致浸提液中溶质含量降低。所以后续的单因素实验选定提取时间为60min。
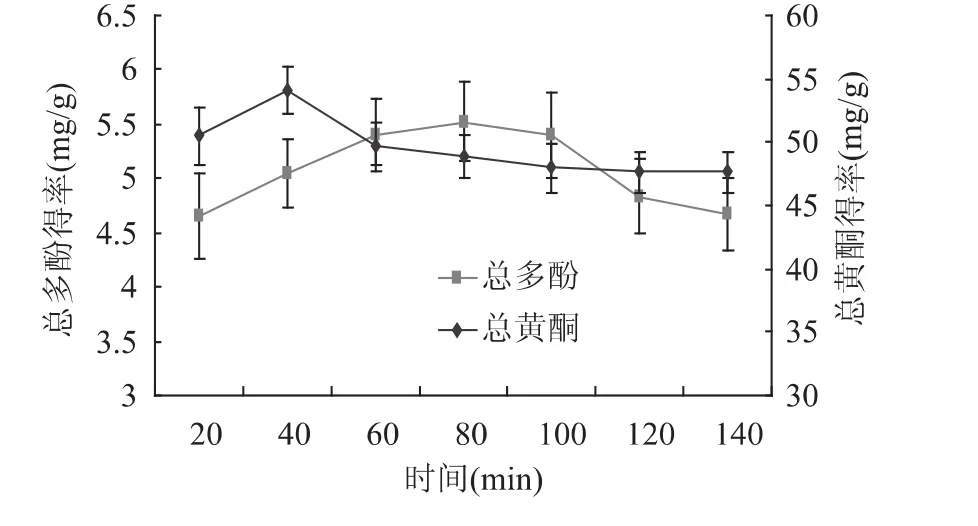
图1 浸提时间对滁菊活性成分得率的影响Fig.1 Effect of extract time on extraction rate of Chuju Chrysanthemum morifolium
2.2 浸提温度对提取效果的影响
浸提温度对滁菊活性成分浸提效果的影响如图2所示。由图2可知,随浸提温度的增加二者得率均逐渐增加,这主要是因为温度升高,加速分子运动,能够促使有效物质的溶出。但70℃以上由于温度较高黄酮类物质及多酚类物质可能会发生氧化反应,同时引起杂质的溶出。所以,后续的单因素实验选定60℃为浸提温度。
2.3 液固比对提取效果的影响
液固比对滁菊活性成分得率的影响如图3所示。由图3可知,随着液固比的增加,总黄酮和总多酚的得率均增加;液固比在30∶1时总多酚的得率趋于稳定、液固比达到40∶1时总黄酮的得率趋于稳定。这可能是滁菊粉末一定的情况下,溶剂量的增加使得样品颗粒周围溶质浓度降低,增大了细胞内外两侧的浓度差,从而促进滁菊有效成分的溶出[15]。所以40∶1为最优液固比。

图2 浸提温度对滁菊活性成分得率的影响Fig.2 Effect of extract temperature on extraction rate of Chuju Chrysanthemum morifolium
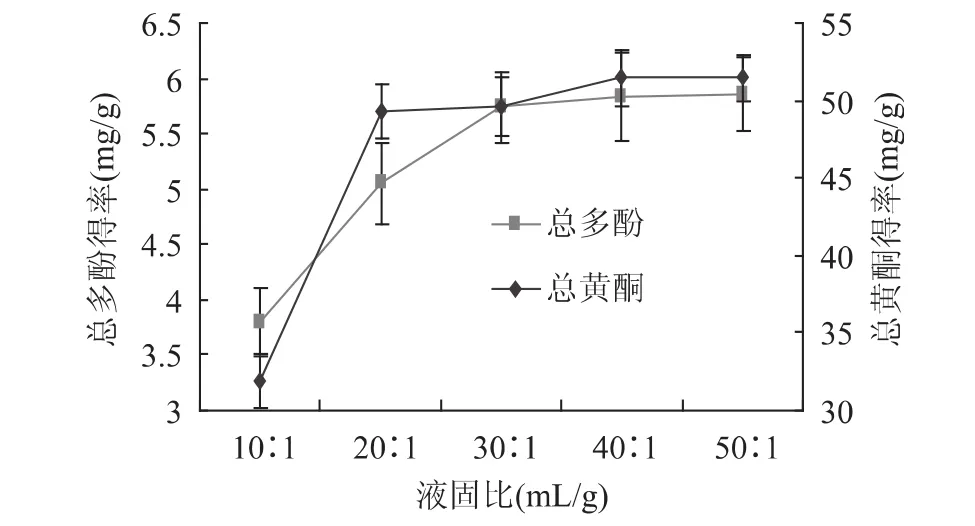
图3 液固比对滁菊活性成分得率的影响Fig.3 Effect of the ratio of liquid to solid on extraction rate of Chuju Chrysanthemum morifolium
2.4 正交实验优化浸提工艺
以滁菊总黄酮及总多酚含量为考察指标,以浸提温度、浸提时间和液固比作为变量,进行正交实验设计[10],因素水平见表1,实验方案及结果见表2。
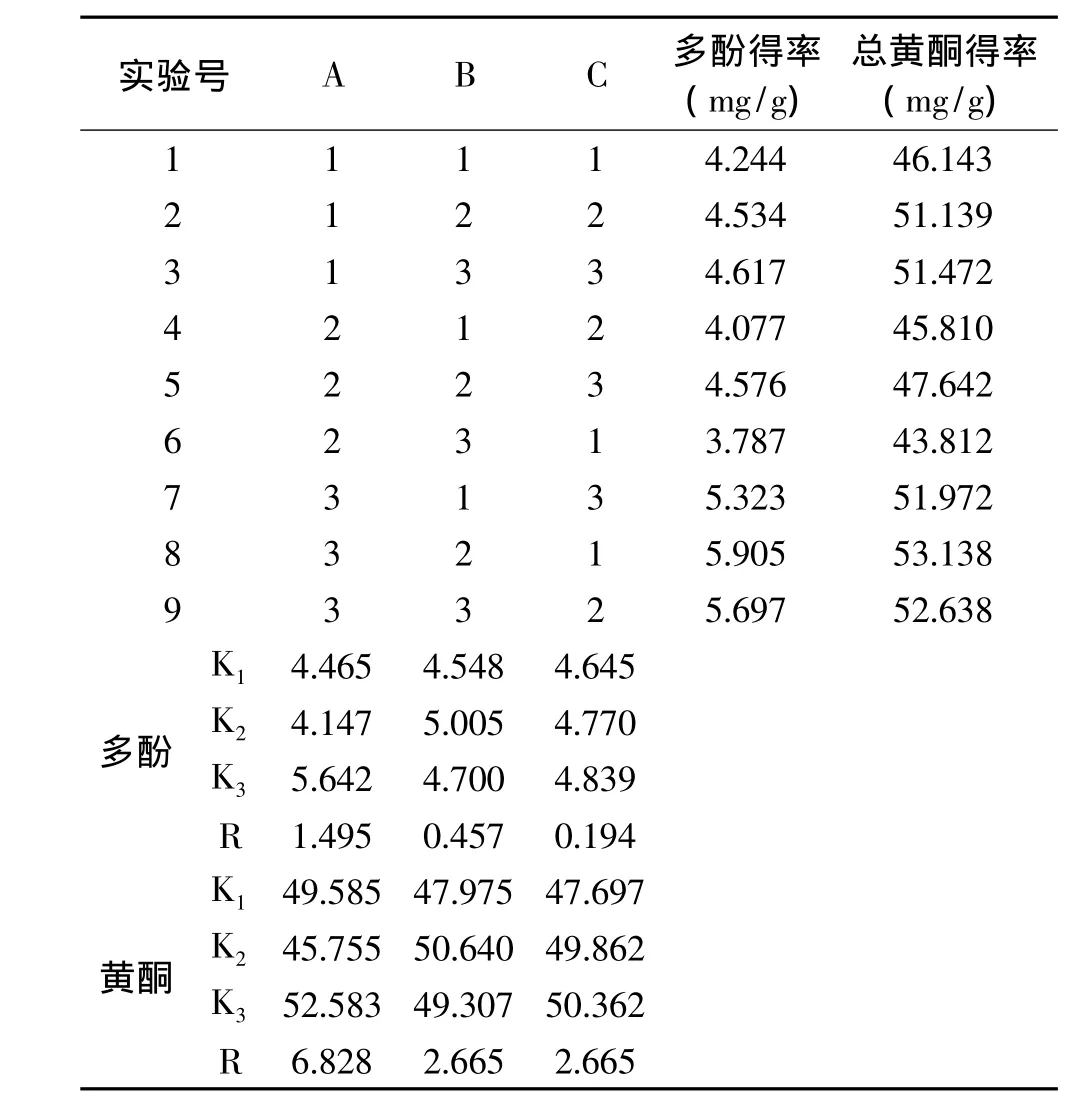
表2 正交实验结果与极差分析表Table 2 Result of orthogonal experiments and extreme difference analysis
对正交实验结果进行极差分析,结果如表2所示,在低温浸提滁菊总多酚及总黄酮的影响因素中,影响大小为 A >B>C,最优水平为 A3、B2、C3。方差分析结果如表3、表4所示,三个影响因素中,温度的影响显著,其他两个因素不显著。考虑到液固比对实验结果影响不显著和液固比增大使浓缩成本增加,采用A3B2C1工艺,即用60℃按30∶1的液固比浸提50min为最佳工艺,在此条件下总多酚得率最高可达到5.905mg/g、总黄酮得率可达到53.138mg/g。
2.5 滁菊浸提液对α-葡萄糖苷酶活性的抑制作用
滁菊浸提液对α-葡萄糖苷酶活性的抑制作用如图4所示。由图4可以看出,滁菊浸提液对α-葡萄糖苷酶活性具有很强的抑制作用,并且随着滁菊浸提液浓度增加,抑制作用增加。当滁菊浸提液浓度为10μg/mL时,对 α-葡萄糖苷酶的抑制率为8.5%,100μg/mL时,抑制率达到97.3%。滁菊浸提液对α-葡萄糖苷酶活性的IC50为32μg/mL。
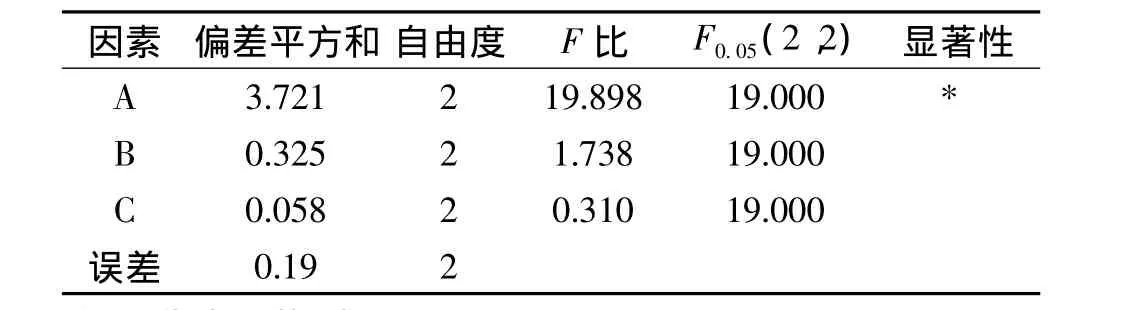
表3 总多酚正交实验结果的方差分析Table 3 Results of variance analysis of total polyphenol
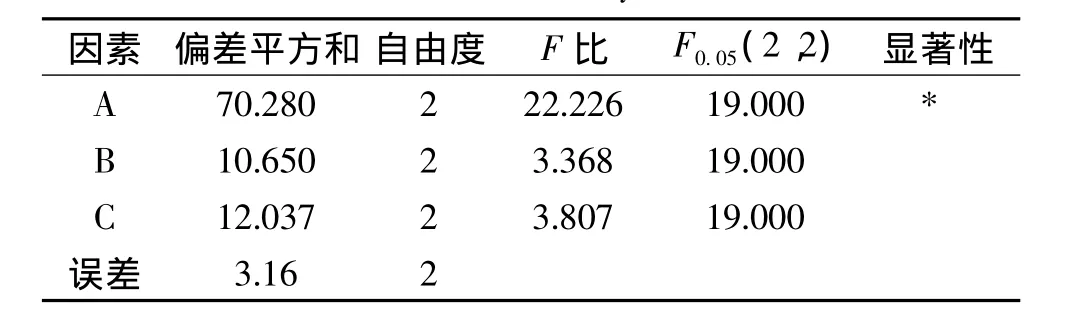
表4 总黄酮正交实验结果的方差分析Table 4 Results of variance analysis of total flavonoids
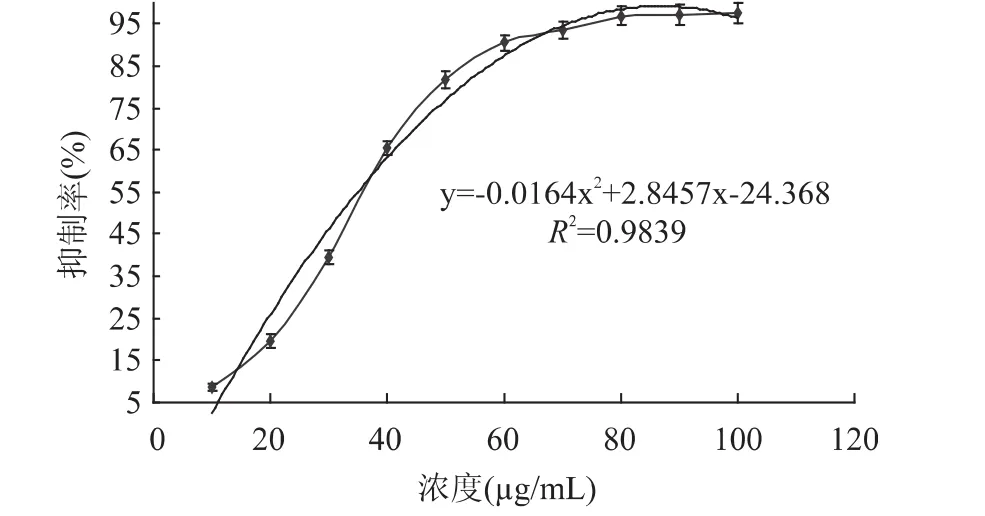
图4 滁菊浸提液对α-葡萄糖苷酶活性的抑制作用Fig.4 Inhibitory activities of Chuju Chrysanthemum morifolium extract against α-glucosidase
3 结论
通过单因素实验和正交实验,得出影响低温浸提滁菊效果的因素依次为浸提温度>浸提时间>液固比,从成本角度考虑,最优浸提工艺为浸提时间50min、浸提温度60℃、液固比为30∶1。在此工艺条件下,总多酚及总黄酮最高得率分别为 5.905、53.138mg/g。滁菊浸提液对α-葡萄糖苷酶活性的IC50为32μg/mL。本研究为滁菊饮料开发提供了理论依据和技术支持。
[1]国家药典委员会.中华人民共和国药典2005年版第一部[S].北京:化学工业出版社,2005:218.
[2]贾凌云,孙启时,黄顺旺.滁菊花中黄酮类化学成分的分离与鉴定[J].中国药物化学杂志,2003,13(3):159-161.
[3]聂莹,陈俊帆,苏东海,等.α-葡萄糖苷酶抑制剂的研究进展及食品源抑制剂的开发前景[J].农产品加工·学刊,2012(3):18-23.
[4]王松,鲍方印,郑玉华.滁菊中黄酮类化合物提取方法的优化[J].食品科学,2010,31(12):80-82.
[5]卫强,汪庆健.滁菊中茎、叶中总黄酮的提取工艺研究[J].中兽医医药杂志,2009(1):39-40.
[6].袁敏,刘道芳.正交实验优选滁菊总黄酮的提取工艺[J].安徽医药,2006,10(8):569-570.
[7]安凤平,刘燕,宋江良.白茶低温浸提工艺[J].福建农林大学学报:自然科学版,2010,39(6):595-599.
[8]史玉汉,罗栋源,万端极.速溶红茶粉的低温浸提工艺[J].食品研究与开发,2010,31(10):71-74.
[9]李凤娟,丁兆堂,杜金华.低温浸提茶汁的最优工艺条件[J].食品与发酵工业,2004,30(4):114-116.
[10]梁新红,赵功玲,赵瑞香.分光光度法测定仙人掌酒中总黄酮含量[J].中国酿造,2007(6):67-69.
[11]赵佳,霍俊伟.蓝果忍冬总黄酮提取工艺研究[J].食品工业科技,2010,31(11):243-244.
[12]王丽珠,吴棱,姚元根,等.酒石酸亚铁分光光度法测定茶多酚[J].光谱实验室,1997,14(3):26-29.
[13]胡玲玲,韩丽丽,张超霞,等.茶叶废料中茶多酚提取工艺优化研究[J].广东化工,2011,38(6):30-31.
[14]张丽,李彩芳,李晓梅,等.加拿大蓬α-葡萄糖苷酶的抑制作用[J].河南大学学报:医学版,2008,27(4):39-41.
[15]王倩,常丽新,贾长虹,等.狗枣猕猴桃叶黄酮提取工艺的研究[J].食品工业科技,2011,32(5):235-237.

