黄连粉末中盐酸小檗碱及盐酸药根碱的体内肠吸收特性*
魏世超, 徐丽君, 邹 欣, 陆付耳, 王开富
华中科技大学同济医学院附属同济医院1药学部,2中西医结合研究所,武汉 430030
黄连用于治疗消渴症(相当于现代医学的糖尿病)已有两千多年的历史[1],形成了系统的理论,积累了丰富的临床经验。我们检索发现:冠名“黄连丸”治疗消渴症的古方就有15种之多,而且在这些方药中均以黄连为主药且以其粉末制丸。诸多研究表明,小檗碱(Berberine)、药根碱(Jatrorrhizine)是目前黄连治疗2型糖尿病最受关注的有效成分,盐酸小檗碱现已广泛应用于2型糖尿病的治疗[1-5]。据报道,盐酸小檗碱高达95%未被小肠吸收,其口服应用时,有效剂量较大[4-7],这一缺陷被临床医师戏称 “吃药如同吃饭”,且由于可能破坏肠道菌丛的平衡而严重限制了其临床应用。该系列研究结果似乎与古方黄连丸剂在糖尿病(消渴症)中的广泛应用形成了矛盾。因此,本研究采用大鼠体内肠灌注实验,研究大鼠小肠对黄连粉末中盐酸小檗碱、盐酸药根碱的肠吸收特性,从一个侧面探讨黄连粉末治疗消渴症的科学性。
1 材料与方法
1.1 主要仪器
Waters高效液相色谱(HPLC)仪(600泵,717自动进样器,2457荧光检测器,Waters公司,美国);Waters色谱工作站;SK-2200LH 超声波清洗器(无锡建仪实验器材有限公司);紫外分光光度计(U-1900,日本岛津公司);HL-2型恒流泵(上海卢西分析仪器厂有限公司);BT25-型电子天平(日本岛津公司);恒温循环水浴锅(Grant Y14-VFP,英国);2-16K台式高速离心机(德国Sigma公司);中药粉碎机(WARING 24CB10C,美国)。
1.2 动物与试药
1.2.1 动物 Wister大鼠,SPF级,雌雄各半,体质量(256.3±13.6)g,华中科技大学同济医学院实验动物学部提供,合格证号:SYXK(鄂)2010-0057。
1.2.2 试药 黄连由武汉中药饮片厂提供,经湖北中医药大学鉴定本品为毛茛科植物黄连(Coptis ChinensisFranch)的干燥根茎;盐酸小檗碱对照品(批号:110713-200208,99.0%,中国药品生物制品检定所);盐酸药根碱对照品(批号:120756-200808,98.0%,中国药品生物制品检定所);乌拉坦(批号:1700063-50G,含量98%,广州威佳科技有限公司);酚红(美国AMRESCO公司);甲醇、乙腈均为色谱纯;磷酸二氢钾、磷酸二氢钠、十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)及其他试剂均为分析纯;水为超纯水。
1.3 溶液的配制
1.3.1 酚红贮备液 精密称取酚红25mg置50 mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得。
1.3.2 Kerbs-Ringer营养液(K-R营养液) 参照文献[8]制备。分别取氯化钠7.8g,氯化钾0.35g,氯化钙0.37g,碳酸氢钠1.37g,磷酸二氢钠0.32 g,氯化镁0.02g,葡萄糖1.40g,置于1L容量瓶中,蒸馏水溶解,稀释至刻度,即得。
1.3.3 模拟胃液 精密称取胃蛋白酶3.20g,氯化钠2.00g置于100mL容量瓶中,加蒸馏水溶解,用10%稀盐酸调pH至1.2,定容,即得。
1.3.4 模拟肠液 参照文献[9]制备。精密称取0.68g磷酸二氢钾,1.00g胰蛋白酶置于100mL容量瓶中,加蒸馏水溶解,用氢氧化钠溶液调pH至7.6,定容,即得。
1.4 酚红、盐酸小檗碱与盐酸药根碱含量测定时检测波长的选择
分别用K-R营养液配制24.75mg/L盐酸小檗碱、5.80mg/L 盐酸药根碱对照品溶液和 18.00 mg/L的酚红溶液(取0.5mL酚红贮备液加0.2 mol/L的氢氧化钠溶液5mL显色)。分别取上述溶液和K-R营养液肠循环2.5h后所得的空白肠循环液,在200~700nm处进行紫外扫描。结果显示,在酚红吸收峰(558nm)处,盐酸小檗碱、盐酸药根碱及空白肠循环液均无吸收干扰;而在盐酸小檗碱和盐酸药根碱吸收峰(345nm)处,酚红及空白肠循环液亦无吸收干扰。故用紫外分光光度法测定酚红的浓度时选择558nm波长;而用HPLC测定盐酸小檗碱和盐酸药根碱的浓度时选用345nm检测波长。
1.5 肠循环液中酚红的测定
1.5.1 酚红标准曲线的绘制 方法参照文献[10-11]。精密量取酚红贮备液适量,用K-R营养液配制成1.25、2.50、5.00、10.00、20.00、40.00mg/L的系列溶液,分别精密量取0.5mL,加入0.2mol/L NaOH溶液5mL,摇匀,在558nm波长处测定吸光度值Y,以Y对质量浓度(C,mg/L)进行线性回归,得标准曲线方程:Y酚红=0.013 2C-0.0127,r=0.999 2,表明酚红浓度在1.25~40.00mg/L范围内与吸光度具有良好的线性关系。低、中、高(1.25、20.00、40.00mg/L)3种浓度的方法回收率分别为100.1%、101.9%、99.1%,日内及日间相对标准差(RSD)均小于2.5%。
1.5.2 酚红浓度的测定 在设定的时间点取肠循环液0.5mL,加入0.2mol/L NaOH 溶液5mL,摇匀,用0.45μm微孔滤膜过滤,取滤液于558nm波长处测定Y值,将其代入标准曲线方程,计算酚红浓度。
1.6 肠循环液中盐酸小檗碱、盐酸药根碱的测定
1.6.1 色谱条件 色谱柱 Waters C18柱(250nm×4.6nm);流动相为50mmol/L的磷酸二氢钾溶液-乙腈(55∶45)(以磷酸调节pH 值至3.0,加入SDS至终溶液浓度25mmol/L);流速为0.5mL/min;检测波长为345nm;进样量为20μL;柱温为30℃。
取适宜浓度的盐酸小檗碱与盐酸药根碱对照品溶液、体内肠循环后样品液和空白肠循环液,在上述色谱条件下测定,盐酸药根碱、盐酸小檗碱的保留时间分别约为27min和39min,样品液的2个主峰保留时间分别与对照品主峰保留时间一致,空白无干扰。见图1。
1.6.2 盐酸小檗碱、盐酸药根碱在空白肠循环液中的稳定性 取大鼠1只,做全肠段插管,用K-R营养液(含酚红20mg/L)循环3h,分别用此空白肠循环液配制24.75mg/L的盐酸小檗碱溶液和11.60 mg/L的盐酸药根碱溶液。于(37±0.5)℃保存24 h。分别于0、4、8、12、16、20、24h测定,观察峰面积的变化情况并计算其RSD。结果,盐酸药根碱RSD为1.56%,盐酸小檗碱RSD为1.12%,表明盐酸药根碱和盐酸小檗碱在空白肠循环液中24h内可以保持稳定。
1.6.3 盐酸小檗碱及盐酸药根碱肠循环液标准曲线的绘制 分别精密称取19.8mg盐酸小檗碱及4.64mg盐酸药根碱对照品置于100mL量瓶中,加甲醇溶解并稀释至刻度,摇匀。分别用含酚红的K-R营养液(酚红20mg/L)等比稀释成浓度为3.094、6.188、12.375、24.750、49.500、99.000 mg/L的盐酸小檗碱溶液及 0.725、1.450、2.900、5.800、11.600、23.200mg/L的盐酸药根碱溶液。于1.6.1项下色谱条件进样20μL测定。以峰面积(Y)对浓度(C,mg/L)进行线性回归,得标准曲线方程如下:Y盐酸小檗碱=138 859C-53 540,r=0.999 9,线 性 范 围 3.094~198.000mg/L;Y盐酸药根碱=138 039C+48 639,r=0.999 7,线性范围0.725~46.400mg/L。结果显示:盐酸小檗碱低、中、高(3.094、24.750、99.000mg/L)3种浓度的回收率分别为 103.1%、98.3%、99.2%,日内、日间 RSD均小于1.9%;盐酸药根碱低、中、高(0.725、5.800、23.200mg/L)3种浓度的方法回收率分别为103.1%、98.7%、101.2%,其日内、日间 RSD 均小于1.9%。二药回收率及精密度均符合测定要求。
1.6.4 肠循环液中盐酸小檗碱、盐酸药根碱浓度的测定 分别精密吸取一定浓度的对照品溶液和在不同时间点取大鼠体内肠循环液100μL于EP管中,加入900μL甲醇,摇匀,于25℃,12 000r/min,离心10min,吸取上清液20μL,注入色谱仪,测定即得。

图1 空白肠循环液、对照品、样品的HPLC图Fig.1 The HPLC chart of blank intestinal juice,reference substance and the sample
1.7 大鼠体内肠吸收实验
1.7.1 样品循环液的配制 精密称取黄连粉末(120目)2.5g置于50mL具塞锥形瓶中,加入模拟胃液,37℃搅拌1h,定容,过滤,滤液测定盐酸小檗碱和盐酸药根碱含量分别为3.345、0.760mg/mL,取母液10mL置于100mL容量瓶中,用含酚红浓度为20mg/L的K-R营养液稀释至刻度,摇匀,即得黄连粉末样品液。同时,分别精密称取对照品盐酸小檗碱167.25mg、盐酸药根碱38.00mg置于50mL具塞锥形瓶中,同上法制成盐酸小檗碱及盐酸药根碱样品液,备用。
1.7.2 大鼠体内小肠吸收实验 参照文献[12]方法。将Wistar大鼠随机分为3组,每组6只,禁食12h(自由饮水)。用20%乌拉坦溶液麻醉(6mL/kg)后固定在手术台板上,保持(37±0.5)℃的体温,沿腹中线切开腹部约3cm,结扎胆总管,在需考察部位(十二指肠上部及回肠下部)的两端剪开小口,插入硅胶管,扎紧,接好循环装置。将插管与恒流泵连接,形成回路。先用(37±0.5)℃的生理盐水清洗肠段,再用(37±0.5)℃的 K-R 营养液以5 mL/min的流速平衡10min,再以空气排出K-R营养液,用已预热(37±0.5)℃的样品液以2.5mL/min的流速回流,分别 于 0、0.25、0.5、1.0、1.5、2.0、2.5h吸取回流液2mL(同时补充等量的20 mg/L酚红溶液),经微孔滤膜(0.45μm)过滤,取滤液分别测定药物和酚红的浓度。根据酚红的浓度计算出供试液的体积,根据每一时间段药物浓度和供试液体积的变化计算出肠循环液中的剩余药量(X),以lnX对取样时间(t)作图得一直线,由直线的斜率求出吸收速率常数(Ka),由2.5h剩余药量的变化值对零时间剩余药量的比,求出2.5h药物吸收百分率。以各时间点吸收率作为纵坐标,以时间为横坐标,得出大鼠小肠对药物(小檗碱和药根碱)的吸收曲线。
2 结果
对黄连粉末中盐酸小檗碱和盐酸药根碱与等量对照品在大鼠小肠吸收速率常数(Ka)及吸收百分率(Pa)进行方差分析,结果见表1。黄连粉末中盐酸小檗碱和盐酸药根碱吸收百分率与对照品比较差异均具有统计学意义(均P<0.01)。且黄连粉末中盐酸小檗碱吸收百分率是对照品盐酸小檗碱的近
3.6倍,而对照品盐酸药根碱吸收百分率是黄连粉末中盐酸药根碱的近2倍。黄连粉末中盐酸小檗碱和盐酸药根碱与等量对照品盐酸小檗碱和盐酸药根碱在大鼠小肠中的吸收均在1.5h达高峰值,在1.5~2.5h达到平衡,见图2、3。
表1 黄连粉末中盐酸小檗碱和盐酸药根碱在大鼠小肠的吸收百分率(Pa)和吸收速率常数(Ka)(±s,n=6)Table 1 The small intestinal Pa and Ka of berberine and jatrorrhizine fromRhizoma coptidis powder in rats(±s,n=6)

表1 黄连粉末中盐酸小檗碱和盐酸药根碱在大鼠小肠的吸收百分率(Pa)和吸收速率常数(Ka)(±s,n=6)Table 1 The small intestinal Pa and Ka of berberine and jatrorrhizine fromRhizoma coptidis powder in rats(±s,n=6)
与对照品比较*P<0.01
Ka(h-1)组别Pa(%)92黄连粉末 1.444±0.219 0.391±0.036 30.26±4.38* 9.61±1.41盐酸小檗碱 盐酸药根碱对照品 1.322±0.232 0.402±0.031 8.22±1.10 19.95±2.盐酸小檗碱 盐酸药根碱*
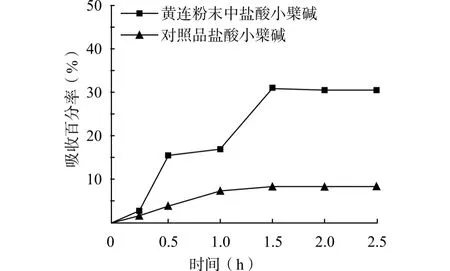
图2 黄连粉末中与对照品中盐酸小檗碱在大鼠小肠的吸收曲线Fig.2 The small intestinal absorption curve of berberine from Rhizoma coptidis powder in rats

图3 黄连粉末中与对照品中盐酸药根碱在大鼠小肠的吸收曲线Fig.3 The small intestinal absorption curve of jatrorrhizine from Rhizoma coptidis powder in rats
3 讨论
本研究以动态的、仿生的方法,模拟通过胃液的消化后黄连粉末在大鼠小肠中的状态,以等量盐酸小檗碱和盐酸药根碱对照品作为对照,对比研究其在小肠中的吸收药量、吸收率、吸收速率和达饱和时间。结果显示,黄连粉末中盐酸小檗碱吸收百分率高达(30.26±4.38)%,是对照品盐酸小檗碱(8.22±1.10)%的近3.6倍,而对照品盐酸药根碱吸收百分率是黄连粉末中盐酸药根碱吸收百分率的近2倍,黄连粉末直接服用有利于其所含盐酸小檗碱在小肠部位的吸收,而不利于盐酸药根碱的吸收,且二者的吸收窗在1.5h。
盐酸小檗碱小肠吸收率较低,该结果与文献报道[13]的一致,但是,黄连粉末中盐酸小檗碱小肠吸收率大幅提高。盐酸小檗碱作为黄连治疗糖尿病主要有效成分,其含量及作用效率远高于有效成分盐酸药根碱[14],且该化合物较易溶于热水而不易溶于冷水,不利于配制成液体制剂,例如,古方中的汤剂。结合本研究结果,说明古方黄连以粉末入丸药治疗糖尿病从剂型选择上具有一定科学性。
黄连粉末中所含盐酸小檗碱较对照品盐酸小檗碱在小肠部位表现出较佳的吸收,而盐酸药根碱与对照品比较则吸收不佳。这一结果充分说明黄连所含众多成分之间,在生物体内的吸收相互影响,这也是黄连进入机体产生的作用效应强于单一同剂量有效成分的原因之一。在中药分离研究中,许多中药经一步步分离后,疗效逐渐降低,这一结果,一方面与中药各成分综合药效有关,另一方面也可能与消化道吸收有关,本研究结果可以作为较好的实验佐证。
[1] 赵启鹏,崔秋兵,张艺 .黄连用于治疗糖尿病的研究进展[J].中药与临床,2011,1(1):55-58.
[2] 安小平,崔庆荣 .黄连治疗糖尿病的研究进展[J].甘肃中医,2008,21(1):57-58.
[3] Yin J,Xing H,Ye J.Efficacy of berberine in patients with type 2diabetes mellitus[J].Metabolism,2008,57(5):712-717.
[4] Yi P,Lu F E,Xu L J,et al.Berberine reverses free-fatty-acidinduced insulin resistance in 3T3-L1adipocytes through targeting IKKβ[J].World J Gastroenteroly,2008,14(6):876-883.
[5] Leng S H,Lu F E,Xu L J.Therapeutic effects of berberine on impaired glucose tolerance rats and its influence on insulin secretion[J].Acta Pharmacologia Sinica,2004,25(4):501-507.
[6] Liu L,Deng Y,Yu S,et al.Berberine attenuates intestinal disaccharidases in streptozotocin-induced diabetic rats[J].Pharmazie,2008,63(5):384-388.
[7] Pan G Y,Huang Z J,Wang G J,et al.The antihyperglycaemic activity of berberine arises from a decrease of glucose absorption[J].Planta Med,2003,69(7):632-636.
[8] 俞森,俞蕴莉,卢守四,等 .黄连中5种小檗碱型生物碱在糖尿病大鼠体内的药动学[J].中国药科大学学报,2008,39(6):526-529.
[9] 江敏,张恩娟 .原儿茶醛大鼠小肠吸收机理的研究[J].中国药房,2003,14(9):528-530.
[10] 陆彬 .药剂学实验[M].北京:人民卫生出版社,1994:131.
[11] 谭晓梅,郭友立,钟玉飞 .黄连提取物中盐酸小檗碱及药根碱大鼠在体肠吸收特征的研究[J].中国中药杂志,2010,35(6):755-758.
[12] 杜先华,牛欣,冯前进,等 .染料木素自微乳的大鼠在体肠吸收机制研究[J].中国中药杂志,2008,33(12):1406-1409.
[13] 肖学凤,乔晓莉,高岚,等 .黄柏中盐酸小檗碱的药代动力学研究[J].天津中医药大学学报,2008,24(4):263-265.
[14] 付燕,胡本容,汤强,等 .药根碱、小檗碱、黄连煎剂及模拟方对小鼠血糖的影响[J].中草药,2005,36(4):548-551.

