细菌性脑膜炎患者脑脊液细菌基因组DNA的提取及16SrDNA的鉴定*
梁志娟, 侯晓霖, 王振海△, 刘爱翠
1宁夏医科大学,银川 750004
2宁夏医科大学总医院神经内科,银川 750004
中枢神经系统感染严重威胁人类生命,细菌性脑膜炎是中枢神经系统感染的常见病、多发病,不但病死率高,而且幸存者中约半数丧失了生活能力。目前,细菌性脑膜炎的诊断主要依赖于传统的细菌培养,其耗时长,脑脊液细菌培养阳性率低,严重滞后于临床诊疗。16SrDNA为细菌基因组的保守序列,包含数个保守区和可变区,根据这些保守区设计的引物不会和非细菌的DNA互补,因此对细菌的鉴别具有特异性,而根据可变区的差异可以鉴别不同的细菌。本实验主要探讨直接从临床细菌性脑膜炎脑脊液标本中提取细菌基因组DNA的方法,再利用16SrDNA序列的特性加以鉴定,建立诊断细菌性脑膜炎的新方法。
1 材料与方法
1.1 材料
1.1.1 标本收集 经无菌腰穿留取细菌性脑膜炎患者脑脊液标本2mL,将其中1mL储存于-80℃冰箱,储存时间小于6个月,另1mL行细菌培养。
1.1.2 主要试剂 DNA 提取试剂盒 DNeasy Blood and Tissue Kit(QIAGEN,Germany),PCR扩增试剂盒 Dream Taq PCR Master Mix(Fermentas,Canada)。
1.1.3 主要仪器设备 生物安全柜(Heal Force),离心机(Heal Force,Neofuge 13R),分光光度计(Thermo Scientific),PCR 仪 (BIO-RAD,S1000 Thermal Cycler),电 泳 仪 (BIO-RAD,Powerpac Basic),凝胶成像仪(BIO-RAD,Gel Doc XR+)。
1.2 方法
1.2.1 脑脊液细菌基因组DNA的提取 将收集的脑脊液8 000r/min离心富集,弃上清。加入溶菌酶裂解液充分混匀,转入带玻璃珠的EP管内,涡旋混匀器振荡5min,温育1h,后续实验步骤按DNA提取试剂盒说明书进行。分光光度计测定浓度,-20℃保存备用。
1.2.2 引物的设计与合成 登录GenBank数据库(http://www.ncbi.nlm.nih.gov),获得细菌基因组16SrDNA的 V3-V5区的序列,V5F:CCATCT CATCCCTGCGTGTCTCCGACTCAGACGAGTG CGTCCGTCAATTCMTTTGAGTTT,V3R:CCTATCCCCTGTGTGCCTTGGCAGTCTCAGACTCCTACGGGAGGCTCCTACGGGAGGCAGCAG,引物交由上海生工生物工程技术服务有限公司合成。
1.2.3 PCR扩增 以提取的DNA为模板,采用16SrDNA的V3-V5区引物进行PCR扩增,PCR反应体系为:PCR Master Mix 12.5μL,上游、下游引物各1μL,模板 DNA 1μL,Nuclease-free Water 9.5μL。按以下条件进行扩增,95℃变性3min,随后95℃30s,56℃30s,72℃30s,35个循环。整个过程约1.5h。
1.2.4 PCR产物鉴定 将PCR反应产物通过2%的琼脂糖凝胶电泳,100V,50min,紫外检测仪下观察条带。
1.2.5 脑脊液细菌培养及鉴定 无菌操作将脑脊液接种于血琼脂平板及巧克力平盘上,37℃需氧培养3~5d。观察平板上有无可疑菌落生长,并挑取可疑菌落进行革兰染色镜检,观察细菌菌落形态,染色特性,进行分离纯化,与质控菌株对比鉴定。
1.3 统计分析
应用SPSS 17.0统计软件,采用卡方检验对两种方法的阳性检出率进行比较,以P<0.05为差异有统计学意义。
2 结果
2.1 细菌培养及鉴定
58例脑脊液临床标本经需氧培养3~5d,有10例在血琼脂平板上见无色针尖样细小群落,阳性率为17.2%。经鉴定,大肠埃希菌2例,肺炎链球菌3例,肺炎克雷伯菌2例,马链球菌1例,李斯特菌1例,鲍曼不动杆菌1例。
2.2 16SrDNA的PCR扩增
PCR检测阳性23例,阳性率为39.7%。扩增产物与Marker对照,片段约为550bp,与目的片段大小一致。见图1。

图1 部分脑脊液临床标本16SrDNA PCR扩增产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of 16SrDNA PCR products of some CSF samples
2.3 两种检测方法阳性率的比较
对58例细菌性脑膜炎患者的脑脊液细菌进行检测,传统细菌培养阳性的10例脑脊液标本中,16S rDNA PCR检测阳性9例,阴性1例;传统细菌培养阴性的48例中,有14例PCR检测为阳性(表1)。两种检测方法阳性率分别为17.2%、39.7%,差异有统计学意义(χ2=7.157,P=0.008),16SrDNA PCR检测明显优于传统的细菌培养方法。
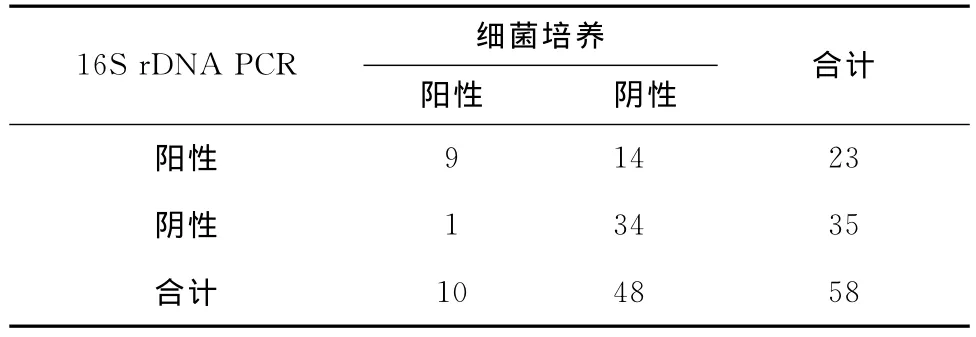
表1 细菌培养及16SrDNA PCR结果比较Table 1 Comparison between bacterial culture and 16SrDNA PCR results
3 讨论
研究表明细菌性脑膜炎治疗效果的好坏与是否早期明确病原菌,选择适当的抗生素进行治疗密切相关[1]。目前,对于细菌性脑膜炎诊断的金标准依旧是传统的细菌培养。既往的研究表明,脑脊液细菌培养的阳性率仅为13%[2-3]。不仅如此,某些特殊的菌种还需要特殊的培养液才能生长,并且需要纯度较高的培养物。而引起细菌性脑膜炎的菌量一般在105~108/mL,加之由于抗生素的早期使用使脑脊液培养前病原菌的数量常减少到102/mL。闫玲等[4]研究表明,当脑脊液中细菌数量减少到102/mL时,直接接种培养结果为阴性。这就使脑脊液的细菌培养阳性率极低,严重制约细菌性脑膜炎的诊断和治疗,临床上往往依靠经验治疗。
本实验取58例细菌性脑膜炎患者的脑脊液样本分别进行细菌培养和16SrDNA PCR检测,有23例标本在550bp处扩增出特异的DNA产物,而细菌培养阳性的标本仅为10例,表明无论特异性还是灵敏性,16SrDNA PCR扩增技术均优于细菌培养,并且其耗时仅为几小时。近几年,16SrDNA序列分析在细菌的分类鉴定中应用较多[5],例如乳酸菌、肠道沙门氏菌等。16SrDNA是编码原核生物核糖体小亚基rRNA(16SrRNA)的基因,长度约为1 500bp,是细菌分类学研究中最常用、最有用的“分子钟”,其序列包含10个可变区(variable region)和与之相间的11个恒定区(constant region),可变区因细菌而异,且变异程度与细菌的系统发育密切相关,因此,16SrDNA可以作为细菌菌落结构分析最常用的系统进化标记分子。利用16S rDNA可变区与恒定区的特性,可以进行不同种属细菌的分类和鉴定。
但是,由于脑脊液临床标本获得困难,量少,往往达不到1mL,所以采取离心法富集细菌是细菌基因组DNA提取的关键步骤。当脑脊液细菌浓度低于10/mL时,采用离心法不能达到浓集细菌的目的,这就使脑脊液中的细菌基因组DNA的提取较为困难,制约了16SrDNA PCR检测技术的应用。该技术对样品中总DNA的提取步骤要求也较高,如果DNA提取过程出现偏差,不能够获得原来群落中的总DNA,则得到的分析结果就不能准确地反映真实的菌群,影响了其灵敏度。即便如此,本研究结果依然证明,对脑脊液中细菌的鉴定,PCR技术优于传统的细菌培养技术,具有快速、直接、准确等优点。不仅如此,样本中只要存在一定量的细菌的DNA碎片,检测结果就是阳性[6],这是传统的细菌培养方法无法比拟的。这种分子水平的检测方法不仅适用于临床脑脊液中细菌的鉴定,而且还适用于临床其它难培养标本中病原微生物的鉴定,例如,脑脓肿、肝脓肿、化脓性关节腔积液等[7]。也适用于其它样本的致病菌鉴定[8]。
以序列比对为基础建立起来的16SrDNA基因诊断要想成为一种临床检测的常规方法,还需要一个强大的质控序列数据库[9-10],而目前数据库尚不完善,甚至有些数据信息是错误的[11]。加之脑脊液中细菌基因组DNA的提取方法国内外文献鲜有报道,因此,脑脊液细菌基因组的提取是此方法得以广泛应用于临床的最大障碍。但是,随着分子生物学理论和方法的日臻成熟和分析技术的改进,16SrDNA检测技术在细菌性脑膜炎的病原菌鉴定方面将起到更加重要的作用。
[1] van de Beek D,de Gans J,Tunkel A R,et al.Community-acquired bacterial meningitis in adults[J].N Engl J Med,2006,354(1):44-53.
[2] Durand M L,Calderwood S B,Weber D J,et al.Acute bacterial meningitis in adults:a review of 493episodes[J].N Engl J Med,1993,328(1):21-28.
[3] Heininger A,Binder M,Ellinger A.et al.DNase pretreatment of master mix reagents improves thevalidity of universal 16S rRNA gene PCR results[J].J Clin Microbiol,2003,41(4):1763-1765.
[4] 闫玲,张润玲,王应芳,等 .浓集脑脊液中细菌的方法学研究[J].第四军医大学学报,2008,29(6):546-548.
[5] 马迪根 M T,马丁克J M.Brock微生物生物学[M].李明春,杨文博,译 .北京:科学出版社,2009:767-773.
[6] Michalet-Doreau B,Fernandez I,Fonty G.A comparison of enzymatic and molecular approaches to characterize the cellulolytic microbial ecosystems of the rumen and the cecum[J].J Anim Sci,2002,80(3):790-796.
[7] Schuurman T,de Boer R F,Kooistra-Smid A M,et al.Prospective study of use of PCR amplification and sequencing of 16Sribosomal DNA from cerebrospinal fluid for diagnosis of bacterial meningitis in a clinical setting[J].J Clin Microbiol,2004,42(2):734-740.
[8] 王大勇,方振东,谢朝新,等 .十三种致病菌多重PCR技术检测[J].华中科技大学学报:医学版,2011,40(3):320-325.
[9] Turenne C Y,Tschetter L,Wolfe J,et al.Necessity of quality controlled 16SrRNA gene sequence databases:identifying nontuberculous Mycobacterium species[J].J Clin Microbiol,2001,39(10):3637-3648.
[10] Cloud J L,Conville P S,Croft A,et al.Evaluation of partial 16Sribosomal DNA sequencing for identification of nocardia species by using the MicroSeq 500system with an expanded database[J].J Clin Microbiol,2004,42(2):578-584.
[11] 吴晓娟,陈峥宏,王菲.PCR扩增16SrDNA在幽门螺杆菌感染诊断中的运用[J].现代检验医学杂志,2010,25(5):1763-1765.

