国际关键比对CCQM-K55C:L-缬氨酸纯度的测量*
戴新华 暴海霞 苏福海 方 向 黄 挺 张 伟 李红梅 王海峰
(中国计量科学研究院,北京 100013)
0 引言
氨基酸是构成蛋白质分子的基本单位,与生物的生命活动密切相关。如果人体缺乏任何一种必需氨基酸,就可导致生理功能异常,影响抗体代谢的正常进行,最后导致疾病。例如:缬氨酸是组成蛋白质的基本氨基酸,是人体8种必须氨基酸之一,它与异亮氨酸和亮氨酸一起工作,促进正常生长,修复组织,调节血糖,并给身体提供能量,提高动物机体免疫机能,影响动物内分泌水平。
由于氨基酸分析在蛋白质组学、生物化学和临床医学等领域的研究中起着重要作用,因此,对氨基酸分析方法的研究得到世界各国的高度重视。大多数氨基酸不含芳香环等生色团,无法直接用紫外检测器检测,需要先将氨基酸衍生为具有较强紫外或荧光吸收的衍生物后进行检测。目前,对氨基酸的分析测定方法主要为以下几种:1)衍生化离子交换色谱法[1],2)衍生化高效液相色谱法[2-4],3)衍生化气相色谱法[5],4)衍生化气相色谱-质谱联用法[6],5)衍生化毛细管电泳法[7-9]。上述方法都属于间接法,需要先对样品中的氨基酸进行衍生后才能利用紫外检、荧光、火焰离子化等检测器或者质谱进行检测,衍生法操作繁杂,衍生试剂昂贵,而且可能漏掉无法衍生的杂质或者在衍生化过程中生成新的杂质而导致错误的检测结果。因此,急需研究直接法对氨基酸进行高准确度的测量,为研制氨基酸类纯度标准物质和基体中目标氨基酸的检测奠定基础,为复杂基体中氨基酸定量和蛋白质定量提供可溯源的标准,为实现国际互认奠定坚实的技术基础。
CCQM有机工作组(OAWG)组织进行了L-缬氨酸纯度测定的国际关键比对活动,其代号为CCQM-K55C。该比对由国际计量局(BIPM)组织实施,中国计量科学研究院(NIM)、美国国家标准和技术研究所 (NIST)、德国国家计量研究院(PTB)、韩国标准与科学研究所(KRISS)、英国政府化学家实验室(LGC)和澳大利亚计量院(NMIA)等共25家实验室参加。本工作应用质量平衡法,分别对四类杂质进行了定量测定,建立了准确可靠的L-缬氨酸纯度的测定方法,并代表我国参加了CCQM-K55C比对,取得优异成绩。
1 实验部分
1.1 试剂与仪器
试剂:超纯水(密理博公司Millipore纯水仪 制备);缬氨酸国际比对样品2瓶(500mg/瓶),由BIPM提供;甲酸、三氟乙酸、乙腈和甲醇,均为HPLC 级(Merck公司);丙氨酸、异亮氨酸、亮氨酸和甲硫氨酸(Sigma公司);α,β,γ-氨基丁酸(Dr.Ehrenstorfer公司);色谱柱:Primesep 100(美国);卡尔费休试剂(Sigma-Aldrich公司)。
主要仪器:超高压液相色谱-电雾式检测器UPLC-CAD(美国Waters公司的超高压液相色谱和美国Thermo-Fisher公司的电雾式检测器联用);高效液相色谱-三重四极杆质谱联用仪HPLC-MSMS(美国Agilent公司的6410QQQ);顶空-火焰离子化检测器(美国安捷伦公司的HP6890);卡尔费休库仑滴定仪(Mettler Toledo公司的 DL39);天平Mettler Toledo UMX2(量程2.1g,精度为 10-7g,梅特勒公司),用于所有纯品的称量;天平Sartorius(量程230g,精度0.01mg,赛多利斯)用于标准和内标溶液的称量。
1.2 标准溶液和内标溶液的配制
待测样品溶液、标准溶液和内标溶液均用重量法配制,高纯水为溶剂。
1.3 测量方法
根据有机纯品中所有杂质的结构特点,将纯物质中的杂质分为如下四类:1)与主成分结构类似的杂质;2)易挥发性杂质(VOCs);3)水分;4)不挥发性杂质。针对这四类杂质的特点,分别采用如下方法对各类杂质进行定性和定量分析。
1)HPLC-CAD方法对与主成分结构类似杂质进行定性分析:仪器为UPLC-CAD,通过选择合适的色谱柱、色谱流动相组成、流速的优化、检测器的选择等,最终得到HPLC-CAD方法的检测条件如下:CAD的参数:气体压力:234kPa;Corona电压:2.38kV;Corona电流:0.99μA;离子捕集电压:20.3V;喷雾温度:35℃。液相色谱部分的参数:色谱柱:Primesep 100(2.1×250mm,5μm);流动相:A:水(0.1%三氟乙酸),B:乙腈(0.1%三氟乙酸),流动相比例:A:B=80:20;流速:0.3mL/min;进样体积:2μL;运行时间:25min。
2)HPLC-MSMS方法对与主成分结构类似杂质进行定性和定量分析:仪器为液相色谱三重四极杆质谱联用仪(Agilent 6410 QQQ);通过选择合适的色谱柱,色谱流动相组成、流速的优化等,最终得到HPLC-MSMS方法的检测条件如下:质谱参数:数据采集时间:25min;扫描模式:MRM;离子模式:正离子;毛细管碎裂电压:60V;碰撞能量:5V;去溶剂气温度:350℃;去溶剂气流速:9L/min;雾化器压力:276kPa。液相色谱参数与上述HPLC-CAD方法中的液相色谱方法相同。
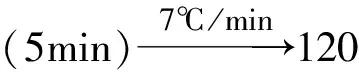
此外对水分的测定采用了卡尔费休滴定法,同时采用热重(TGA)方法进行验证;对不挥发性杂质的测定采用了电感耦合等离子体质谱法(ICP-MS),同时采用TGA方法进行验证。
1.4 数据分析
采用单点校正法[10]计算与主成分结构类似杂质的含量,计算公式如下:
(1)
其中,C为比对样品中某个杂质的浓度,mg/g;Cstd为相应杂质其标准溶液的浓度,μg/g;Cs为被测样品的浓度,mg/g;R为被测杂质的峰面积与该物质标准溶液峰面积的比值;Ps为被测杂质纯品的纯度。
L-缬氨酸纯度的测量按照质量平衡法公式(2)计算:
W1=1000-[W2+W3+W4.+W5]
(2)
式中,W1为CCQM-K55C比对样品中缬氨酸含量,mg/g;W2为与缬氨酸结构类似组分的含量,mg/g;W3为水分含量,mg/g;W4为挥发性杂质VOCs的含量,mg/g;W5为不挥发性杂质/无机类杂质含量,mg/g。
根据ISO导则,及L-缬氨酸计算公式(2),得到L-缬氨酸纯度测量的不确定度公式(3)如下[11]:
(3)
式中,uw1为L-缬氨酸的不确定度;uW2为与缬氨酸结构类似组分的标准不确定度;uW3为水分的标准不确定度;uW4为VOCs的标准不确定度;uW5为不挥发性杂质的标准不确定度。
2 结果与讨论
2.1 与主成分结构类似杂质的定值结果
缬氨酸不含紫外吸收基团,无法直接采用紫外检测器检测。示差折光检测器不能兼容梯度淋洗,易受外界干扰;蒸发光散射检测器的线性与灵敏度问题等等,都无法满足该次比对中对于含量极低杂质的测量。CAD是一款新型的、检测原理独特的通用型检测器,不依赖于被分析物的结构,也不需要将被分析物电离,且灵敏度可以达到pg 级,重现性良好。因此在本方法研究中,选用了灵敏度相对较高的通用型检测器- CAD进行检测。
按照“1.3测量方法”部分中HPLC-CAD方法的实验条件,对样品进行检测,得到比对样品中与主成分结构类似的杂质是丙氨酸、异亮氨酸和亮氨酸和另外一个未知杂质。为了确定在Primesep100上杂质定性的准确性,我们采用了HPLC-IT-TOF-MS进行验证。在HPLC-IT-TOF-MS方法中一方面能够得到母离子和子离子的精确分子量,预测杂质的分子式;然后,采用该杂质的纯品进行验证。检测结果表明:该方法与上述HPLC-CAD方法中得到的杂质相同,因此,确定此次比对样品缬氨酸中与其结构类似的杂质主要是丙氨酸、异亮氨酸和亮氨酸。
对于上述方法中的含量相对较低的未知杂质,通过与17种氨基酸混合标准溶液对照实验,发现该杂质并不是氨基酸类物质,因此需要单独对其进行定性。根据该杂质在HPLC-IT-TOF-MS上测得的精确分子量以及预测的分子式,并结合L-缬氨酸的合成途径,初步推测该杂质是氨基-丁酸。而氨基丁酸具有三种不同的异构体,为了确认样品中是哪一种异构体,采用LC-IT-TOF方法对三种异构体与CCQM-K55C比对样品进行对比实验,确定该杂质为a-氨基丁酸。
为了确认在上述不同方法中,是否还存在与主成分共流出的杂质组分,同时为了对确定了的杂质成分进行准确定量分析,逐一研究建立了17种氨基酸的HPLC-MSMS直接检测法,发现甲硫氨酸的保留时间与缬氨酸完全一致。为了确认该次比对样品中是否存在杂质甲硫氨酸,分别对比对样品和甲硫氨酸标准溶液进行了检测,证实了存在与主成分共流出的杂质甲硫氨酸,这个结果与文献报道的缬氨酸合成途径中可能杂质相一致。因此共得到与主成分结构类似的杂质有5种,依据在色谱图上的保留时间顺序依次为丙氨酸、a-氨基丁酸、甲硫氨酸、异亮氨酸和亮氨酸(图1所示)。
对上述经定性分析了的5种杂质,按照“1.3测量方法”部分中采用HPLC-MSMS方法逐一进行了定量测定。定值方法是先采用了外标曲线法得到杂质的大致含量,在此基础上再采用单点精确匹配法进行了多次测量,按照公式(1)计算最终得到各个杂质的含量见表1。结果表明:HPLC-MSMS方法测量的结果与该次比对的参考值的一致性好,证明了对杂质定量的准确性。
表1缬氨酸中各杂质组分的含量及与CCQM-K55C比对结果的比较
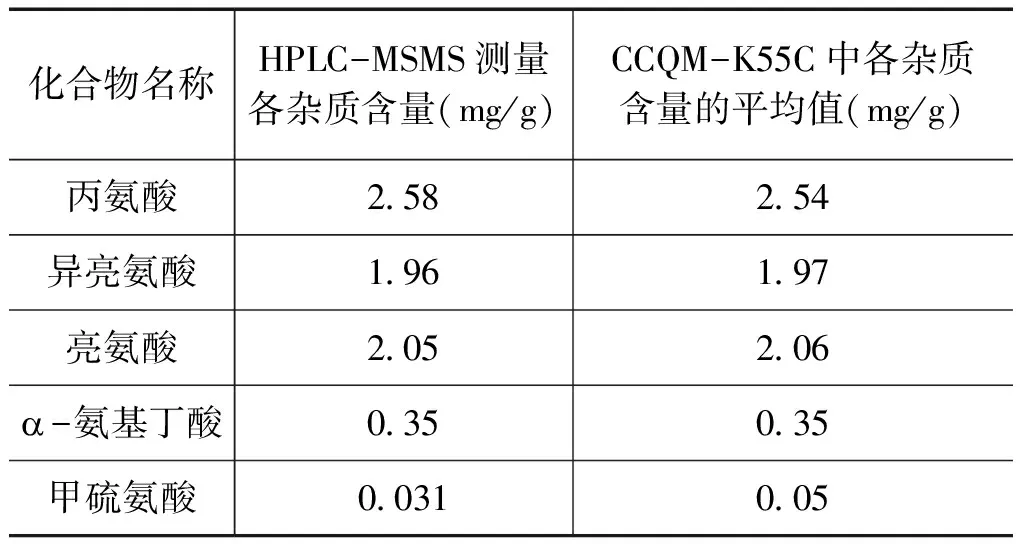
化合物名称HPLC-MSMS测量各杂质含量(mg/g)CCQM-K55C中各杂质含量的平均值(mg/g)丙氨酸258254异亮氨酸196197亮氨酸205206a-氨基丁酸035035甲硫氨酸0031005
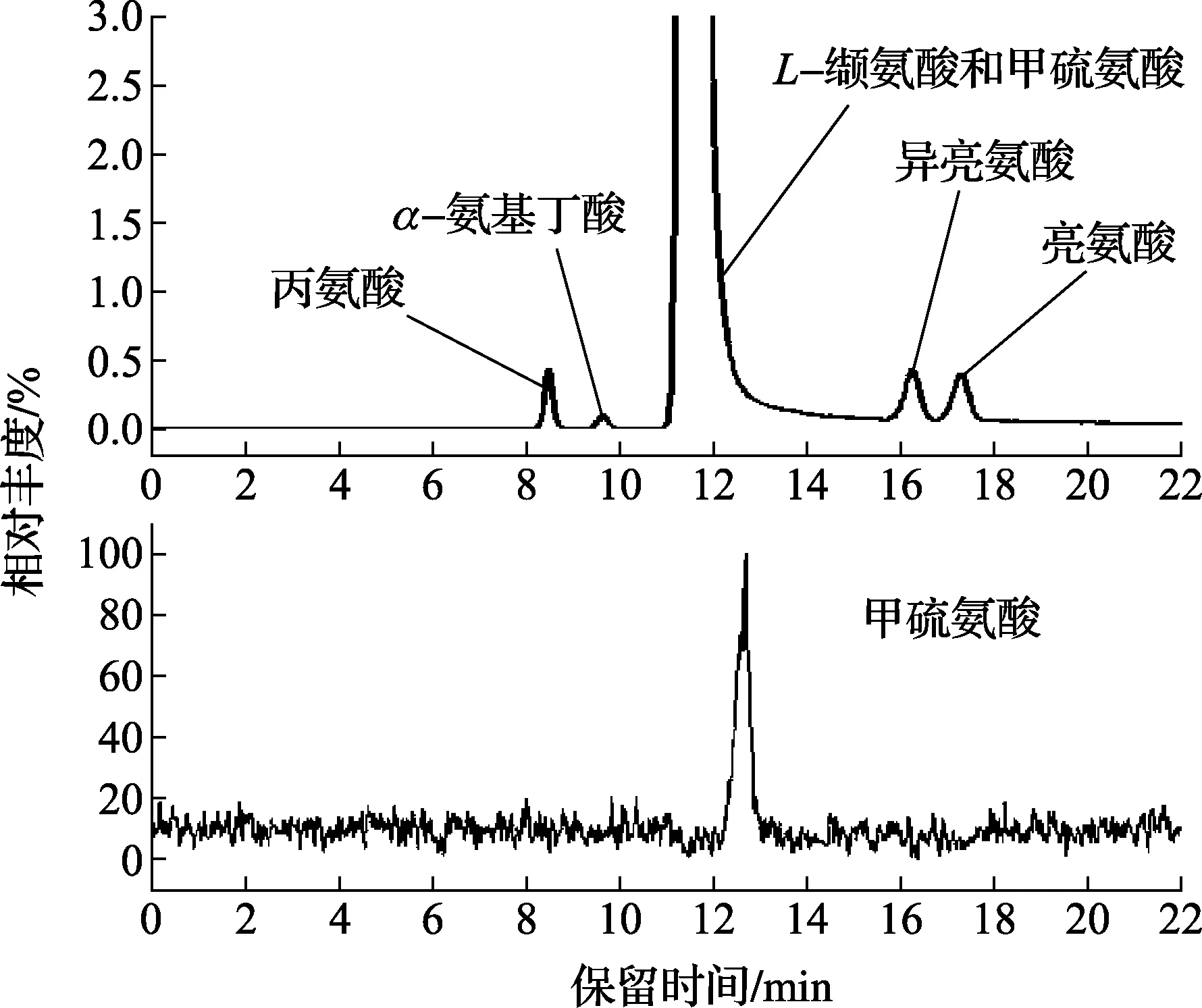
图1 HPLC-MSMS检测CCQM-K55C比对样品中杂质的总离子流和选择离子流图
2.2 水分的测定
采用卡尔费休法对水分进行测定,每次取约50mg的比对样品,共测定三次,采用直接进样方式进行测定,得到水分测量的平均值为0.27%,RSD为7.3%。为了验证该测定结果,采用热重法对水分进行了测量,得到水分含量为0.23%,与卡尔费休法的一致性较好。在固体样品中水分含量如此低的情况下,方法的重复性小于10%,充分说明了该方法对水分测量的准确性。
2.3 挥发性杂质的定性和定量分析
对该类杂质的分析,目前国内外文献未见报道。本文采用宽口径的毛细管柱,大体积顶空直接进样与质谱联用的方法进行定性分析。按照实验部分挥发性杂质的测定条件,根据顶空-质谱联用分析结果及缬氨酸的制备和纯化分离过程,得到CCQM-K55C中挥发性杂质为甲醇。按照 “1.3测量方法”部分中对挥发性杂质的GC-FID测定条件,采用外标曲线法进行定量,每次取样量约为50mg,平行测定三次,最终得到甲醇的平均含量为0.021 mg/g,测量重复性RSD为8.5%。
2.4 不挥发性杂质的测定
对于纯品物质的分析,其中不挥发性杂质的测定传统方法主要是采用灼烧残渣的方法,由于国际比对样品量的有限性(只有2瓶样品,每瓶为500mg),本研究采用电感耦合等离子体质谱法对不挥发性杂质进行定性和定量分析,得到本次比对样品缬氨酸中无机类杂质的总含量为0.17mg/g。为了验证定量的准确性,采用TGA方法对该类杂质进行了验证,得到不挥发杂质含量为0.20mg/g,与ICPMS方法测定结果相近,验证了不挥发性杂质定值的准确性。
2.5 不确定度评定和比对结果
采用质量平衡法对缬氨酸纯度进行定值,其定值不确定度是各种杂质不确定度的加合。按照式(2)和式(3)计算得到缬氨酸的不确定度及其含量如表2所示:
表2采用质量平衡法得到CCQM-K55C缬氨酸含量及其不确定度值
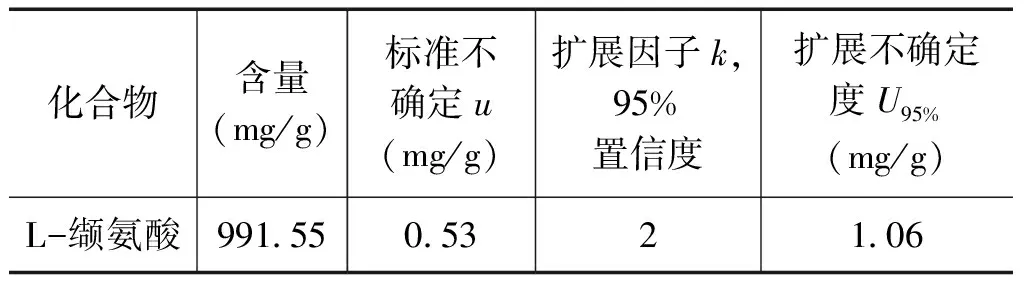
化合物含量(mg/g)标准不确定u(mg/g)扩展因子k,95%置信度扩展不确定度U95%(mg/g)L-缬氨酸991550532106
参加该次比对的共有25个国家和地区,我们NIM在对于每类杂质的定值结果均取得了等效度,采用质量平衡法测定的主成分的测定结果与该次比对的参考值相差仅仅0.035%,不确定度相对较小(见图2),取得了国际互认。
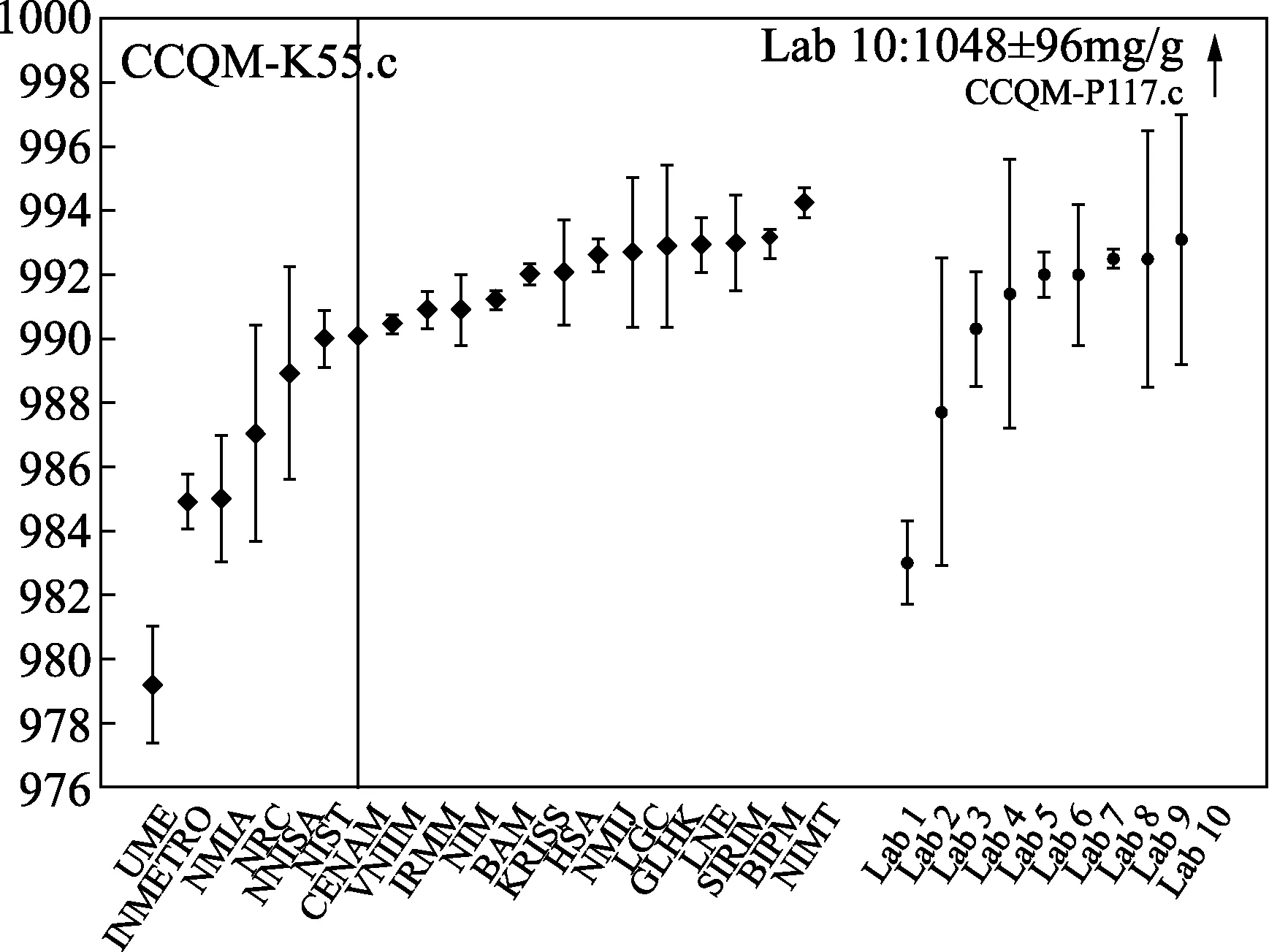
图2 CCQM-K55C L-缬氨酸纯度测定的比对结果
3 结论
本工作研究建立了缬氨酸纯度定值方法和各类杂质的定性和定量分析方法。对与主成分结构类似的杂质,一直是高纯有机物制备、纯化和定值中的难点和关键,本工作通过采用HPLC-CAD、HPLC-IT-TOF-MS和HPLC-MSMS等联用技术对与缬氨酸结构类似的杂质进行了直接定性和定量分析,结果表明该次国际关键比对中我们确定的杂质组分多,测量准确。尤其是我们对含量仅仅为31μg/g且与主成分共流出的甲硫氨酸进行了定性和定量测定,是该类纯物质定值中最为困难和值得借鉴的地方。上述对与主成分结构类似杂质的定性和定量方法与传统的氨基酸衍生化检测方法相比避免了复杂繁琐的衍生反应、衍生反应不完全、衍生过程生成新的副产物及衍生后背景干扰严重等的缺点。总之,本方法不仅操作相对简单,而且检测结果的可靠性大大提高,填补了氨基酸直接测量方法的空白。该方法为结构类似的其他20种基本氨基酸纯物质和基体的定值提供了可供借鉴的模式和方法基础;同时为高水平氨基酸纯度标准物质的研制提供了关键的定值手段。
本工作中还研究建立了有机纯物质定值中其它三类杂质的定性和定量方法,为今后有机纯物质的定值及其标准物质的研制提供了可供借鉴的模式和方式。
[1] Georgiadis A G,Coffey J W.Single column analysis of amino acids in protein hydrolysates utilizing the fluorescamine reaction.Anal.Biochem.,1973,56:121~128
[2] Pereira V,Pontes M,Cmara S,et al.Simultaneous analysis of free amino acids and biogenic amines in honey and wine samples using in loop orthophthalaldeyde derivatization procedure[J].J.Chromatogr.A,2008,1189:435-443
[3] Lozanov V,Benkova B,Mateva L,et al.Liquid chromatography method for simultaneous analysis of amino acids and biogenic amines in biological fluids with simultaneous gradient of pH and acetonitrile[J].J.Chromatogr.B,2007,860:92-97
[5] Khuhawar M Y,Majidano S A.GC Analysis of Amino Acids Using Trifluoroacetylacetone and Ethyl Chloroformate as Derivatizing Reagents in Skin Samples of Psoriatic and Arsenicosis Patients[J].Chromatographia,2011,73:701-708
[6] Kawana S,Nakagawa K,Hasegawa Y.Simple and rapid analytical method for detection of amino acids in blood usingblood spot on filter paper,fast-GC/MS and isotope dilution techique[J].J.Chromatogr.B,2010,878:3113-3118
[7] Hsieh M M,Chen S M.Determination of amino acids in tea leaves and beverages using capillary electrophoresis with light-emitting diode-induced fluorescence detection [J].Talanta 2007,73:326-331
[8] Zhang N,Zhang HS,Wang H.Separation of free amino acids and catecholamines in human plasma and rabbit vitreous samples using a new fluorogenic reagent 3-(4-bromobenzoyl)-2-quinolinecarboxaldehyde with CE-LIF detection [J].Electrophoresis,2009,30(13):2258-2265
[9] Zinellu A,Sotgia S,Pisanu E,et al.Quantification of neurotransmitter amino acids by capillary electrophoresis laser-induced fluorescence detection in biological fluids[J].Anal.Bioanal.Chem.,2010,398(5):1973-1978
[10] Thienpont L.M.,Nieuwenhove B.Van,Stockl D.,Leenheer A.P.De,J.Calibration for isotope dilution mass spectrometry-description of an alternative to the bracketing procedure[J] Mass Spectrom.,1996,31:1119-1125
[11] ISO/GUM(1993),Guide to the expression of uncertainty in measurement[S].

