靶病变浅表性钙化对经皮冠状动脉介入治疗的影响
尚晨黧, 王 禹, 白 静
(解放军总医院老年心血管病研究所, 北京 100853)
冠状动脉(简称冠脉)钙化增加了经皮冠脉介入治疗(percutaneous coronary intervention,PCI)手术操作的复杂性,并且与球囊扩张导致的血管夹层、冠脉支架的不充分扩张有关,后者被公认为是PCI术后再狭窄、支架内血栓和靶病变再血管化的危险因素[1,2]。然而,何种类型的冠脉钙化与其相关尚在商榷之中。血管内超声(intravascular ultrasound,IVUS)可以观察冠脉的管壁结构,对冠脉钙化的检测敏感性及特异性极高[3],并且可以分辨钙化的分布。本研究旨在通过IVUS技术分析冠脉靶病变钙化特征,从而观察靶病变浅表性钙化对PCI的影响。
1 对象与方法
1.1 对象
连续收集2012年5月至12月于解放军总医院老年心血管病研究所行冠脉造影检查,且同时行血管内超声及冠脉支架植入术的患者61例(61处靶病变)。入选标准:年龄>18岁,符合冠心病诊断标准;冠脉造影检查提示至少一支血管狭窄>70%;IVUS证实靶病变为钙化病变。排除标准:临界病变经IVUS评估无需支架植入术者;冠脉支架植入术后再狭窄病变;严重心功能不全,左室射血分数(left ventricular ejection fraction,LVEF)<30%;急性心肌梗死接受急诊PCI者;恶性肿瘤,预期存活时间小于1年。根据IVUS检测冠脉钙化情况分为两组:浅表性钙化组29例,非浅表性钙化组32例。所有患者术前签署知情同意,并自愿加入本研究。
1.2 实验室指标
术前抽取空腹肘静脉血,测定空腹血糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肌酐、脑利钠肽前体。肾膳食改良方程估算肾小球滤过率。
1.3 冠脉造影及PCI治疗
术前至少12h口服阿司匹林300mg,同时氯吡格雷负荷剂量300mg口服,术中经动脉鞘管给予普通肝素100IU/kg,维持全血活化凝血时间≥300s,常规备用临时起搏器和主动脉内球囊反搏装置,冠脉内给予200µg硝酸甘油,采用Phillip Allura Xper FD 20数字剪影心血管造影系统和Judlin's法多体位造影。所有病变均给予1~4次预扩张,压力12~18atm(1atm=101.325kpa),球囊直径通常达2.5mm,选择Ryujin、Pioneer等常规球囊预扩,如病变钙化严重,预扩效果不理想或预计不理想,给予Grip等非顺应性高压球囊或切割球囊预扩。两组均植入药物洗脱支架。术后IVUS指导下视情况给予非顺应性高压球囊后扩张处理。术后所有患者接受阿司匹林、氯吡格雷双联抗血小板、盐酸替罗非班强化抗血小板以及他汀类药物调脂等常规冠心病二级预防治疗。罪犯血管为由2名经验丰富的冠脉介入医师根据临床症状、心电图、超声提示的节段性室壁运动异常部位及冠脉造影结果判断的缺血相关血管。靶病变定义为罪犯血管内管腔横截面积最小的病变。
1.4 IVUS成像及影像分析
常规冠脉造影后,选择冠脉造影提示的直径狭窄至少>70%的血管,给予IVUS成像,采用VOLCANO S5 imaging system(VOLCANO CORPORATION),Eagle Eye®Gold超声导管(2.9F,20MHz)。超声导管送至病变远端,采用VOLCANO公司自动回撤装置,以0.5mm/s自动回撤至冠状动脉窦口。PCI术后复查IVUS,评估支架贴壁及膨胀情况。如存在贴壁不良、膨胀欠佳,给予后扩张处理。所有靶病变纳入分析。术前最小管腔截面处、病变近端及远端参考段测量管腔面积、面积狭窄率、最大钙化弧度、术后支架内最小横截面积及同一截面的最大/最小支架直径。支架对称指数=最小支架直径/最大支架直径。支架膨胀指数=最小支架横截面积/平均参考管腔横截面积。相对管腔获得=即刻管腔获得/术前最小管腔横截面积。浅表性钙化、深层钙化的IVUS表现见图1。支架置入理想的标准:(1)完全贴壁,整个支架的所有支架丝均匀完全紧贴内壁,支架与血管壁之间不存在空隙;(2)对称性,支架内的最小直径/最大直径≥0.7;(3)展开良好,最小支架截面积/平均参考血管段管腔面积≥0.8。

图1 不同类型钙化Figure 1 Different types of coronary calcification
1.5 研究终点
造影成功,定义为造影证实术后冠脉残余狭窄≤20%,前向血流TIMI3级,无急性闭塞。手术成功:造影成功基础上无院内主要不良心脏事件(major adverse cardiac events,MACE)。MACE定义:院内死亡、心肌梗死、靶血管血运重建。死亡为全因死亡,非致命性心肌梗死定义为心肌缺血性症状、肌酸激酶同工酶正常上限两倍以上增高,伴有或不伴有ST段抬高。靶血管血运重建定义为靶血管重复接受手术治疗,PCI或冠脉旁路移植术。
1.6 统计学处理
采用SPSS13.0统计软件,正态分布的连续变量以±s表示,两组间比较采用双侧独立t检验;分类变量以百分率表示,两组比较应用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基线临床特征
浅表性钙化组29例,平均年龄(63.40±11.87)岁,男性19例,非浅表性钙化组32例,平均年龄(58.50±6.93)岁,男性26例。具体情况见表1。
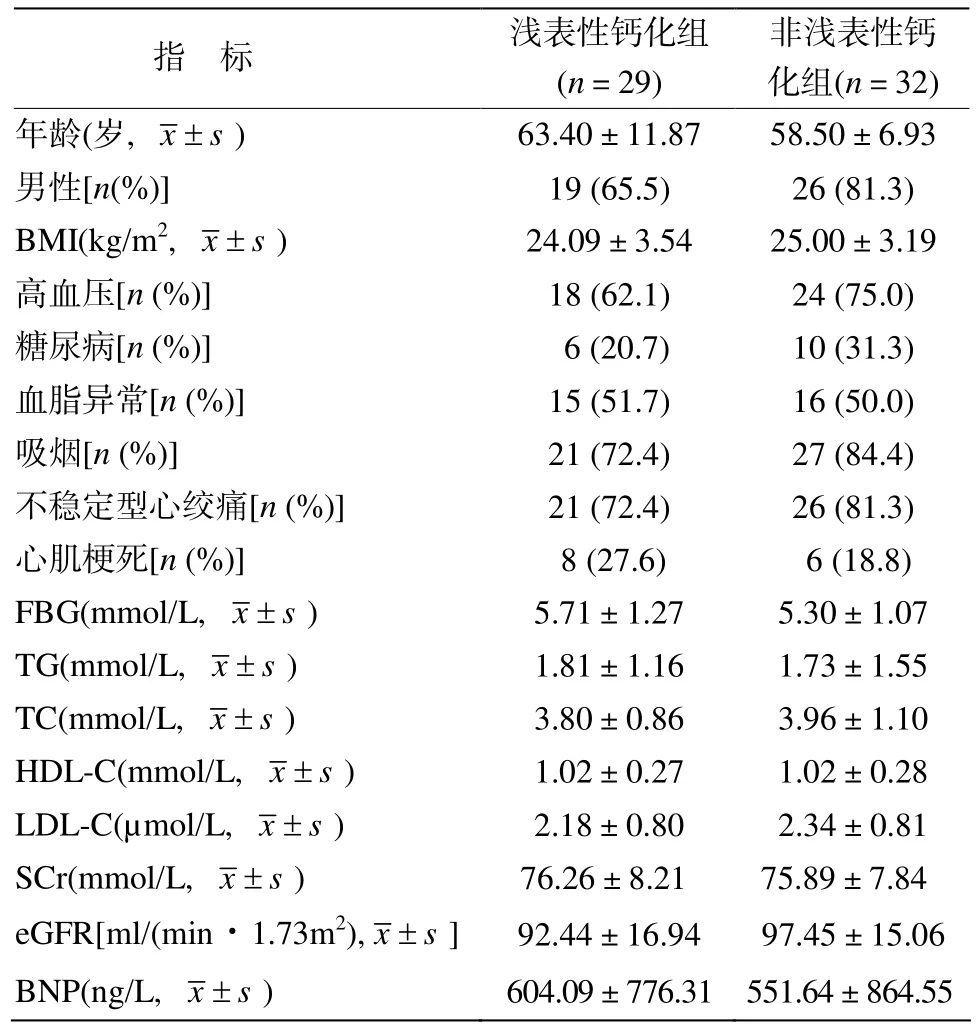
表1 基线临床特征Table 1 Baseline characteristics of the two groups
2.2 冠脉造影及术前IVUS结果
浅表性钙化组29处,前降支/左主干25处,回旋支3处,右冠1处。非浅表性钙化组32处,前降支/左主干26处,回旋支4处,右冠2处。浅表性钙化组面积狭窄率(75.70±7.11)%,非浅表性钙化组(68.78±5.56)% (P=0.019)。两组术前最小管腔横截面积、最大钙化弧度等差异无统计学意义(表2)。
2.3 冠脉介入治疗情况及术后IVUS结果
浅表性钙化组最大支架释放压力(11.89±2.37)atm,非浅表性钙化组(14.45±1.97)atm(P=0.016)。浅表性钙化组支架对称性及支架膨胀指数明显劣于非浅表性钙化组[(0.85±0.06)vs(0.90±0.02),P=0.016;(0.68±0.14)vs(0.82±0.10),P=0.021]。两组手术并发症发生率差异未发现统计学意义(表3)。部分严重浅表性钙化病变术后支架扩张明显不对称(图2)。

表2 术前靶病变特征及血管内超声测量Table 2 Characteristics of target lesions and IVUS measurements of the two groups before PCI

表3 手术操作特点及冠脉支架植入术后IVUS测量Table 3 Procedural characteristics and IVUS measurements of the two groups after PCI

图2 严重浅表性钙化PCI术后支架不对称扩张Figure 2 Asymmetric stent expansion after PCI in severe superficial calcification
3 讨 论
冠脉钙化是动脉粥样硬化的特征之一,Moussa等[2]报道中重度钙化病变由于支架递送困难导致技术失败较无/轻度钙化病变明显增多。冠脉钙化病变亦和血管夹层、支架扩张不充分有关,而这些情况又是PCI术后再狭窄、支架内血栓及靶病变再血管化的危险因素[1,2]。本研究应用血管内超声技术首次探讨冠脉靶病变浅表性钙化对介入治疗的影响。
Song等[4]有关预测药物支架术后支架内再狭窄最合适的最小支架面积(minimal stent area,MSA)的研究中初步认为,在西罗莫司涂层支架术后,预测再狭窄最合适的MSA临界值为5.5mm2,zotarolimus涂层支架为5.3mm2,依维莫司涂层支架为5.4mm2。Doi等[5]研究发现,在紫杉醇药物支架术后,预测术后9个月内支架再狭窄的MSA界值为5.7mm2。本研究中,浅表性钙化组术后MSA小于非浅表性钙化组,虽未发现统计学差异,但均值刚刚达到上述临界值,部分病变可能预后不良。最近的研究发现钙化病变PCI术后残余直径狭窄明显大于非钙化病变[1]。本研究进一步证实,冠脉浅表性钙化支架膨胀指数明显小于非浅表性钙化。深在型钙化或混合型钙化,无论是在球囊扩张还是支架释放时,钙化表面至管腔之间的相对软的斑块部分似乎可以认为是一个缓冲带,而浅表性钙化直接限制支架的展开,在钙化弧度相当的情况下,浅表性钙化更直接地影响了支架扩张。
Otake等[6]利用光相干断层成像(optical coherence tomography,OCT)对冠脉西罗莫司支架术后进行了6个月以上的随访研究,发现发生支架血栓的病变平均支架偏心指数明显小于非血栓病变。而Brugaletta等[7]研究发现生物可吸收支架较XIENCE V支架术后具有更大的支架对称指数,但在6个月的随访中MACE事件发生率差异并无统计学意义。本研究发现浅表性钙化组支架对称性明显劣于非浅表性钙化组,这可能与斑块不均匀钙化有关,而浅层钙化的存在使得同一截面钙化区域与非钙化区域坚硬度明显不同,非顺应性球囊的应用可能在一定程度上能改善其对支架不对称扩张的影响,但仍不能完全规避。本研究尚未发现支架对称性与院内MACE事件的相关性,而支架不对称扩张是否影响远期疗效有待长期随访研究。
Xu等[8]新近研究报道颈动脉斑块浅表性钙化是决定斑块不稳定的重要因素,并认为表浅钙化的形状和位置与斑块内出血相关。根据美国心脏病协会分类[9],基于病理学的研究,突入血管管腔的冠脉浅表性钙化结节是易损斑块的一种类型[9,10]。Matsumoto等[11]根据表浅冠脉钙化是否突入管腔将冠脉斑块表浅钙化分为两类,发现突入管腔的表浅钙化更接近管腔,钙化容积较小,是易损斑块的一种类型。冠脉斑块浅表性钙化无论从斑块稳定性,还是临床结局方面的研究都有待进一步深入。
[1]Kawaguchi R, Tsurugaya H, Hoshizaki H,et al.Impact of lesion calcification on clinical and angiographic outcome after sirolimus-eluting stent implantation in real-world patients[J].Cardiovasc Revasc Med, 2008, 9(1): 2-8.
[2]Moussa I, Ellis SG, Jones M,et al.Impact of coronary culprit lesion calcium in patients undergoing paclitaxel-eluting stent implantation (a TAXUS-IV sub study)[J].Am J Cardiol,2005, 96(9): 1242-1247.
[3]Escolar E, Weigold G, Fuisz A,et al.New imaging techniques for diagnosing coronary artery disease[J].CMAJ,2006, 174(4): 487-495.
[4]Song HG, Kang SJ, Ahn JM,et al.Intravascular ultrasound assessment of optimal stent area to prevent in-stent restenosis after zotarolimus, everolimus and sirolimus-eluting stent implantation[J].Catheter Cardiovasc Interv, 2012, [Epub ahead of print].
[5]Doi H, Maehara A, Mintz GS,et al.Impact of post-intervention minimal stent area on 9-month follow-up patency of paclitaxel-eluting stents: an integrated intravascular ultrasound analysis from the TAXUS IV, V and VI and TAXUS ATLAS Workhorse, Long Lesion and Direct Stent Trials[J].JACC Cardiovasc Interv, 2009, 2(12):1269-1275.
[6]Otake H, Shite J, Ako J,et al.Local determinants of thrombus formation following sirolimus-eluting stent implantation assessed by optical coherence tomography[J].JACC Cardiovasc Interv, 2009, 2(5): 459-466.
[7]Bruqaletta S, Gomez-Lara J, Diletti R,et al.Comparison ofin vivoeccentricity and symmetry indices between metallic stents and bioresorbable vascular scaffolds: insights from the ABSORB and SPIRIT trials[J].Catheter Cardiovasc Interv,2012, 79(2): 219-228.
[8]Xu X, Ju H, Cai J,et al.High-resolution MR study of the relationship between superficial calcification and the stability of carotid atherosclerotic plaque[J].Int J Cardiovasc Imaging,2010, (Suppl 1): 143-150.
[9]Naghavi M, Libby P, Falk E,et al.From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I[J].Circulation, 2003, 108(14):1664-1672.
[10]Kume T, Akasaka T, Kawamoto T,et al.Assessment of coronary arterial plaque by optical coherence tomography[J].Am J Cardiol, 2006, 97(8): 1172-1175.
[11]Matsumoto M, Yoshikawa D, Ishii H,et al.Morphologic characterization and quantification of superficial calcifications of the coronary arteryin vivoassessment using optical coherence tomography[J].Nagoya J Med Sci, 2012,74(3-4): 253-259.

