猪肺炎支原体强毒株的分离和鉴定
姜来生,张 洪,杜德燕,方鹏飞,郭建宝
(四川省华派生物制药有限公司,四川 简阳 641400)
猪肺炎支原体是猪支原体肺炎(MPS)(又称猪喘气病或猪地方流行性肺炎)的病原,是一种介于细菌和病毒之间的原核微生物。猪喘气病是一种高传染性、接触性、高发病率和低死亡率的慢性呼吸道病,而且很容易继发其他病原感染,最终形成慢性肺炎。该病流行范围广,且难以治愈,严重影响了养猪业的发展,是世界上最主要的猪病之一。本试验从疑似猪支原体肺炎病例病料中分离、培养并鉴定获得了1株猪肺炎支原体强毒株,并进行了部分基因序列测序分析,为后续猪肺炎支原体研究提供参考。
1 材料与方法
1.1 材料
1.1.1 发病猪病料 疑似猪支原体肺炎的发病猪病料采集自四川地区部分猪场。
1.1.2 培养基 改良A26培养基由四川省华派生物制药有限公司研发配制。
1.1.3 主要试剂 2×Taq PCR MasterMix、Maker III,购自TIANGEN生物科技公司;猪肺炎支原体ELISA抗体检测试剂盒,购自IDEXX公司;猪圆环病毒ELISA抗体检测试剂盒,购自Biocheck公司;猪瘟阻断ELISA抗体检测试剂盒、猪繁殖与呼吸综合征ELISA抗体检测试剂盒,购自法国LSI公司。
1.2 方法
1.2.1 菌株分离 参照刘茂军等的方法,无菌采集疑似病例的猪肺进行无细胞分离培养。
1.2.2 染色镜检 取培养物涂片,用革兰氏染色液和瑞氏染色液进行染色观察。
1.2.3 颜色变化单位(CCU)的测定 参照王继春介绍的方法,取菌种依次以1∶10递减稀释,稀释至10-11;设本培养基作对照,置37℃恒温箱中培养,每日观察一次,直至21d。
1.2.4 PCR鉴定 根据Genbank中公布的猪肺炎支原体基因组序列设计一对特异性引物,并提交给Invitrogen公司合成,引物序列为 P1:5′-TTACAGCGGGAAGACC-3′,P2:5′-CGGCGAGAAACTGGATA-3′。将经培养传代试验和染色镜检试验鉴定为猪肺炎支原体的培养物按文献方法提取基因组DNA,进行PCR扩增,扩增结束后取产物5μL在1%琼脂糖凝胶电泳上进行电泳检测。
1.2.5 测序分析 PCR产物送往Invitrogen公司测序,将测序结果与GenBank中已发表的4个国际主要代表株的相应序列进行比较分析。用于比较的参考毒株名称及其在GenBank 中的登陆号为:J(NCO07295)、168(NC017509)、232(NC006360)、7448(NC007332)。
1.2.6 菌株的致病性试验 从健康的长白二元杂交猪中筛选出猪肺炎支原体、猪圆环病、猪瘟、猪繁殖与呼吸综合征4种病的抗原及抗体均呈阴性的试验猪,将经培养传代试验、染色镜检试验和测序检测鉴定为猪肺炎支原体的新鲜培养物按合适剂量以气管注射的方式接种 3头(编号 1、2、3)试验猪,同时设 2头(编号4、5)气管注射A26培养基的猪作为对照组。攻毒后按常规饲养,饲料中无抗生素。逐日观察至25 d,再剖检试验猪,根据55分评分法对试验猪的肺部病变进行评分。
1.2.7 攻毒猪病变肺中支原体的再分离 操作同1.2.1的方法一样。
2 结果与分析
2.1 猪肺炎支原体的分离与形态观察 从15份疑似猪支原体肺炎的猪肺病料中分离培养获得1株病原。将分离株接种到A26培养基培养后,培养基变黄,pH值下降;将培养物涂片,瑞氏染色、镜检,观察到特征性的多形态菌体,有点状、环状、球状和两极状,无杂菌污染。连续传代至20代,其培养特性和病原形态皆稳定。
2.2 颜色变化单位(CCU)的测定结果 将培养传代至第5代的培养物稀释至10-11,共11个梯度,观察颜色变化单位,至 21d 时,CCU 达到 1×109。
2.3 PCR鉴定结果 由图1可见,传代培养物与攻毒后再分离培养的培养物的PCR扩增结果,均与猪肺炎支原体J株PCR的扩增结果大小一致,并与预期片段427bp大小一致。
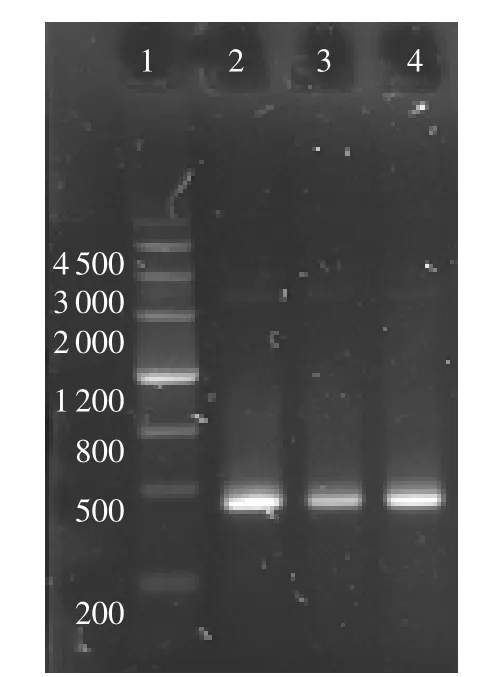
图1 PCR鉴定扩增结果
2.4 序列分析 测序结果经NCBI-Blast和DNAStar比对分析,发现目的序列与J株序列(基因号:NC007295)相比,在第8个碱基处多一个G碱基;与168株序列(基因号:NC017509)则反向互补,并在第8个碱基处多一个G碱基,在第382个碱基处不一致;与232株序列(基因号:NC006360)比对,发现在第8个碱基处多一个G碱基,在第27、171、350个碱基处均不一致;与7448株序列(基因号:NC007332)比对,发现在第8个碱基处多一个G碱基,在第381个碱基处不一致。测序结果如下:
TTACAGCGGGGAAGACCACAAAAACCGGGTGAAA CTCGGCTTGAATTAGTAGCTGATAACATCCGAATTATC CGGGAAATTGCACTAAAAGTCAAAGAAAGTGGCTTTA GTGGAATAAGTATTATTGTTGCTAATCCTGTTGATATA ATTACAAGGGCTTACCGGGATGCATCTGGATTTTCCGA TCAAAAAGTTATCGGTAGTGGAACTGTTTTAGATACAG CAAGGCTTCAATTTGCAATCGCAAAAAGAGCAAAAGT ATCGCCTAATTCGGTTCAGGCCTACGTGATGGGTGAAC ATGGTGATTCATCTTTTGTTGCTTATTCAAATATTAAAA TTGCCGGTGAATGTTTCTGTGCTTATTCTAAACTAACCG GAATTGATAGCTCAAATTACGAAAAAGAACTTGAATAT CCAGTTTCTCGCCG
2.5 动物回归实验结果 在长白二元杂交猪气管内注射合适剂量的分离株新鲜培养物后,猪出现咳嗽、喘气等临床症状。注射后15d、25d采血检测抗体,结果试验组都为抗体阳性,对照组为抗体阴性;25d剖检攻毒猪,发现肺脏的尖叶、心叶、中间叶或膈叶前缘有不同程度的特征性病变,呈“肉样”或“虾肉样”。临床症状及病变评分见表1。
2.6 攻毒猪病变肺中支原体的再分离 将攻毒病变猪的肺组织病料经分离、传代培养后,显示pH值下降;涂片染色镜检,观察到特征性的多形态菌体,有点状、环状、球状和两极状,无杂菌污染;PCR鉴定结果见图1。

表1 动物回归实验肺部病变评分
3 小结与讨论
猪支原体肺炎是由猪肺炎支原体引起的慢性、接触性呼吸道疾病,猪肺炎支原体在自然界中长期存在,猪感染后久治难愈,给养猪业带来了很大的危害。1973年,上海畜牧兽医研究所首次将病猪的肺组织通过猪肺埋块细胞培养法分离得到一株致病性猪肺炎支原体,此后广东、广西等8个省、自治区亦相继分离到此病原。本试验从15份猪疑似支原体肺炎的临床病料中分离到1株毒株,经培养传代、染色镜检、PCR鉴定及测序分析,鉴定为猪肺炎支原体。分离株在攻毒健康猪后出现典型的猪支原体肺炎临床症状和病变,并从病变肺中又分离到了该毒株,说明所分离的毒株不仅是猪肺炎支原体,而且该分离株对猪具有一定的毒力。
[1]毕丁仁,王桂枝.动物霉形体及研究方法[M].北京:中国农业出版社,1998.
[2]Kobisch M,Blanchard B,Le Potier M F.Mycoplasma hyopneumoniae infection in pigs∶duration of the disease and resistance to reinfection[J].Vet Res,1993,24(1):67-77.
[3]Thacker E L,Halbur P G,Ross R F,et al.Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia[J].J Clin Microbiol,1999,37(3):620-627.
[4]刘茂军,邵国青,周勇岐,等.一株猪肺炎支原体强毒株的分离和鉴定[J].江苏农业学报,2009,25(2):308-310.
[5]王继春,邵国青,何家惠,等.猪肺炎支原体168无细胞弱毒疫苗株的变色单位测定试验[J].畜牧与兽医,2001,33(6):22-23.
[6]沈青春,谭青松,王琴,等.PCR方法测定猪肺炎支原体培养物菌数[J].中国预防兽医学报,2006,28(1):55-57.
[7]Goodwin R F.Field trials with a formalinized vaccine against enzootic pneumonia of pigs[J].Br.Ver.J,1973,129:456-470.
[8]Barile M F,Chandler D K,Yoshida H,et al.Hamster challenge potency assay for evaluation of mycoplasma pneumoniae vaccines[J].Infect Immune,1988,56(9).
[9]张锋钢,沈志强,高云英,等.猪肺炎支原体的分离及PCR鉴定[J].中国兽医杂志,2007,43(4):21-22.
[10]邵国青,刘茂军,孙佩元,等.猪气喘病人工发病模型的建立[J].微生物与感染,2007,2(4):215-218.
[11]熊焰,石谦,邓均华,等.猪肺炎支原体MY-99株的致病性[J].中国兽医学报,2006,26(3):259-261.
[12]蔡宝祥.家畜传染病学[M].4版.北京:中国农业出版社,2001.

