抗体生产用反应器放大中的问题及对策
段须杰
·调查与研究·
抗体生产用反应器放大中的问题及对策
段须杰
由于具有靶向明确、副作用小等优势,抗体药物近年来发展迅速。2012 年,抗体药物全球销售额已达 650 亿美元[1]。放眼国内,一方面国家通过“新药创制”科技重大专项为生物医药产业发展提供强有力的科技支撑,同时越来越多的抗体药物面临“专利悬崖”,在国内也形成了抗体药物的开发热潮。
众所周知,工程细胞株构建、动物细胞大规模培养工艺开发以及抗体质量分析已成为我国抗体药物产业化的主要瓶颈[2]。其中,工程细胞株构建包括宿主细胞改造、表达载体构建与转染、高表达细胞株筛选等关键技术[3];动物细胞大规模培养工艺开发包括培养基开发、培养工艺优化以及反应器放大等关键技术[4-5];而抗体质量分析则包括影响药物特性(如安全性、药代动力学和药效动力学等)的所有质量表征,例如糖基化、纯度、电荷分布、生物学活性等[5]。值得一提的是,无论是细胞株构建还是培养工艺开发,都必须以满足抗体质量要求为前提。
反应器放大作为大规模细胞培养的关键环节,对抗体的产量和质量影响十分显著。然而,目前国内企业的抗体开发大多处于申报阶段,尚未面临产业化问题,同时生产规模多为百升左右,因而反应器放大过程中存在的技术难题多未面临。本文将从介绍细胞培养反应器种类及放大原则入手,重点探讨近年来有关反应器放大过程中存在的问题及对策,以期对国内企业进行抗体生产工艺放大及产业化起到指导作用。
1 细胞培养反应器概述
1.1 反应器种类
尽管近年来涌现出以降低剪切、增强传质混合为目的的新型反应器,如 GE 公司 WAVE®反应器、PBS Biotech 公司 Air-Wheel®反应器等,但是抗体药物生产仍主要采用通气搅拌式反应器。根据反应器材质可将其分为不锈钢反应器和一次性反应器。
1.1.1 不锈钢反应器 迄今为止,FDA 批准的抗体药物基本都是在不锈钢反应器内完成生产的[1]。由于早期抗体产量较低,因此生产规模大都在 10 000 L 左右。不锈钢反应器通常涉及 CIP 模块、SIP 模块、存储模块等,因此管路连接十分复杂,对操作人员要求较高。一旦出现污染,便需要对整个系统进行排查和灭菌。同时,不锈钢反应器还面临着高昂的前期设备投入以及运行成本。著名的反应器制造商主要包括 Sartorius 公司、Applikon 公司、Bioengineering 公司等。
1.1.2 一次性反应器 近年来,一次性反应器凭借其免清洁、免灭菌、操作灵活等优势迅速占领国内外市场。Shire 公司商品名为 VPRIV®的酶制剂即采用一次性反应器进行生产,并已获得 EMA 批准上市。用于动物细胞培养的一次性生物反应器品牌众多,例如 Sartorius 公司的 BIOSTAT®STR、Thermo 公司的 Hyclone®SUB 和 GE 公司的Xcellerex®XDR 等。与传统的不锈钢反应器相比,无论是细胞生长、抗体产量,还是抗体质量,采用一次性反应器都可以达到高度相似,同时还可以显著降低生产成本,缩短生产周期[6]。此外,Smelko 等[7]通过一次性反应器(1000 L)和不锈钢反应器(15 000 L)对比研究发现,无论采用 CHO细胞还是 NS0 细胞培养,都能够获得质量一致的抗体产品。
1.2 反应器放大原则
动物细胞对于培养微环境的改变非常敏感,因而在反应器放大过程中常常会遇到挑战。就生物反应器放大而言,可将反应器操作参数分为两类:体积依赖性参数和体积非依赖性参数[8]。其中,体积依赖性参数包括搅拌转速、通气量、培养体积、流加培养基体积等,而体积非依赖性参数包括温度、pH、溶氧水平等。反应器放大的基本策略是保持体积非依赖性参数不变,同时适当地放大体积依赖性参数。然而,对于体积非依赖性参数而言,往往是非线性放大,因此在实际应用过程中常常采取经验性放大准则,详见表 1[9-10]。
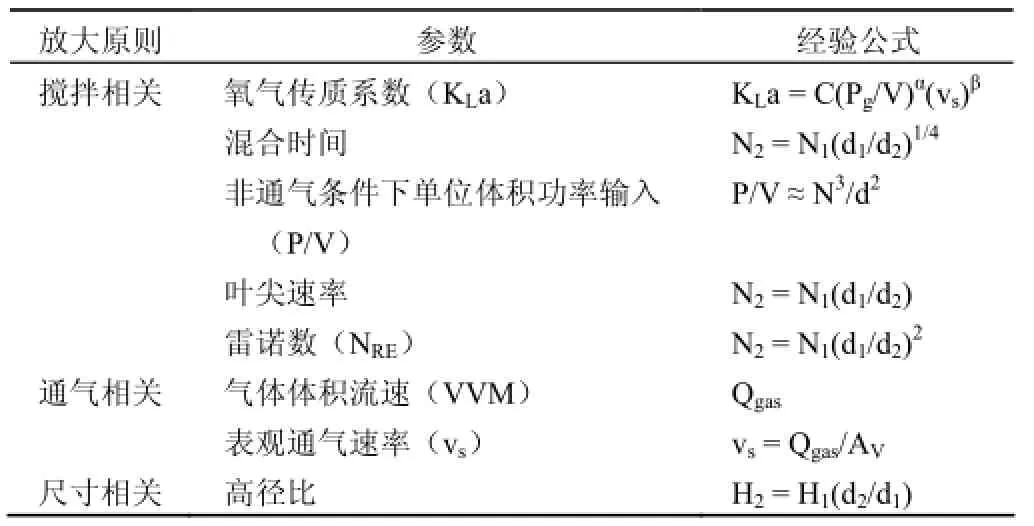
表 1 动物细胞培养反应器放大原则
如表 1 所示,体积非依赖性参数的放大基本可以分为三类:搅拌相关(包括氧气传质系数、混合时间、P/V、叶尖速率和雷诺数)、通气相关(气体体积流速和表观通气速率)以及几何尺寸相关。由于基于几何尺寸的放大原则仅仅考虑反应器的外形尺寸相似,而忽略了反应器内部的传质与混合,因此在实际应用中很少单独使用。对于搅拌和通气相关的参数而言,很难保证所有参数在放大过程中都保持不变,必须针对具体细胞株以及培养基的特性,寻找培养工艺中最敏感因素,从而保证工艺放大的一致性。
2 反应器放大存在问题及对策
搅拌和通气作为关键的体积依赖性参数,已成为细胞培养工艺放大公认的难题。一方面搅拌可以促进培养基、O2等营养物的混合,同时加强气液传质效果;另一方面,通气可以满足细胞生长和抗体合成的 O2需求,还可以排除溶解于培养液中的 CO2。然而,无论是搅拌还是通气都是一把“双刃剑”,过高的搅拌速度和过大的通气量所产生的剪切力又会对细胞生长产生负面影响。由此可见,细胞培养反应器放大过程中遇到的诸如剪切力、O2供给、CO2排除、pH 控制等问题皆与搅拌和通气有关。
2.1 剪切力
细胞培养反应器内剪切力按照来源大致可以分为两类:搅拌相关和通气相关[10]。本节将详细阐述由上述两类剪切力对细胞造成的损伤机制及解决办法。
2.1.1 搅拌相关剪切力 搅拌相关的剪切力主要是指由搅拌桨运动产生的流体剪切力,该剪切力会造成细胞死亡、非致命的生理反应、抗体糖基化水平降低等影响[11-13]。根据Kolmogorov 湍流理论可知,只有当细胞尺寸大于Kolmogorov 湍流尺度或者与之相当时,才有可能受到流体剪切力的影响。大量试验结果表明,当反应器内平均能量耗散率达到 105~ 106W/kg 时,会造成细胞死亡;当反应器内平均能量耗散率达到 1 ~ 100 W/kg 时,会造成细胞的非致命生理反应。而在通常情况下,细胞培养反应器的平均能量耗散率只有 0.01 ~ 0.15 W/kg,因此流体剪切对细胞的影响微乎其微。
2.1.2 通气相关剪切力 根据气泡的形成周期可将其对细胞造成的损伤分为四个阶段:①气体分布器处气泡形成;②搅拌桨处气泡合并与破裂;③反应器内气泡上升;④气液交界面气泡破裂。研究结果表明,气液交界面气泡破裂是导致细胞损伤的剪切力的主要来源,而气泡的形成与上升对细胞的损伤很小[10]。Trinh 等[14]通过设计一个可使大量、单个气泡在短时间内破裂的装置来证明气泡破裂对细胞造成的伤害。结果显示一个 2 mm 的气泡破裂可以导致约 1000 个细胞死亡。除此以外,采用不同孔径的气体分布器以及改变分布器与搅拌桨的相对位置发现,与大气泡相比,小气泡对细胞的损伤更大[10]。
2.1.3 降低剪切力损伤 与搅拌相关的剪切力可通过降低搅拌转速、改变搅拌桨形式(如翼型桨、象耳桨、斜叶桨等)来实现。由于改变搅拌转速或搅拌桨形式会影响反应器内部的混合效果,因此在放大过程中需要特别注意。通气相关的剪切力则采用添加剪切保护剂的方式降低气泡对细胞的损伤。Pluronic F68 作为一种非离子表面活性剂,可以阻止气泡与细胞之间的相互作用而避免气泡对细胞的损伤,因而常添加至培养基中。然而,Gigout 等[15]发现 CHO 细胞对 Pluronic F68 会产生内吞,因此在添加时需注意其浓度选择。
2.2 O2供给
O2是细胞培养重要的营养物质,通常 30% 的溶氧水平即能满足大多数细胞的正常生长。对于大规模、高密度细胞培养而言,细胞对 O2的消耗速率很快,往往需要通过微泡分布器来加强气液传质。微泡分布器(微米级)和大泡分布器(毫米级)是细胞培养常用的两种分布器。前者通过增加气泡的表面积来提高氧气传质系数(KLa),但会在气液交界处形成一层较厚的气泡层,进而导致培养后期大量泡沫形成。若用大泡分布器供氧则会需要较大的通气量,往往很难实现放大,因而常用来通入空气以排除 CO2。Hyclone®SUB反应器便采用微泡和大泡分布器共用的方式实现工艺放大。
与此同时,随着反应器体积的增加,混合时间明显增加,造成反应器内的溶氧水平呈现梯度化分布。研究结果显示,溶氧水平的改变不仅影响细胞的代谢情况,而且显著改变蛋白的糖基化水平[5]。Serrato 等[16]通过溶氧水平的振荡性改变来模拟大规模培养过程中可能存在的溶氧梯度化分布。结果表明,振荡性改变溶氧水平会明显降低细胞生长速率、最高细胞密度以及细胞活力。
2.3 CO2排除
CO2排除是反应器放大的另一个难题。由于动物细胞的呼吸熵约为 1,即细胞每消耗一分子 O2便产生一分子CO2,同时培养基中 CO2的溶解度远高于 O2,使得反应器内的 CO2短时间内会大量累积。当反应器内二氧化碳浓度达到 15% ~ 20%[(1.5 ~ 2.0)× 104Pa]时,便会对细胞产生毒害作用,并且过高的二氧化碳分压也会对抗体的电荷分布和糖基化产生影响[17-19]。因此,培养基中常会添加 20 ~40 mmol/L NaHCO3作为缓冲体系。然而,当 CO2分压超过 1.3 × 104Pa 时,将远高于 NaHCO3的缓冲能力,必须采取其他措施将其控制在合理的范围。Mostafa 和 Gu[20]考察通气量、搅拌转速、气泡尺寸等多种因素对 CO2排除效果的影响,发现增大深层通气量或使用大泡分布器可以显著降低 CO2分压,而改变搅拌转速或增加表层通气量则对CO2分压影响很小。
2.4 pH 控制

图1 Scale-down 模型用于生产工艺表征和生产支持
pH 作为一个重要的工艺控制参数,直接影响细胞正常生长以及抗体糖基化水平[5]。细胞培养过程中产生的乳酸和CO2会使得培养液 pH 迅速下降,因而需要通过补加碱液(如 NaHCO3、Na2CO3等)进行 pH 控制。随着反应器规模的增加,混合时间也逐渐增加,碱液的补加也会造成反应器内局部 pH 过高,进而导致细胞裂解[21]。因此,大规模反应器碱液补加位置的选择非常重要,同时应尽可能选择较低浓度的碱液进行 pH 控制。此外,Goudar 等[22]研究发现,采用 Na2CO3代替 NaHCO3,不仅能够降低因补加碱液造成的渗透压增加,同时还可以显著降低 CO2分压。
2.5 补料培养基流加
与碱液流加相似,补料培养基的流加也应注意培养基的流加位置和浓度。补料培养基的浓度通常较高(如葡萄糖等),短时间内会造成局部营养物质“过剩”,进而对细胞的代谢状态产生影响。Takuma 等[23]研究发现,葡萄糖浓度的改变会对乳酸和丙氨酸的比生成速率产生显著影响,同时,局部营养物质的“过剩”也会加剧溶氧水平的梯度化[24]。
3 Scale-down 模型及其应用
Scale-down 模型是指用于抗体药物工艺开发的实验室规模的模型,通常可以放大到中试及生产规模。另外,它常作为模拟生产规模的有利工具。如图 1 所示,工艺开发贯穿整个抗体药物临床试验及上市阶段。由于抗体药物生产规模通常较大,在该条件下进行工艺表征往往代价不菲。因此,Scale-down 模型常用于模拟生产规模下的工艺条件,完成工艺表征,或者处理生产规模下的工艺问题,以提供生产支持[25]。
3.1 Scale-down 模型建立原则
总体而言,Scale-down 模型建立的原则是尽可能保持不同规模下参数的一致性。首先,模型中涉及的设备要尽可能与生产规模下的设备相似。尽管相似的高径比不能够保证反应器内部的传质与混合效果相似,但是可以确保高径比不会成为工艺放大过程中的影响因素。其次,培养工艺中涉及的原材料应与生产规模下的原材料保持一致,因为培养基中任何一种成分的改变都可能对细胞生长和产物合成产生影响。第三,应保证模型中涉及的检测手段与生产规模下的检测手段相似,这样可以减少分析手段引入的差异。第四,保持体积非依赖性参数(如温度、pH、接种比例等)不变,同时线性调整体积依赖性参数。对于体积依赖性参数而言,除了搅拌转速外,可以按照线性比例缩小,如培养体积、流加培养基体积、通气量等。而搅拌转速可以按照表 1 所述,采用 KLa、P/V、雷诺数、叶尖速率等放大原则进行缩小[25]。
3.2 Scale-down 模型确证
Scale-down 模型确证主要包括以下步骤:首先,保证模型的所有参数设定值均为生产规模下工艺参数的设定值;其次,对比不同规模下的操作参数(溶氧、pH、温度、转速等)和性能参数(细胞生长、O2消耗、抗体产量及质量等);第三,根据生产规模下的历史培养数据确立模型的可接受标准。Li 等[26]通过 2 L 生物反应器建立 Scale-down模型来完成 2000 L 规模的工艺表征,并由此确定关键操作参数的影响及工艺操作范围,为后续工艺验证奠定基础。
3.3 Scale-down 模型反应器
Scale-down 模型确证通常需要保持反应器外形尺寸尽可能与生产规模下反应器相一致,因此通常采用 1 ~ 3 L 生物反应器进行模拟,商业品牌诸如 Sartorius、Applikon、Dasgip 等。近年来,随着一次性微型反应器技术的迅速发展,越来越多的高通量筛选系统采用 Scale-down 模型建立,如 Tap Systems 公司的 Ambr®、Pall 公司的 Micro-24®等。高通量筛选系统可以大幅缩短工艺确证的时间,提高试验效率,但使用时需注意该反应器是否适用于 Scale-down模型。
4 结语
随着细胞株构建技术及培养基开发技术的迅速发展,使得细胞密度和抗体产量大幅度提高,对大规模细胞培养提出了严峻的挑战[27]。首先,一次性反应器的迅速崛起,给传统的不锈钢反应器带来了巨大冲击。由于一次性反应器在降低大量 CIP、SIP 及相关验证工作的同时,显著提高操作灵活性并降低污染风险。作者认为,如果能够很好地解决溶出物/析出物以及生产规模问题(目前最大生产规模约为2000 L),未来将有可能取代不锈钢反应器而成为抗体生产的主流反应器[28]。
其次,由于反应器放大的主要依据仍以经验性放大原则为主,且尚存在一定的争议,例如叶尖速率作为放大原则的适宜性等[10]。这些因素无疑增加了未来抗体药物产业化的难度和风险。作者认为,深入探讨反应器内剪切力对细胞培养的影响机制,同时借助计算流体力学技术模拟反应器内的流场分布及混合效果将成为解决反应器放大问题的未来研究趋势。
放眼国内,大多数生物制药企业仍处于抗体药物研发的初期阶段(临床申报),且反应器规模均在 1000 L 以下,尚未面临大规模、高密度的细胞培养中存在的众多技术难题。基于此,作者期望通过对国内外的反应器放大工作进展进行研究,为未来国内企业在抗体生产过程中可能出现的问题提供解决方法。
[1] TOP 20 best-selling drugs of 2012. [2013-03-05]. http://www. genengnews.com/insight-and-intelligence/top-20-best-selling-drugs-of -2012/77899775/.
[2] Liu BN. The progress of therapeutic antibody drug and the industrial key-technology of antibody production. China Biotechnol, 2013, 33(5): 132-138. (in Chinese)
刘伯宁. 治疗性单抗与抗体产业关键技术. 中国生物工程杂志, 2013, 33(5):132-138.
[3] Li HQ, Cai JX, Zhang YB. Construction strategy of Chinese hamster ovary cell line with high expression of therapeutic antibodies. Chin Med Biotechnol, 2013, 8(3):220-224. (in Chinese)
李浩强, 蔡洁行, 张玉彬. 治疗性抗体表达CHO细胞株构建策略.中国医药生物技术, 2013, 8(3):220-224.
[4] Liu BN. The lasted development of large scale cell culture technology for commercial antibody manufacture. China Biotechnol, 2013, 33(7): 103-111. (in Chinese)
刘伯宁. 用于重组抗体生产的细胞大规模培养技术. 中国生物工程杂志, 2013, 33(7):103-111.
[5] Duan XJ, Liu R, Xu WT, et al. Effect of cell culture conditions on antibody heterogeneity. Chin J Biotechnol, 2013, 29(11):1-7. (in Chinese)
段须杰, 刘睿, 徐卫涛, 等. 细胞培养工艺条件对抗体异质性影响的研究进展. 生物工程学报, 2013, 29(11):1-7.
[6] Lahille AP, Richard C, Fisch S, et al. Comparing Fed-batch cell culture performances of stainless steel and disposable bioreactors. BioPharm Int, 2011, 24(1):35.
[7] Smelko JP, Wiltberger KR, Hickman EF, et al. Performance of high intensity fed-batch mammalian cell cultures in disposable bioreactor systems. Biotechnol Prog, 2011, 27(5):1358-1364.
[8] Li F, Vijayasankaran N, Shen AY, et al. Cell culture processes for monoclonal antibody production. MAbs, 2010, 2(5):466-479.
[9] Marques MP, Cabral JM, Fernandes P. Bioprocess scale-up: quest for the parameters to be used as criterion to move from microreactors to lab-scale. J Chem Technol Biotechnol, 2010, 85(9):1184-1198.
[10] Nienow AW. Reactor engineering in large scale animal cell culture. Cytotechnology, 2006, 50(1-3):9-33.
[11] Zhang H, Wang W, Quan C, et al. Engineering considerations for process development in mammalian cell cultivation. Curr Pharm Biotechnol, 2010, 11(1):103-112.
[12] Senger RS, Karim MN. Effect of shear stress on intrinsic CHO culture state and glycosylation of recombinant tissue-type plasminogen activator protein. Biotechnol Prog, 2003, 19(4):1199-1209.
[13] Keane JT, Ryan D, Gray PP. Effect of shear stress on expression of a recombinant protein by Chinese hamster ovary cells. Biotechnol Bioeng, 2003, 81(2):211-220.
[14] Trinh K, Garcia-Briones M, Chalmers JJ, et al. Quantification of damage to suspended insect cells as a result of bubble rupture. Biotechnol Bioeng, 1994, 43(1):37-45.
[15] Gigout A, Buschmann MD, Jolicoeur M. The fate of Pluronic F-68 in chondrocytes and CHO cells. Biotechnol Bioeng, 2008, 100(5):975-987.
[16] Serrato JA, Palomares LA, Meneses-Acosta A, et al. Heterogeneous conditions in dissolved oxygen affect N-glycosylation but not productivity of a monoclonal antibody in hybridoma cultures. Biotechnol Bioeng, 2004, 88(2):176-188.
[17] Schmelzer AE, Miller WM. Hyperosmotic stress and elevated pCO2 alter monoclonal antibody charge distribution and monosaccharide content. Biotechnol Prog, 2002, 18(2):346-353.
[18] deZengotita VM, Schmelzer AE, Miller WM. Characterization of hybridoma cell responses to elevated pCO(2) and osmolality: intracellular pH, cell size, apoptosis, and metabolism. Biotechnol Bioeng, 2002, 77(4):369-380.
[19] Zhu MM, Goyal A, Rank DL, et al. Effects of elevated pCO2 and osmolality on growth of CHO cells and production of antibody-fusion protein B1: a case study. Biotechnol Prog, 2005, 21(1):70-77.
[20] Mostafa SS, Gu X. Strategies for improved dCO2 removal in large-scale fed-batch cultures. Biotechnol Prog, 2003, 19(1):45-51.
[21] Langheinrich C, Nienow AW. Control of pH in large-scale, free suspension animal cell bioreactors: alkali addition and pH excursions. Biotechnol Bioeng, 1999, 66(3):171-179.
[22] Goudar CT, Matanguihan R, Long E, et al. Decreased pCO(2) accumulation by eliminating bicarbonate addition to high cell-density cultures. Biotechnol Bioeng, 2007, 96(6):1107-1117.
[23] Takuma S, Hirashima C, Piret JM. Dependence on glucose limitation of the pCO2 influences on CHO cell growth, metabolism and IgG production. Biotechnol Bioeng, 2007, 97(6):1479-1488.
[24] Enfors SO, Jahic M, Rozkov A, et al. Physiological responses to mixing in large scale bioreactors. J Biotechnol, 2001, 85(2):175-185.
[25] Rathore AS, Krishnan R, Tozer S, et al. Scaling down of biopharmaceutical unit operations part 1: Fermentation. BioPharm Int, 2005.
[26] Li F, Hashimura Y, Pendleton R, et al. A systematic approach for scale-down model development and characterization of commercial cell culture processes. Biotechnol Prog, 2006, 22(3):696-703.
[27] Huang YM, Hu W, Rustandi E, et al. Maximizing productivity of CHO cell-based fed-batch culture using chemically defined media conditions and typical manufacturing equipment. Biotechnol Prog, 2010, 26(5):1400-1410.
[28] Mire-Sluis A, Ma S, Markovic I, et al. Extractables and leachables. Bioprocess Int, 2011, 9(2):14-23.
10.3969/cmba.j.issn.1673-713X.2013.06.015
“重大新药创制”国家科技重大专项(2012ZX09105301)
210042 南京,江苏先声药业有限公司,Email:duanxujie@ simcere.com
2013-09-09

