阿莫西林克拉维酸钾干混悬剂(14:1)的质量标准研究※
欧阳亦华李瑞明
阿莫西林克拉维酸钾干混悬剂(14:1)的质量标准研究※
欧阳亦华1李瑞明2
目的对阿莫西林克拉维酸钾干混悬剂(14:1)的质量标准内容进行了研究。方法通过对质量标准的研究,对质量控制的各个方面进行完整的考察,从而确定制剂的保存方法和质量控制指标。结果与结论阿莫西林克拉维酸钾干混悬剂(14:1)中阿莫西林、克拉维酸钾湿度较高时较不稳定,影响其质量问题,保存时应当注意,其它要求均能合格制剂条件。
阿莫西林;克拉维酸钾;质量标准研究
阿莫西林是青霉素类抗生素,单独用药时容易产生耐药性,阿莫西林克拉维酸钾干混悬剂是阿莫西林和克拉维酸钾的复方制剂,β-内酰胺酶抑制剂克拉维酸钾能明显提高阿莫西林对其耐药菌的活性,故阿莫西林配合克拉维酸钾使用时疗效更好,且对革兰阳性及革兰阴性细菌均有效[1-3]。本文主要针对阿莫西林克拉维酸钾干混悬剂(14:1)进行质量标准的研究,从而确定阿莫西林和克拉维酸配比情况下的制剂保存和质量控制指标[4]。
1 仪器与试剂
1.1 试验方法参照中国药典2010年版二部。岛津LC-10AT型高效液相色谱仪,SPD-10A紫外检测器,浙江大学N2000色谱管理系统,色谱柱:Diamonsil C18,5μm,Φ4.6×200mm,北京迪马公司,柱温:室温;pHS-10A数字酸度计。
1.2 色谱条件与系统适应性试验用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液[取磷酸二氢钠7.8g,加水900ml溶解,用磷酸或10mol/L氢氧化钠溶液调节PH值至(4.4±0.1),加水稀释至1000ml]-甲醇(95:5)为流动相;流速:1.0ml/min;检测波长为220nm。阿莫西林峰与克拉维酸峰的分离度应大于3.5,理论板数按阿莫西林及克拉维酸计算均应不低于2000。
1.3 样品来源本品所含的两种组分阿莫西林和克拉维酸钾均由江西制药有限责任公司提供。批号:200101003,含量:阿莫西林(C16H19N3O5S)为77.32%;克拉维酸钾(C8H8KNO5)以克拉维酸计为5.50%。经按中国药典2010年版二部检验符合规定。阿莫西林600mg(以无水物计):克拉维酸钾42.9mg(以克拉维酸计),样品批号:010506、010508、010510。阿莫西林对照品,批号:0409-9907,含量84.5%;克拉维酸对照品,批号:0429-9902,含量:91.3%,均由中国药品生物制品检定所提供。
2 方法与结果
2.1 性状
2.1.1 外观性状本品原料为白色粉未,所用辅料均为白色。经对试制的三批样品进行检查,结果均为白色粉末。考虑到本品原辅料颜色变化可能对成品颜色带来的影响,参考阿莫西林克拉维酸钾其它口服制剂质量标准的外观性状描述,将其性状描述为:本品为白色或类白色粉末。
2.1.2 吸湿情况取阿莫西林克拉维酸钾(14:1)干混悬剂010506批,去除外包装袋后,分别露置于装有饱和氯化钠水溶液(相对湿度75%)和装有饱和硝酸钾水溶液(相对湿度92.5%)的干燥器中,分别在1、2、3、4、5、6、7、8、9、10、11、12、24、48、72、96、120、240h取出称量,计算增重的百分数。结果表明,本品具有较强引湿性,在相对湿度为75%的条件下吸湿达3.7%后趋于饱和;在相对湿度为92.5%的条件下放置10d,吸湿达9%。
2.2 鉴别本品是由两类不同结构的化合物混合加适当的辅料制成的,参考同类混合制剂的鉴别方法采用高效液相色谱法(HPLC法)鉴别。在含量测定项下记录的色谱图中,供试品溶液的两主峰保留时间应与对应的对照品溶液中阿莫西林对照品和克拉维酸对照品的保留时间一致(保留时间相差应不得过5%)。经检验三批样品,结果见表1。

表1 阿莫西林与克拉维酸钾(14:1)干混悬剂鉴别结果(min)
2.3 检查
2.3.1 PH值的测定试验方法:取阿莫西林克拉维酸钾(14:1)干混悬剂适量,加水制成每1ml中约含阿莫西林10mg的溶液,依法(中国药典2010年版二部附录Ⅵ H)测定。定位溶液:邻苯二甲酸氢钾标准缓冲液(PH=4.00,T=25℃),核对溶液:磷酸盐标准缓冲液(PH=6.86,T=25℃)。对三批样品按上述方法检查,样品010506、010508、010510的PH值结果分别为4.35、4.28、4.41。
2.3.2 溶液的沉降体积比参考中国药典2010年版二部附录ΙΟ混悬剂项下的沉降体积比的检查方法,取阿莫西林克拉维酸钾(14:1)干混悬剂10包,置于具塞量筒中,加水至50ml振摇1min,混合均匀,记录此时混悬物的高度(Ho),放置3h后记录此时混悬物的高度(H)。计算H/Ho的结果,即为沉降体积比。对三批样品按上述方法检查,沉降体积比均在药典规定范围。
2.3.3 混悬剂的分散性参考中国药典2010年版二部附录ΙΟ混悬剂项下的有关规定,取阿莫西林克拉维酸钾(14:1)干混悬剂5包,置于烧杯中,加入50ml水搅拌5min,分别对三批样品进行检查,混悬剂均分散均匀,无异物。
2.3.4 水分阿莫西林克拉维酸钾(14:1)干混悬剂中的阿莫西林为三水化合物(每分子含有三个结晶水),其水分含量较高,克拉维酸分子中不含有结晶水,参照阿莫西林水分测定法,采用卡尔-费休氏水分测定法测定其含水量。取本品150mg,按中国药典2010年版二部附录Ⅷ M水分测定法第一法进行测定。对三批样品按上述方法检查,样品010506、010508、010510的水分测定结果分别为4.7%、4.8%、4.6%。
2.3.5 装量差异取本品三批各10包,除去外包装,分别精密称定每一包内容物的重量,求出每包内容物的装量与平均装量,三批样品称定结果见表2。
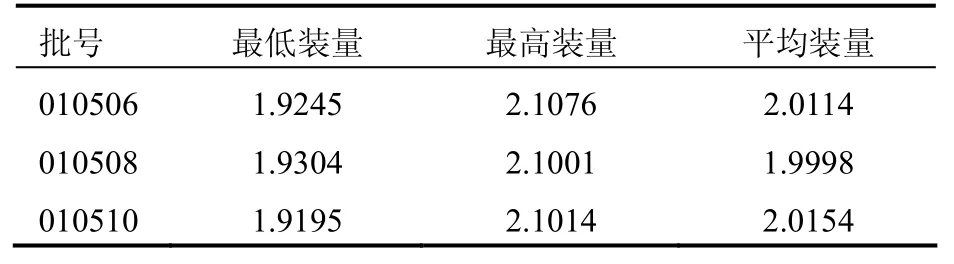
表2 阿莫西林克拉维酸钾(14:1)干混悬剂的装量差异结果(g)
2.3.6 样品含量均匀度取本品1小包,照含量均匀度测定法(中国药典2010年版二部附录Х E),置于500ml量瓶中,加水使溶解,并稀释至刻度,摇匀。滤过,精密量取续滤液20ml置25ml量瓶中,加水稀释至刻度,摇匀。取10μl注入液相色谱仪,记录色谱图;另取克拉维酸对照品适量,加水溶解,制成每1ml中约含克拉维酸0.07mg的溶液,同法测定。按外标法以峰面积计算供试品中C5H9NO5的含量。三批样品中克拉维酸钾的含量均匀度,结果见表3。
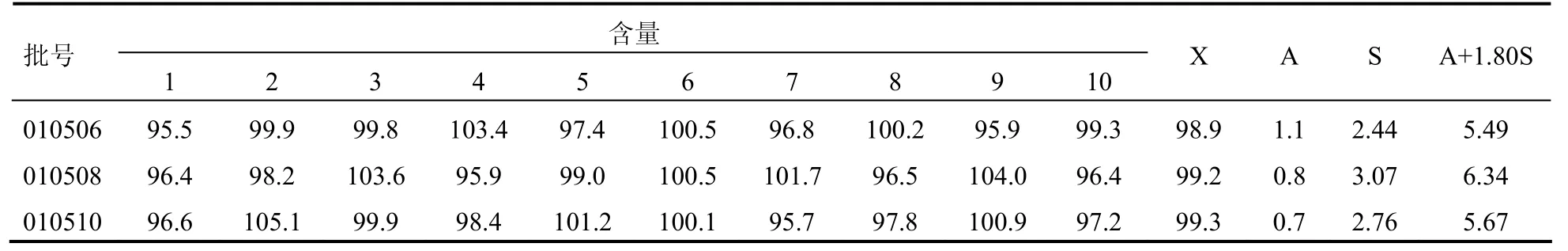
表3 各批号克拉维酸钾含量均匀度测定结果(%)
2.3.7 微生物限度根据中国药典2010年版二部附录的要求,阿莫西林克拉维酸钾干混悬剂属抗细菌的抗生素,应进行霉菌检查。经对三批样品的霉菌检查,样品010506、010508、010510的霉菌结果均小于10个/g。
2.3.8 有关物质试验方法:参照中国药典2010年版二部收载品种阿莫西林克拉维酸钾片的含量测定方法——高效液相色谱法(中国药典2010年版二部附录Ⅴ D),确定本品有关物质测定法为高效液相色谱法,其有关物质的考察采用自身对照法。测定法:精密吸取对照溶液10μl,注入高效液相色谱仪,调节仪器灵敏度,使阿莫西林峰高约为满量程的20~25%。再精密吸取供试品溶液与对照溶液各10μl,注入高效液相色谱仪,记录色谱图至主峰保留时间的2.5倍,供试品溶液的色谱图中各杂质峰面积之和与对照溶液(1%)主峰面积之和相比,计算出有关物质的量。采用自身对照法计算样品中有关物质的含量,样品010506、010508、010510的结果分别为0.62%、0.64%、0.65%。
2.3.9 最低检出量取对照品溶液,逐级稀释后,依上述有关物质测定方法检测,记录色谱图,以主峰响应信号为噪声3倍作为最小可检测的信号(S/N≈3),当对照品溶液中的克拉维酸稀释至3.5ng/ml时,得克拉维酸最低检测量为0.035ng。继续稀释,当对照品溶液中的阿莫西林稀释至5ng/ml时,得阿莫西林最低检测量为0.05ng。色谱图见图1、2。
图1 克拉维酸最低检出量HPLC图

图2 阿莫西林最低检出量HPLC图
3 结果与讨论
阿莫西林克拉维酸钾干混悬剂为了便于保存,方便携带和使用的一种在临床上常用的抗感染药,主要成分在分子结构上均为含p-内酞胺结构的化合物,对光、热、湿度均不稳定,阿莫西林克拉维酸钾干混悬剂(7:1)已有上市产品,但不同比例的干混悬剂在使用中由于阿莫西林克拉维酸钾两者比例的不同,从而影响每天需要服用的次数和剂量。
本研究制剂是采用阿莫西林和克拉维酸钾(14:1)比例制成的干混悬剂。本文对其质量标准进行了研究,从而得出是否在此比例时的阿莫西林克拉维酸钾干混悬剂更稳定,更有利临床使用。通过对(14:l)干混悬剂质量标准考察,显示湿度是影响其稳定性的最关键性因素,尤其对克拉维酸钾的影响极大,因此本品在制备和贮藏过程中,应严格控制环境湿度,同时制剂需采用棕色玻璃瓶包装,瓶口压铝箔纸板复合内盖密封封口,才能确保在有效期内的产品质量。
干混悬剂把药物与辅料共同以干粉形式贮存,而使用时加入溶液后则以混悬液形式供口服,因此特别适于对水、湿度不稳定的药物;干混悬剂也可用于儿童和部分有吞咽困难的成人,在临床上是值得研发的一种新剂型。
[1] 中华人民共和国药典委员会.中国药典(二部)[M].北京:化学工业出版社,2010.
[2] The United States Pharmacopeial Convention. United States Plarmacop eia(USP)XXIX[S],2005.
[3] 张珂.HPLC法测定阿莫西林克拉维酸钾颗粒的含量[J].药学进展,2007,31(5):221-224.
[4] 吴小玉,常学军,李嘉宇,等.阿莫西林克拉维酸钾(7:l)干混悬剂工艺及稳定性研究[J].中国药师,2006,9(5):394-397.
The study of quality standards on Amoxicillin and Clavulanate Potassium for Suspension(14∶1)
Ouyang Yihua Li Ruiming
ObjectiveTo study the quality standards of amoxicillin and clavulanate Potassium for Suspension (14∶1).MethodsQuality standards, quality control of all aspects of a complete investigation to determine the save method of preparation and quality control indicators.Results and ConclusionAmoxicillin and clavulanate Potassium for Suspension (14∶1) when with a high relative humidity will be less stability, affecting its quality problems, should be saved in proper material.
Amoxicillin; Clavulanate Potassium; Quality control
R927.11
A
1673-5846(2013)02-0056-03
1 广州市番禺区人口和计划生育服务站药剂科,广东广州 511400
2 中山大学附属第一医院药学部,广东广州 510080
广东省重大科技专项项目(2011A080300004);广州市生物产业示范工程发展专项项目(2012-243)
欧阳亦华(1971-9),男,本科,主管药师,主要研究方向为医院药学。E-mail:617888649@qq.com。
李瑞明(1974-7),男,本科,主管药师,主要研究方向为医院制剂。E-mail:liruiming321@163.com。

