补料分批发酵泡沫分离耦合对乳链菌肽生产的影响*
郭凯敏,崔小颖,张达,郑辉杰,吴兆亮
(河北工业大学化工学院生物工程系,天津,300130)
乳链菌肽(nisin)亦称乳酸链球菌素,是由乳酸乳球菌发酵生产的一种肽类细菌素,由34个氨基酸组成[1-2],分子质量为3 500 Da。它对许多 G+菌有很强的抑制作用[3-4],且安全、无毒,广泛应用于肉制品、乳制品、发酵食品等的防腐,是国际上公认的天然食品防腐剂[5-6]。
微生物发酵生产nisin过程中,nisin对细胞生长特别是自身的合成具有显著的抑制作用,从而限制了nisin产量的提高,因此解除产物的抑制作用将会大幅度提高产量[7-9]。在以往报道的发酵分离耦合过程中,其分离方法如吸附法[10]、膜分离[8]等方法往往因存在成本高、操作困难等问题,使发酵分离耦合过程难以实现工业化生产。因此,寻找一种合适的分离方法来实现发酵分离耦合显得尤为重要。泡沫分离又称泡沫吸附分离[11],是一种简单、高效的分离方法,其根据表面吸附原理,向含有表面活性物质的液体中鼓泡,使液体内的表面活性物质聚集在气液界面,在液相主体上方形成泡沫层,将泡沫层和液相主体分开,就可以得到浓缩表面活性物质的目的。它因具有成本低,效率高,操作简单,容易实现规模化生产等优点,已经成功应用于多种表面活性剂的分离[12-15]。对于 nisin,其分子结构既有亲水基团,又有疏水基团,具有一定的表面活性,可以将泡沫分离技术和发酵进行耦合来进行生产。
本文首先确定了发酵泡沫分离耦合的最佳操作条件,并在此条件下,进行了发酵分离耦合实验。在此基础上,研究了补料结合的发酵分离耦合,并对不同的发酵工艺进行了对比。
1 材料和方法
1.1 实验材料
1.1.1 菌株
生产菌株:乳酸乳球菌菌株,由天津康益生物工程有限公司提供。
效价检测菌株:藤黄八叠球菌,购于中国科学院微生物所菌种保藏中心。
1.1.2 培养基
发酵培养基(g/L):蛋白胨 3.8,酵母膏 1.9,蔗糖40,KH2PO415,NaCl 2,MgSO40.2,玉米浆 25;pH 7.6,121 ℃灭菌20 min。
检测培养基(g/L):蛋白胨8,酵母浸粉5,NaCl 5,葡萄糖 5,Na2HPO42,琼脂 7.5,吐温 20 5 mL/L;pH 7.2,121 ℃灭菌20 min。
1.1.3 发酵泡沫分离耦合操作装置图
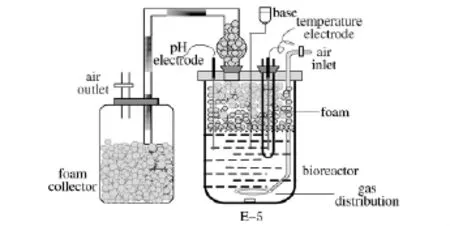
图1 发酵泡沫分离耦合装置图Fig.1 The diagram of fermentation coupled with foam separation
发酵泡沫分离耦合操作装置如图1所示(恒温磁力搅拌器在图中未显示),在进行耦合操作时,通过空气分布器向发酵罐中通入无菌空气产生气泡,根据表面吸附原理,发酵液中具有表面活性的物质吸附在气泡的气液相界面上,随着气泡的上升,在发酵液上方形成泡沫层。这时,泡沫层中的持液量很高,由于泡沫排液,上升的泡沫层持液量逐渐减少达到稳定值,最后收集该泡沫,得到浓缩的产物,从而缓和或解除了发酵液中产物的抑制作用。
1.2 实验方法
1.2.1 检测方法
根据文献[16]采用琼脂扩散法(ADT)定量分析nisin效价,根据文献[17]采用比浊法测定菌体生长曲线。
1.2.2 发酵泡沫分离耦合操作条件的优化
在发酵的第8 h开始进行泡沫分离耦合操作,这是因为:一方面,nisin发酵在第8 h开始进入稳定期,这时进行耦合操作对生产菌的生长影响较小;另外,此时发酵液中已积累一定量的nisin,需要及时移除以便缓解产物的抑制作用。
在进行泡沫分离耦合时,由于进行通气操作不可避免地会对发酵产生影响,这可能是由于通入的气体对生产菌及nisin的活性有影响[18],也可能是由于通气时形成的剪切力造成的nisin失活。因此,必须要对耦合操作条件进行优化,使产物nisin的损失降到最低。在之前本课题组的研究中[18],确定了nisin发酵的最适pH梯度(5.75~6.25)、理想的通气速率(30~50 mL/min)和通气持续时间(60~120 min)。在此基础上,本文通过正交试验对通气速率、发酵的pH值和通气持续时间这3个因素进行优化,确定最适的耦合操作条件,使nisin的损失最小。下面为正交试验设计表(表1)。
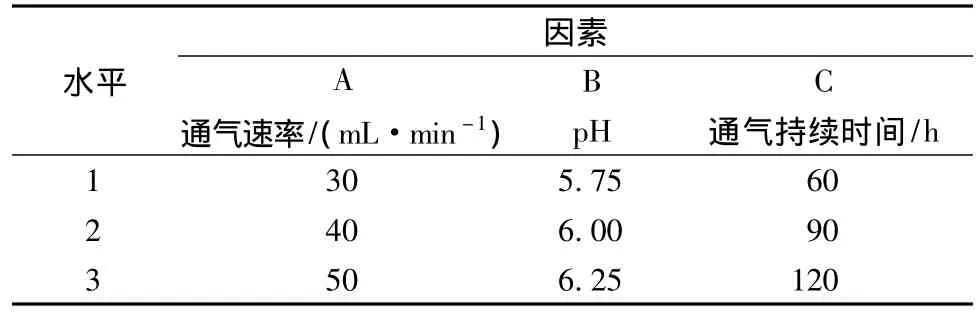
表1 正交试验因素及水平表Table 1 Experimental factors and levels for orthogonal-designing experiments
1.2.3 底物起泡性能和补料组分的确定
发酵泡沫分离耦合过程中生成的产物nisin和营养组分不可避免地会随着形成的泡沫带出反应体系,因此补料对于细胞生长和nisin生产都具有重要的影响。补料组分的确定应遵循以下原则,即某种营养物质的起泡性能越好也就越容易被带出反应体系,也就越需要向反应体系中补充其含量。底物的起泡性能通过罗氏泡沫仪在30℃下进行测定。
1.2.4 补料时间的确定
在分批发酵中,自发酵开始后每1 h取1次样,测定菌体生长曲线、蔗糖消耗曲线和nisin合成曲线以确定合适的补料时间。
1.2.5 补料体积的确定
分别将 0、50、100、150、200 和 250 mL 的补料溶液在发酵的第12 h加入到发酵体系中,测定各组的nisin效价,确定合适的补料体积。
1.2.6 不同生产工艺对nisin发酵的影响
按4种方式分别进行发酵:(1)进行非补料非耦合的发酵(对照组);(2)进行耦合的发酵(耦合组);(3)进行只有补料的发酵(补料组);(4)进行既补料又耦合的发酵(补料耦合组)。测定每种发酵方式的单位nisin效价以及总产量,进行比较。
2 结果与讨论
2.1 发酵泡沫分离耦合操作条件的确定
在nisin发酵泡沫分离耦合过程中,由于通气速率、pH值和通气持续时间对发酵的影响比较大,因此本部分以产物nisin的失活率(I)为指标通过正交试验来考察这3个因素对nisin生产的不利影响。正交试验的分析结果见表2。
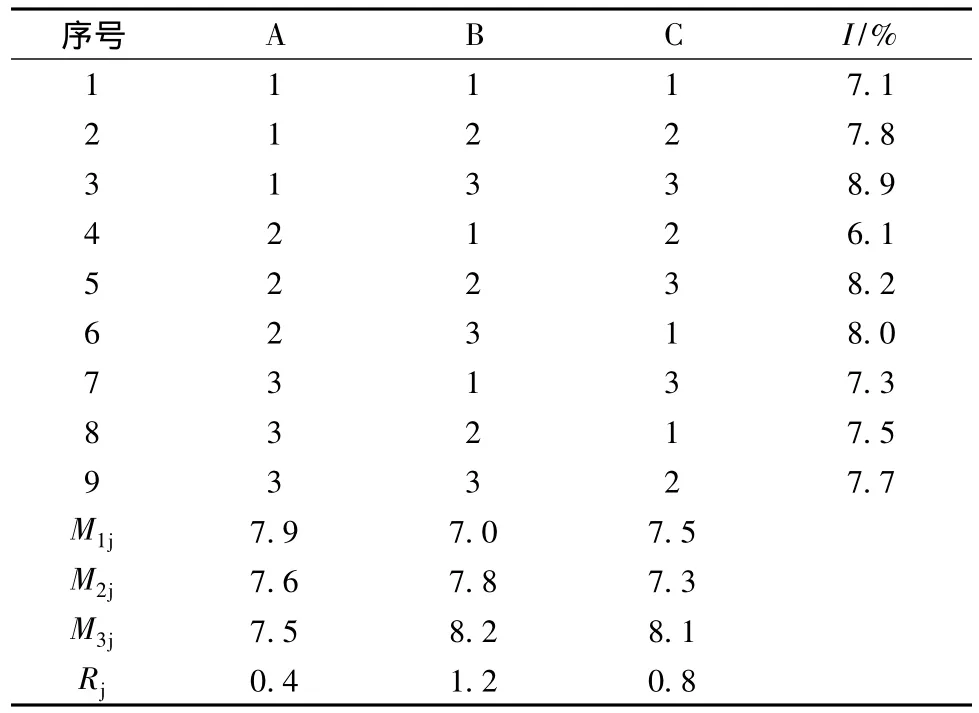
表2 正交试验结果分析Table 2 Analysis of orthogonal-designing experiments
nisin的失活率(I)在进行耦合操作结束时进行计算,以没有进行耦合操作的发酵作为对照组。计算方式如下:
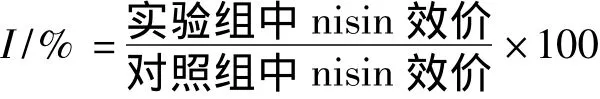
其中,实验组中的nisin效价包括发酵液和泡沫液中的nisin效价。
在表2中,Tij(i=1,2,3)分别为不同因素不同水平实验结果的总和;Mij(i=1,2,3;j=1,2,3)分别为不同因素不同水平实验结果的平均值;Rj分别为各因素列的极差。
对极差进行分析,由于RB>RC>RA,即影响nisin失活率的3个实验因素的主次关系为B(pH)>C(通气持续时间)>A(气速),可得到较好的试验条件为 A2B1C2,即气速为 40 mL/min,pH 为 5.75,通气持续时间为90 min的耦合操作可以得到最小的nisin失活率6.1%。
在上述优化条件下进行重复实验,并与对照组进行比较,结果如图2所示。
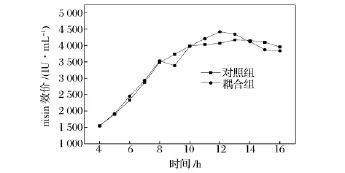
图2 发酵泡沫分离耦合对nisin效价的影响Fig.2 Effects of fermentation coupled with foam separation on nisin activity
由图2可知,与对照组相比,在进行耦合操作之后,得到nisin的失活率为5.75%。但是,在之后的发酵过程中,nisin效价持续上升并在发酵的第12 h达到最大4 422 IU/mL。这表明,进行泡沫分离耦合操作有利于nisin的发酵生产,这主要归因于nisin产物抑制作用的解除或缓和,这与很多的报道相一致[8-10]。但是与对照组的最大nisin效价4 173 IU/mL相比较,并没有太大的提高,而且达到最大值后nisin效价下降也较快,这可能是因为在发酵过程中,由于菌体对营养物质的消耗以及耦合操作过程中营养物质随上升的泡沫被带出从而导致营养物质不足造成的。因此,有必要在发酵的第12 h进行补料来验证耦合操作实验。
2.2 底物起泡性能和补料组分的确定
在进行补料之前,首先对发酵液中各营养组分的起泡性能进行了测定。结果如表3所示。

表3 发酵液中各组分的起泡性能Table 3 Foaming properties of components in the fermentation media
由表3可知,反应体系中玉米浆的起泡性能最好,酵母膏和蛋白胨次之,而碳源(蔗糖)的起泡性能较差。这表明反应体系中氮源(玉米浆,酵母膏和蛋白胨)会被大量带出来,需要补充其含量。蔗糖虽然不易被带出反应体系,但由于耦合过程中解除了nisin对菌体生长的抑制,菌体需要更多的碳源来满足其快速生长的能量需求,因此蔗糖液需要进行补加,这些补加组分浓度与初始发酵液浓度相一致。
2.3 补料时间的确定
nisin的分批发酵如图3所示,在发酵的0~3 h为菌体生长的延滞期,此时蔗糖的消耗量以及nisin的生成量都很少。之后菌体进入指数生长期,到第14 h时菌体迅速增加至最大值,此时细胞干重为4.10 g/L。同时随着菌体在指数期的迅速增大,nisin也随着迅速生成,在发酵的第13 h nisin的效价达到最大值4 173 IU/mL,此时蔗糖消耗殆尽。从图3中可以看到在发酵的第12 h,蔗糖浓度已下降至10 g/L,而且在耦合操作过程中,会有一部分营养组分随形成的泡沫液带出,因此应在此时进行补料,防止蔗糖浓度过低影响最终nisin的产量。
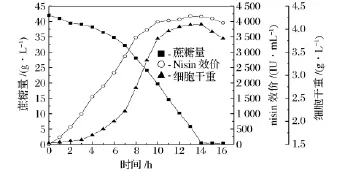
图3 乳链菌肽分批发酵曲线图Fig.3 The curve of nisin production in batch fermentation
2.4 补料体积的确定
在耦合发酵的第12 h,向发酵反应体系中分别补加0、50、100、150、200 和250 mL 的料液(2.2 确定的营养物),其结果如图4所示,在补加不同体积的料液后,发酵液中的nisin效价都有明显的下降,并且随着补加料液体积的增加,nisin效价下降的幅度增加,这主要是由于补料对发酵液稀释的作用导致的。可以看到,随着发酵的进行,发酵液中的nisin效价显著上升,并且补料体积为100 mL时,取得最高的nisin效价4 813 IU/mL,这表明在发酵后期的补料促进了nisin的合成。较大的补料体积不仅会造成底物的抑制,而且会增加生产成本,而低的补料体积不足以弥补耦合过程中带出的营养成分,综合考虑,选取100 mL为补料体积。
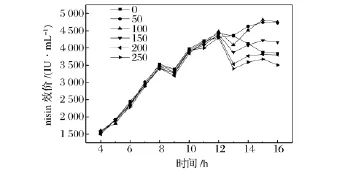
图4 不同补料体积对发酵耦合泡沫分离生产nisin的影响Fig.4 Effects of different feeding volume on fermentation coupled with foam separation producing nisin
2.5 不同生产工艺对nisin发酵的影响
4种不同的发酵工艺对发酵过程的nisin效价和nisin产量的影响分别见图5a和图5b。
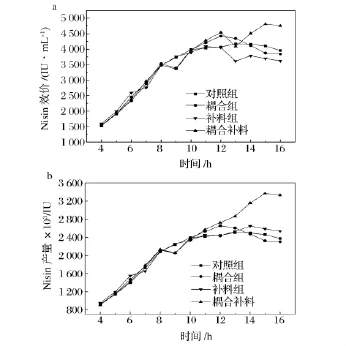
图5 不同发酵工艺对nisin生产的影响Fig.5 Effects of different fermentation technologies on nisin production
图5的结果表明,与对照组相比,补料组在发酵第12 h至第13 h nisin效价显著下降,nisin产量增加缓慢,其主要原因是在发酵第12 h补料溶液的稀释作用结果。随着发酵的进行,由于补料促进了nisin的合成速率,nisin效价和产量开始上升,在发酵的第14 h达到最高值,这与之前的研究结果是一致的[19]。
图5-a和图5-b的结果还表明,耦合组(这里包括耦合补料组和耦合不补料组)与对照组相比,在发酵时间第8~9 h内nisin效价和产量同时下降,这是由于耦合过程中的通气影响了乳酸乳球菌的生长,从而使nisin合成受到影响,另外有部分nisin在通气过程中失活也是造成效价和产量下降的原因。停止通气后菌体生长逐渐恢复正常且nisin抑制作用被解除,因此nisin效价和产量在发酵第9~12 h内效价迅速增加。随后,由于补料的稀释作用,耦合补料组的nisin效价在发酵第12~13 h内明显降低。此后,随着发酵的进行,由于补料促进了nisin的合成速率,该组的nisin产量和效价均大幅提高,最终发酵末期时(发酵第15 h)nisin总效价(4 813 IU/mL)和产量(3.37×106IU)相对于对照组(4 097 IU/mL和2.46×106IU)分别提高了17.5%和37.0%。耦合不补料组的效价和产量自第13小时逐步降低,发酵末期时该组的效价和产量分别为3 875 IU/mL和2.33×106IU,较对照组均降低了5.7%和5.6%。其原因是发酵后期营养组分的缺乏影响了细胞生长,且部分nisin在耦合过程中失活,从而影响了nisin的效价和产量。
3 结论
通过正交试验确定了合适的耦合操作条件为气速40 mL/min,pH 5.75,通气持续时间为90 min。在此条件下,耦合发酵中nisin的失活率为6.1%,重复试验,得到nisin的失活率为5.7%。在该条件下的耦合发酵过程中进行补料,结果表明,该工艺可使反应体系中的nisin效价和产量分别达到4 813 IU/mL和3.37×106IU,与对照组相比较分别提高了17.5%和 37.0%。
[1] Stringer S C,Dodd C E R,Morgan M R A,et al.Locating nisin-producing Lactococcus lactis in a fermented meat system[J].Journal of Applied Microbiology,1995,78(4):341-348.
[2] Zhang Fang,Wu Zhao-liang,Wu Zeng-jiang,et al.Effect of ionic strength on the foam separation of nisin from the fermentation broth[J].Separation and Purification Technology,2011,78(1):42-48.
[3] Hurst A.Nisin[J].Advances in Applied Microbiology,1981,27:85-123.
[4] Meghrous J,Lacroix C,Simard R E.The effects on vegetative cells and spores of three bacteriocins from lactic acid bacteria[J].Food Microbiology,1999,16(2):105-114.
[5] Rayman M,Aris B,Hurst A.Nisin:a possible alternative or adjunct to nitrite in the preservation of meats[J].Applied and Environmental Microbiology,1981,41(2):375.
[6] Ruiz A,Williams S,Djeri N,et al.Nisin,rosemary,and ethylenediaminetetraacetic acid affect the growth of Listeria monocytogenes on ready-to-eat turkey ham stored at four degrees Celsius for sixty-three days[J].Poultry Science,2009,88(8):1 765-1 772.
[7] Kim W S.Nisin production by Lactococcus lactis using two-phase batch culture[J].Letters in Applied Microbiology,1997,25(3):169-171.
[8] Pongtharangku T,Demirci A.Online recovery of nisin during fermentation and its effect on nisin production in biofilm reactor[J].Applied Microbiology and Biotechnology,2007,74(3):555-562.
[9] Simsek Ö,Saris P.Cycle changing the medium results in increased nisin productivity per cell in Lactococcus lactis[J].Biotechnology Letters,2009,31(3):415-421.
[10] 徐浩,吴兆亮,殷浩,等.发酵吸附分离耦合生产乳酸链球菌素工艺研究[J].高分子材料科学与工程,2010,26(10):155-158.
[11] 王斐,南碎飞,窦梅,等.超滤与泡沫分离内耦合应用于表面活性物质浓缩分离的实验研究[J].化工学报,2010,5(61):1 157-1 162.
[12] Davis D A,Lynch H C,Varley J.The application of foaming for the recovery of Surfactin from B.subtilis ATCC 21332 cultures[J].Enzyme and Microbial Technology,2001,28(4/5):346-354.
[13] Chen C Y,Baker S C,Darton R C.Batch production of biosurfactant with foam fractionation[J].Journal of Chemical Technology & Biotechnology,2006,81(12):1 915-1 922.
[14] Zhang Q,Lo C-M,Ju L-K.Factors affecting foaming behavior in cellulase fermentation by Trichoderma reesei Rut C-30 [J].Bioresource Technology,2007,98(4):753-760.
[15] 杨全文,吴兆亮,殷昊,等.螺旋构件强化排液的泡沫分离塔用于牛血清蛋白分离[J].化工学报,2011,62(4):1 000-1 005.
[16] 张国只,陈林海,杨天佑,等.琼脂扩散法测定乳链菌肽效价的优化[J].食品科学,2007,28(3):175-178.
[17] 吴兆亮,宫里鹏,赵艳丽,等.乳链菌肽发酵工艺的研究[J].化学反应工程与工艺,2006,22(4):377-380.
[18] Liu Wei,Zheng Hui-jie,Wu Zhao-liang,et al.Effects of pH profiles on nisin fermentation coupling with foam separation [J].Applied Microbiology and Biotechnology,2010,85(5):1 401-1 407.
[19] Wu Zhao-liang,Wang Lin,Jing Ying-jun,et al.Variable volume fed-batch fermentation for nisin production by Lactococcus lactis subsp.lactis W28 [J].Applied Biochemistry and Biotechnology,2009,152(3):372-382.

