杂交狗牙根内生固氮菌的接种效果
李凤娇,毛中伟,黎瑞君,刘天增,张巨明
(华南农业大学农学院草业科学系,广东 广州 510642)
杂交狗牙根(Cynodondactylon×Cynodontransvaalensis)在我国南方地区高尔夫球场上广泛使用,其质地细密、颜色深绿,但管理要求高。为了使草坪保持良好的颜色和生长状态而施用大量氮肥,不仅成本高,还会对环境造成污染。如何在减少氮肥使用量的同时维持草坪的正常生长,减少氮素对环境的影响,成为高尔夫球场可持续发展的重要课题。
植物内生固氮菌是一类定殖于健康植物体内,与宿主植物进行联合固氮的微生物,通过固氮作用为植物提供氮素,同时可产生生理活性物质促使宿主适应环境,在农业生产中具有重要的应用潜力[1]。
植物内生固氮菌存在于一些非豆科植物中,到目前为止,已有文献报道的内生固氮菌均为内生固氮细菌[1-2]。近年来在甘蔗(Saccharumofficinarum)、玉米(Zeamays)、水稻(Oryzasativa)等作物和一些牧草中发现了多种具有固氮功能的内生细菌,引起了学术界的高度关注,现已成为生物固氮研究的活跃领域[2-3]。近年来,研究人员已经从不同植物中分离和量化各种各样的固氮细菌,他们可能有益于植物的氮营养[4-6]。当植物与固氮细菌联合或共生时,直接受益于生物固氮作用,内生固氮菌的矿化作用则使植物间接受益。
本研究尝试将从野生狗牙根(C.dactylon)中分离出的内生固氮菌接种至人工培育的杂交狗牙根体内,摸索适宜的接种浓度和接种方法,在少施或不施氮肥的情况下通过观测草坪生长状态变化,探索利用植物内生固氮菌的可能性,以期为降低养护成本,保护生态环境,促进高尔夫球场可持续发展提供科学依据。
1 材料与方法
1.1试验材料 供试植物为天堂419杂交狗牙根,取自华南农业大学增城宁西教学试验基地。采用口径12 cm,高10 cm的塑料花盆栽培,基质为过2 mm筛的纯砂。
接种的内生固氮菌从19份野生狗牙根根、茎、叶中分离出,从中筛选出8份具代表性的固氮酶活性不同的菌株并进行固氮酶活性分析。选择固氮酶活性最高(256.09 μmol·h-1·mL-1)、中等(8.29 μmol·h-1·mL-1)、最低(0.80 μmol·h-1·mL-1)的3种混合菌液,分别将其用半固体无氮培养基培养并作为供试菌液(每次接种前用分光光度计调节至OD600≈1)。
1.2试验处理 本试验共设计3种菌液处理、3种接种方法[7-8];并设计两种尿素处理,以不接种为对照,共20个处理,每个处理4个重复,共80盆。
3种菌液处理分别为固氮酶活性最高的菌液处理(Bh)、活性中等的菌液处理(Bm)和活性最低的菌液处理(Bl);3种接种方法分别为菌液浸泡(S)、菌液浸泡+浇灌菌液6次(Si1)、菌液浸泡+浇灌菌液12次(Si2);尿素处理设不施和施尿素两处理,施尿素量为8 g·m-2。
1.3试验方法
1.3.1盆栽 参照吴彦奇等[9]的方法。盆栽时,手工撕开种苗,每盆10个草茎,均匀扦插于盆。然后覆约0.5 cm厚的中细砂,反复镇压。种植当天,按P2O5、K2O各10 g·m-2给各盆基质中施磷肥和钾肥。试验开始后,仅尿素处理每月施尿素8 g·m-2,其余处理不再施肥。试验过程中,定期定量浇水,人工拔除杂草,发生病害用百菌清防治,虫害用毒死蜱防治。
1.3.2菌液制备 内生固氮菌的保存参照田宏等[10]、路国兵等[11]、卢镇岳等[12]的方法,内生共固氮菌的活化参照李倍金等[13-14]、冯宏等[15]的方法。
1.3.3接种 从供试材料中取出800个草茎用于盆栽前处理,每盆10个。将其中720个草茎均分为3份,分别在固氮酶活性最高、中等和最低的3种内生固氮菌菌液中浸泡24 h后进行盆栽,每种菌液用量为67.824 mL;种植一个月后,给其中24盆浇灌相应菌液直到第90天,每种菌液浇灌8盆,每盆用量为2.826 mL,每半个月浇灌一次(共浇灌菌液6次,记为Si1);同时给另外24盆浇灌菌液直至清盆前半个月(210 d)停止浇灌(同上)(共浇灌菌液12次,记为Si2);剩余24盆不做菌液浇灌处理(记为S)。
1.3.4测定指标及方法 给天堂419杂交狗牙根接种各菌液之后,土壤脲酶活性的测定采用比色法[16]、土壤有效氮的测定采用碱解扩散法[17-18],分别于0、30和210 d清盆时测定土壤脲酶活性和有效氮;地上部全氮量的测定采用双氧水-硫酸快速消化、扩散定氮法[17-19],分别于0、210 d清盆时测定地上部全氮量,同时在210 d清盆时测定地下生物量;草坪颜色的测定,采用9分制对草坪颜色进行打分[20-21],于30、75、135和210 d定期观测记录草坪绿色程度。内生固氮菌固氮酶活性的测定、计算参照田宏等[10]、李倍金等[13-14]、冯宏等[15]的方法,内生固氮菌菌群密度的测定和计数参照夏娟娟[22]、张晓波[23]的方法。
1.4数据统计与分析 试验数据均以平均值表示,用Excel 2003进行数据图表分析;用SPSS 17.0统计分析软件进行多重比较,各平均数的多重比较采用邓肯氏新复极差检验法。
2 结果与分析
2.1土壤脲酶活性和土壤有效氮 结果表明,生长前期,各接种菌液类型对土壤脲酶活性、有效氮均存在显著影响(P<0.05),但后期影响差异不显著(表1、表2)。虽然接种方法并不影响土壤脲酶活性,但却影响有效氮含量,在30 d时,S、Si1处理的有效氮显著大于Si2处理及CK(P<0.05)(表2)。接种30、210 d,尿素显著增加了土壤脲酶活性(P<0.05)(表1),但对有效氮影响不显著。

表1 不同菌液类型、不同尿素处理对土壤脲酶活性的影响Table 1 Effects of bacterial liquid and urea treatment on soil urease activity mg·g-1
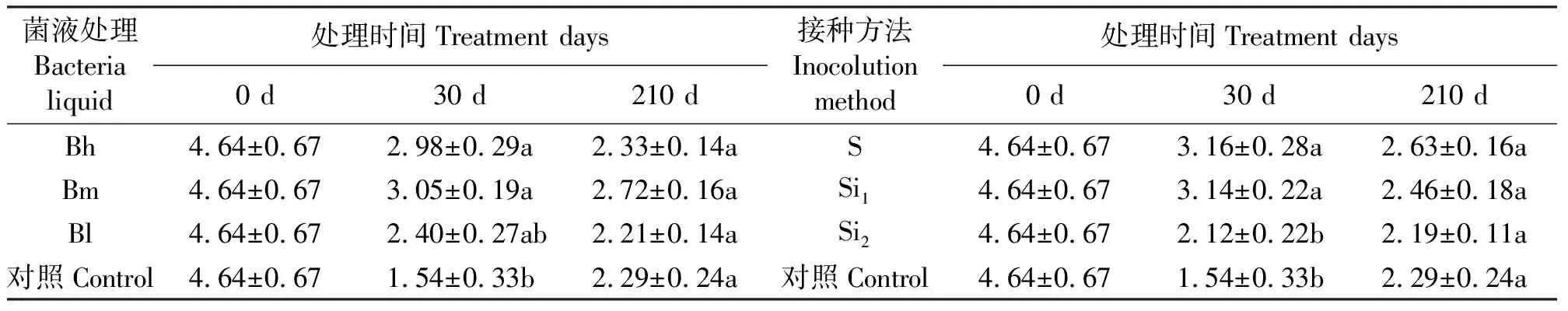
表2 不同菌液类型、不同接种方法对土壤有效氮的影响Table 2 Effects of bacterial liquid and inoculation methods on soil available N mg·kg-1
2.2地上部全氮量、地下生物量 接种后210 d时,接种菌液Bm、Bh的地上部全氮量与Bl、CK差异明显,且均远高于接种Bl;接种方法S地上部全氮量高于Si1和Si2,即植物生长过程中浇灌内生固氮菌液对天堂419杂交狗牙根地上部全氮量无显著影响。无论是菌液类型处理还是接种方法处理,它们的地上部全氮增加量都高于对照(表3)。
其中,Bm地下生物量最多,与Bh、Bl差异显著(P<0.05);尿素对地下生物量影响显著(P<0.05)(表4)。
2.3草坪颜色 不同菌液处理草坪颜色在各次测定中存在显著差异(P<0.05),且Bm、Bl效果相对较好。结果表明,接种不同菌液可使草坪在一定时期内保持良好的颜色,其中生长初期以接种Bm效果好于Bl,生长后期则相反(图1)。
不同接种方法草坪颜色也在各次测定中存在显著差异(P<0.05)(图2),除了接种75 d外,其他测定时间基本表现为接种处理组草坪颜色分值高于对照,结果表明不同接种方法可使草坪保持良好颜色,但3种接种方法效果无明显差异。
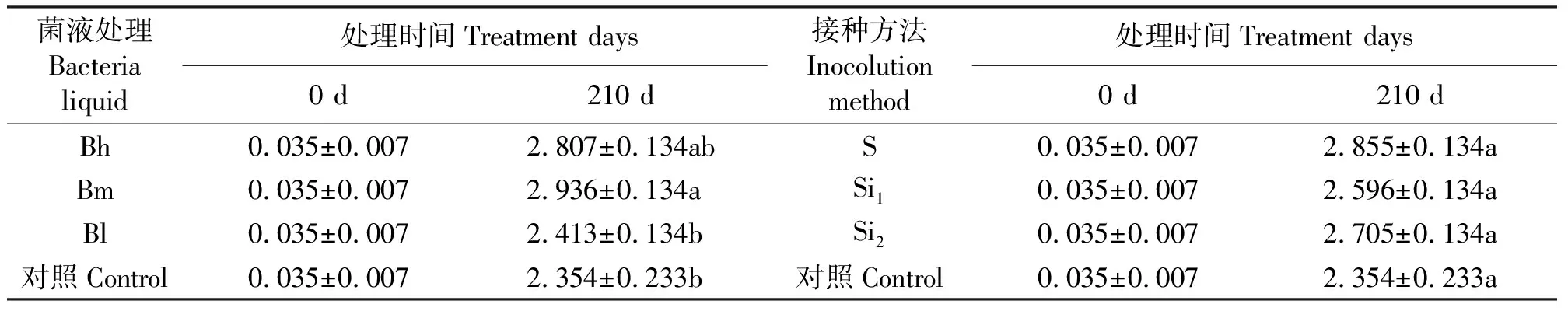
表3 菌液类型和接种方法对天堂419杂交狗牙根地上部全氮量的影响Table 3 Effects of bacterial liquid and inoculation methods on aboveground Total N of hybrid bermudagrass g·kg-1
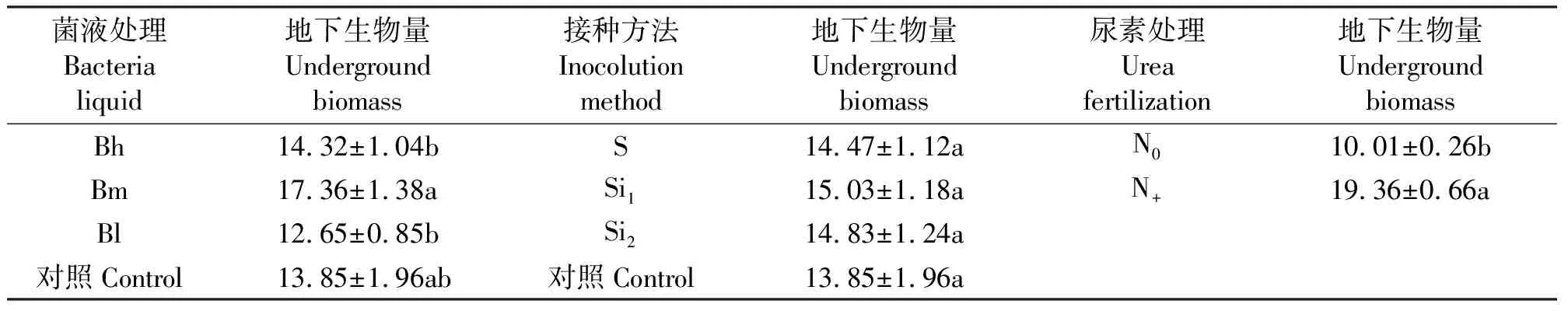
表4 菌液类型、接种方法和尿素对处理210 d后天堂419杂交狗牙根的地下生物量的影响Table 4 Effects of bacterial liquid, inoculation methods and urea treatment on underground biomass of hybrid bermudagrass after inoculation 210 d ×10-2 g·cm-2
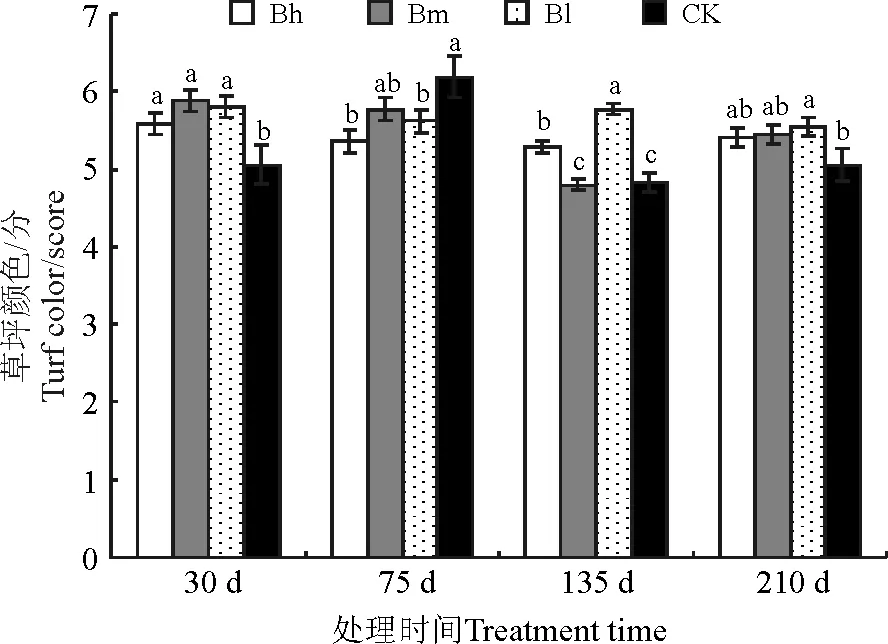
图1 菌液处理对天堂419杂交狗牙根草坪颜色的影响Fig.1 Effects of bacterial liquid on turf color of hybrid bermudagrass
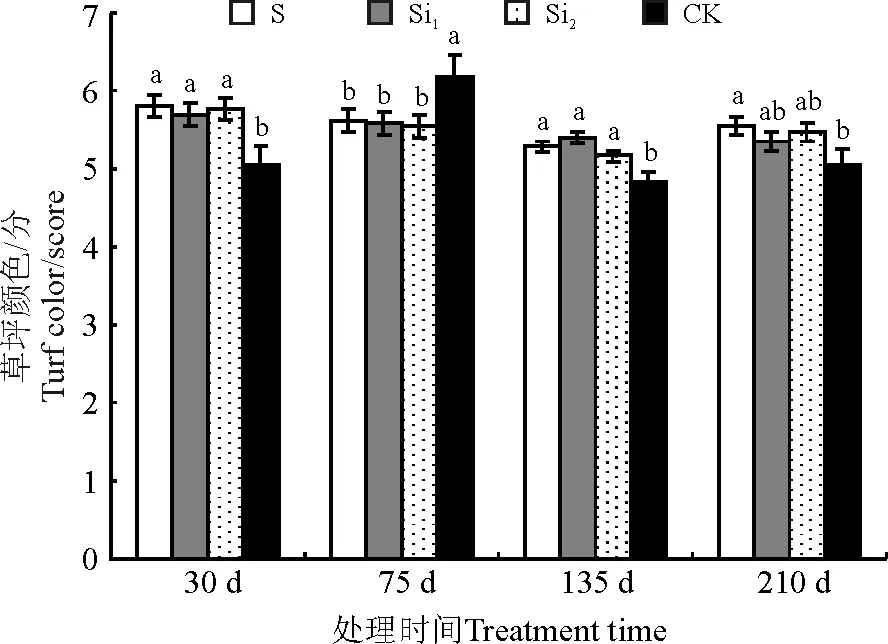
图2 不同接种方法对天堂419杂交狗牙根草坪颜色的影响Fig.2 Effects of inoculation methods on turf color of hybrid bermudagrass
处理30、135 d时,尿素对草坪颜色影响差异不显著,而处理75、210 d时尿素对草坪颜色有显著影响(P<0.05)(图3)。
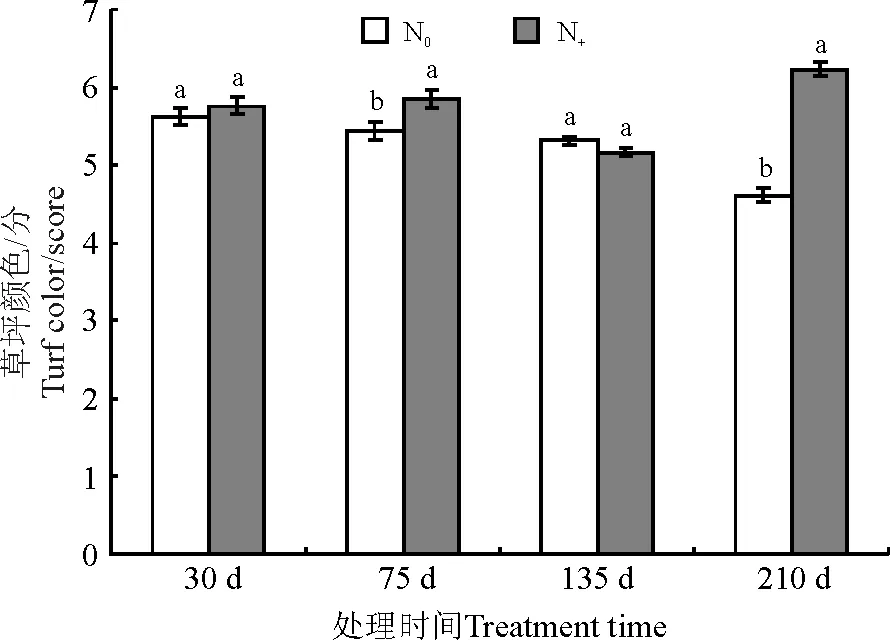
图3 不同尿素处理对天堂419杂交狗牙根草坪颜色的影响Fig.3 Effects of urea treatment on turf color of hybrid bermudagrass
2.4地上部内生固氮菌固氮酶活性和菌群密度 天堂419杂交狗牙根接种后,定期测定地上部内生固氮菌固氮酶活性和菌群密度。生长前、后期,菌液Bm对酶活影响显著大于Bh、Bl和CK(P<0.05)(表5);且Bm或Bh接种的天堂419杂交狗牙根地上部内生固氮菌菌群密度明显大于其它菌液(表6)。生长前期,接种方法S对酶活影响较Si2、Si1和CK的大(表7)。
3 讨论
大田试验表明,高氮肥料可能威胁着内生联合固氮的自然发生[24-26]。高氮肥条件下种植的植物,固氮菌不能保证植物的氮供应[27-29],因为高浓度结合态氮抑制了固氮酶合成和(或)活性[30]。然而,如果解除结合态氮抑制行为后,固氮基因操控还是有可能在田间高氮肥下促进生物固氮(BNF)作用的[31-32]。因此,本研究设计了施尿素处理和不施尿素对照。结果表明,尿素处理对接种天堂419杂交狗牙根地上部内生固氮菌固氮酶活性及菌群密度的影响不显著,但是尿素处理受接种菌液类型以及接种方法的影响,它们之间的交互作用很有可能利于酶活提高和菌群密度的增加。
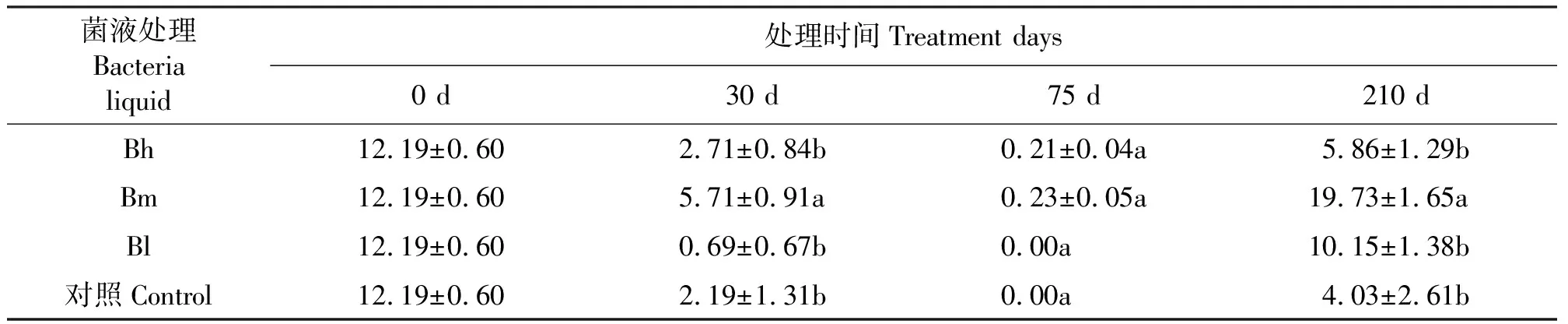
表5 不同菌液类型对地上部内生固氮菌固氮酶活性的影响Table 5 Effects of bacterial liquid on nitrogenase activity of aboveground endophytic diazotrophs μmol·h-1·mL-1

表6 菌液处理对地上部内生固氮菌固氮菌菌群密度的影响Table 6 Effects of bacterial liquid on flora density of aboveground endophytic diazotrophs lg(cfu·g-1)
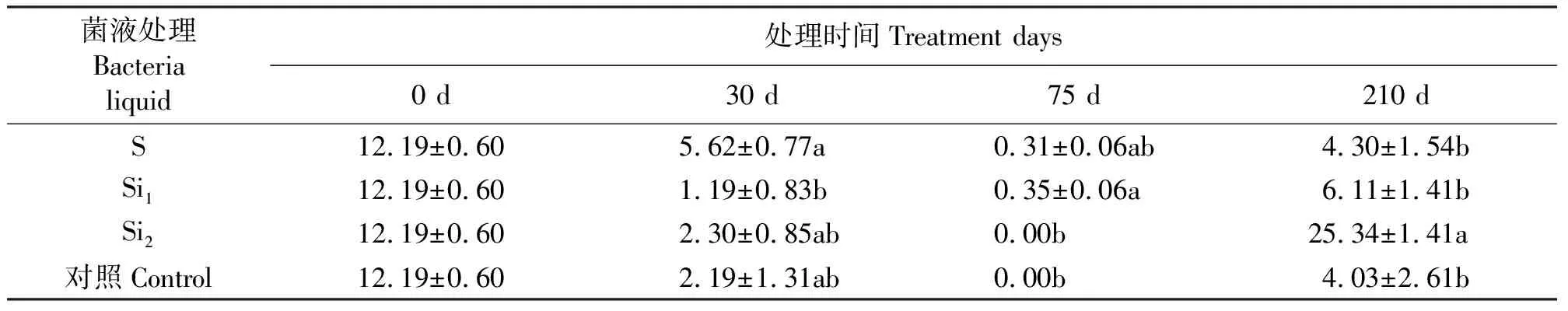
表7 不同接种方法对地上部内生固氮菌固氮酶活性的影响Table 7 Effects of inoculation methods on nitrogenase activity of aboveground endophytic diazotrophs μmol·h-1·mL-1
本研究中固氮酶活性中等的菌液(Bm)对天堂419杂交狗牙根地上部内生固氮菌固氮酶活性的影响明显大于其它菌液和对照,说明菌液Bm接种至天堂419杂交狗牙根后表现出较高的固氮能力。有研究显示,接种了越南伯克氏菌(Burkholderiavietnamiensis)、重氮营养葡糖酸醋杆菌(Gluconacetobacterdiazotrophicus)、织片草螺菌Z67(HerbaspirillumseropedicaeZ67)的组培甘蔗内定殖了大量接种细菌,达到每克根鲜质量115 000 cfu[33-35]。本研究中,与接种前相比,各菌液处理地上部内生固氮菌菌群密度于接种30 d后明显增加,但75、210 d后菌群密度部分呈减少趋势。说明在整个接种内生固氮菌过程中,其菌群密度并非持续增加,可能受土壤环境、气候等多种因素影响,不同时期呈现不同的表现[36]。
从天堂419杂交狗牙根地上部内生固氮菌固氮酶活性来说,在生长前、中期,菌液浸泡的接种方法(S)对酶活性的影响显著大于其它接种方法和对照;然而到生长后期,菌液浸泡+浇灌菌液12次的接种方法(Si2)对酶活的影响显著大于其它接种方法和对照。从地上部内生固氮菌固氮酶活性测定结果可判断,菌液浸泡是一种相对较好的接种方法,既省事,成本也没有其它接种方法高。
天堂419杂交狗牙根接种后,接种不同菌液可使草坪在一定时期内保持良好的颜色,其中生长初期接种Bm效果好于Bl,但是生长后期则相反,可能与生长后期植株体内定殖的固氮菌固氮效率降低有关[30];不同接种方法可使草坪颜色在各次测定中存在显著差异(P<0.05),其它测定时间基本是接种处理组草坪颜色分值高于对照,除了处理75 d外。说明不同接种方法可使草坪保持良好颜色,但处理75 d时与正处于高温天气有关,可能影响了草坪微生物正常活动[37-39]。处理75、210 d尿素对草坪颜色有显著影响,可能是由于接种菌液在天堂419杂交狗牙根体内发挥固氮作用,促进叶绿素合成[40]。
本试验只是一项初步研究,试图探索将从野生狗牙根中分离到的内生固氮菌接种至栽培品种天堂419杂交狗牙根上的可行性。值得指出的是,氮肥是影响内生固氮菌生存生长及接种效果的一个重要因素,本研究选择了目前运动场草坪常规施用量,在试验设计上仅考虑到氮是否影响内生固氮菌的接种效果,却没有进一步设置氮肥水平梯度去探究氮肥与菌液浓度的最佳组合;其次,菌液浓度、接种方法及氮素之间可能存在交互作用,接种方法、尿素处理究竟如何影响菌液发挥其固氮能力;此外,本研究中接种方法对菌群密度的影响差异不显著,可能是浸泡时间不足,24 h究竟能不能为固氮菌侵染草茎提供充足时间。以上问题还有待进一步研究。
[1] 覃丽萍,黄思良,李杨瑞.植物内生固氮菌的研究进展[J].中国农学通报,2005,21(2):150-159.
[2] 许褆森.内生固氮菌研究进展[J].安徽农业科学,2008,36(12):4828-4830.
[3] 罗明,卢云.植物内生固氮菌研究进展[J].微生物学杂志,2005,25(1):82-88.
[4] 卢江平,李安源.生物固氮菌在烤烟上的应用[J].烟草科技,1996(5):36-37.
[5] Loiret F G,Ortega E,Kleiner D,etal.A putative new endophytic nitrogen-fixing bacteriumPantoeasp. from sugarcane[J].Journal of Applied Microbiology,2004,97(3):504-511.
[6] Roesch L F W,Camargo F A O,Bento F M,etal.Biodiversity of diazotrophic bacteria within the soil, root and stem of field-grown maize[J].Plant and Soil,2008,302(1-2):91-104.
[7] 赵记军,徐培智,解开治,等.内生固氮菌在水稻上的应用效果研究初报[J].广东农业科学,2008(1):35-38.
[8] Montanez A,Abreu C,Gill P R,etal.Biological Nnitrogen fixation in maize (ZeamaysL.) by15N isotope-dilution and identification of associated culturable diazotrophs[J].Biology and Fertility of Soils,2009,45(3):253-263.
[9] 吴彦奇,胥晓刚,杨烈.种间杂交狗牙根足球场草坪的建植与管理技术研究[J].四川草原,1999(3):40-43.
[10] 田宏,张徳罡,姚拓,等.禾本科草坪草固氮菌株筛选及部分特性初步研究[J].中国草地,2005,27(5):47-52.
[11] 路国兵,张瑶,冀宪领,等.植物内生细菌的侵染定制规律研究进展[J].生物技术通报,2007(3):89-92.
[12] 卢镇岳,杨新芳,冯永君.植物内生细菌的分离、分类、定殖与应用[J].生命科学,2006,18(1):91-94.
[13] 李倍金.禾草内生固氮菌的分离及固氮促生效能研究[D].乌鲁木齐:新疆农业大学,2008:1-11.
[14] 李倍金,罗明,周俊,等.几种禾草内生固氮菌的分离及固氮活性测定[J].草业学报,2008,17(5):37-42.
[15] 冯宏,郭彦彪,林日强,等.类芦和狗牙根内生固氮菌初步研究[J].热带亚热带植物学报,2009,17(5):465-470.
[16] 丰骁,段建平,蒲小鹏,等.土壤脲酶活性两种测定方法的比较[J].草原与草坪,2008(2):70-72.
[17] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000:56-57.
[18] 陈建忠.一种测定烟叶全氮含量的简便方法——扩散法[J].烟草科技,1998(6):32-33.
[19] 南京农学院.土壤农化分析[M].北京:农业出版社,1980:191-193.
[20] Zakria M,Ohsako A,Saeki Y,etal.Colonization and growth promotion characteristics ofEnterobactersp.andHerbaspirillumsp.on Brassica oleracea[J].Soil Science and Plant Nutrition,2008,54(4):507-516.
[21] 孙吉雄.草坪学[M].第二版.北京:中国农业出版社,2003:355-370.
[22] 夏娟娟.植物促生内生细菌的筛选及其强化油菜富集土壤铅镉重金属的研究[D].南京:南京农业大学,2006:17-34.
[23] 张晓波.草地早熟禾根际促生菌(PGPR)特性及根际微生物区系研究[D].北京:北京林业大学,2008:10-14.
[24] 李建平,贾海生,邹华,等.暖季型狗牙根草坪建植与管理[J].青海草业,2002,11(2):36-37.
[25] 刘晓静.草坪质量评价新方法——综合外观质量法[J].甘肃农业大学学报,2004,39(6):651-655.
[26] Jha P, Kumar A.Characterization of novel plant growth promoting endophytic bacteriumAchromobacterxylosoxidansfrom wheat plant[J].Microbial Ecology,2009,58(1):179-188.
[27] 新楠,樊明寿,王海凤.羊草和冰草根际高效固氮菌的分离及鉴定[J].天津农学院学报,2008,15(2):40-42.
[28] Fuentes-Ramirez L E,Caballero-Mellado J,Sepulveda J,etal.Colonization of sugarcane byAcetobacterdiazotrophicusis inhibited by high N-fertilization[J].FEMS Microbiology Ecology,1999,29(2):117-128.
[29] Tan Z Y,Peng G X,Xu P Z,etal.Diversity and high nitrogenase activity of endophytic diazotrophs isolated fromOryzarufipogonGriff[J].Chinese Science Bulletin,2009,54(16):2839-2848.
[30] 李凤霞,姚拓,张德罡.植物生长促生菌浸种对高寒地区燕麦生长及固氮的效应[J].草业科学,2006,23(1):22-25.
[31] Martinez L,Caballero-Mellaod J,Orozco J,etal.Diazotrophic bacteria associated with banana (Musaspp.)[J].Plant and Soil,2003,257(1):35-47.
[32] Cocking E C.Endophytic colonization of plant roots by nitrogen-fixing bacteria[J].Plant and Soil,2003,252(1):169-175.
[33] 于新宁.非豆科植物固氮系统研究进展[J].现代农业科技,2007(17):126-127.
[34] 安千里,李久蒂.植物内生固氮菌[J].植物生理学通讯,1999,35(4):265-272.
[35] Govindarajan M,Balandreau J,Muthukumarasamy R,etal.Improved yield of micropropagated sugarcane following inoculation by endophyticBurkholderiavietnamiensis[J].Plant and Soil,2006,280(1-2):239-252.
[36] 刘小龙,芦云,罗明.3种旱生禾草内生固氮菌的分离及促生性能测定[J].草地学报,2012,20(4):759-767.
[37] Vinagre F,Vargas C,Schwarcz K,etal.SHR5:A novel plant receptor kinase involved in plant-N2-fixing endophytic bacteria association[J].Journal of Experimental Botany,2006,57(3):559-569.
[38] Triplett E W.Diazotrophic endophytes:Progress and prospects for nitrogen fixation in monocots[J].Plant and Soil,1996,186(1):29-38.
[39] 陈利云,张海林,周志宇.生物与非生物因素对共生固氮的影响[J].草业科学,2010,27(6):64-70.
[40] 宫世勇,孙淑荣,周俊初.导入detABD和nifA基因对苜蓿中华根瘤菌共生固氮效率的影响[J].湖北农业科学,2006,45(5):538-541.

