高效免疫调节剂对S180肉瘤小鼠IL-6及IL-10表达的调节作用
常欣峰,宋春花,罗宝英,罗亚楠,李 欢,黄志华,韩立民*
(1.湖南中医药大学,长沙 410007;2.赣南医学院,江西 赣州 341000)
肿瘤的发生、发展和转移与机体的免疫状态密切相关。研究[1-2]表明,肿瘤患者都会出现不同程度的免疫功能下降现象,如NKC活性、CD4+/CD8+比值、IL-2含量等均呈下降趋势,这是肿瘤得以无限增长的一个重要因素。而肿瘤的生长又通过分泌免疫抑制因子进一步抑制宿主免疫功能,从而形成恶性循环[3]。近年来,肿瘤的生物治疗得到长足的发展,在改善患者生存质量,降低复发率方面的重要作用已得到越来越多的认可和重视。肿瘤的生物治疗成为继手术、放疗、化疗之后的第四大治疗方法。目前国内外有关肿瘤生物治疗包括:免疫调节剂治疗、肿瘤细胞瘤苗治疗、过继性T细胞治疗-CIK、树突细胞疫苗治疗和造血干细胞移植治疗等五大方法。笔者通过对已上市疫苗进行的筛选研究,确定了多价疫苗应用的处方(HIS),并申请了中国发明专利(申请号:200810107096.6)。在前期工作中,已完成对HIS急性和3个月长期毒性实验的观察。本次实验以S180肉瘤小鼠为模型,通过计算脾指数、抑瘤率及检测IL-6、IL-10,初步探讨HIS对免疫系统的影响及抑瘤机理。
1 材料
1.1 动物及瘤株 SPF级昆明小鼠40只,雄性,6~8周龄,体质量18~22 g,由湖南省斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2009-0004,合格证号,4300016645。S180瘤株,由中国医学科学院医药研究所购进,赣南医学院科研中心传代培养。
1.2 药品及试剂 高效免疫调节剂(HIS),由江中肿瘤治疗研究组提供,批号:110325;环磷酰胺,白色粉状针剂,0.2 g/支,江苏恒瑞医药股份有限公司生产,批号:12041125;IL-6放免检测试剂盒购自北京普尔伟业生物科技有限公司,批号:20120820;IL-10多克隆抗体购自博士德生物工程有限公司(货号:BA1201);BCA蛋白定量试剂盒购自天根生化科技有限公司(货号:A:Lot#J9122;B:Lot#J8830)。
1.3 仪器 SN-695型智能放免γ测量仪(上海核福光电仪器有限公司),赛多利斯BS224S型电子天平(北京赛多利斯仪器有限公司),MK3型酶标仪(美国Thermo公司)。垂直电泳仪(美国Bio-Rad公司),化学发光成像系统(美国Bio-Rad公司)。
2 方法
2.1 S180肉瘤小鼠模型的建立 于超净工作台,无菌条件下抽取接种S180瘤株7 d的小鼠腹水,呈淡奶白色,生理盐水稀释后,1 000 r/min,离心5 min,弃上清液,用生理盐水将细胞重悬,苔盼蓝染色,肿瘤活细胞比率>95%,调整细胞浓度为1×107个/mL,置于冰水中保存。75%乙醇消毒,0.2 mL/只接种于小鼠右腋部皮下,正常对照组接种同体积的生理盐水。
2.2 分组及给药 接种后次日,将40只小鼠随机分为4组,即正常对照组、S180肉瘤模型组、S180肉瘤模型加环磷酰胺组(CTX组)、S180肉瘤模型加高效免疫调节剂组(HIS组),每组10只。CTX组于小鼠腹腔注射CTX,50 mg/kg;HIS治疗组给予腹股沟皮下注射浓度为0.03 g/mL的HIS 0.1 mL/10 g体质量,终剂量为0.3 g/kg;正常对照组及S180肉瘤模型组腹腔注射等容积生理盐水。以上各组均3 d给药1次。连续10 d(即给予4次药物治疗)。
2.3 瘤重、抑瘤率及脾指数测定 于末次给药24 h后,称体质量,取血,取脾脏、肿瘤,电子天平称脾脏及肿瘤质量。
2.4 放射免疫学方法检测血清IL-6水平 摘眼球取血置于促凝管中,4 ℃、3 000 r/min,离心10 min,制备血清,-80 ℃保存。送往北京普尔伟业生物科技有限公司代检。
2.5 Western blot法检测肿瘤组织细胞因子IL-10表达 于-80 ℃冰箱中称取肿瘤组织20~30 mg,以预冷的PBS清洗并用眼科剪将组织剪碎于1.5 mL EP管中,再加入适量的蛋白裂解液研磨,4 ℃颠倒混匀1 h,12 000 r/min,离心5 min,抽取上清液,即为组织总蛋白,用BCA蛋白检测法进行蛋白定量。取50 μg蛋白,调整体积为24 μL,样品煮沸5 min,6 000 r/min,离心5 min,经SDS-PAGE凝胶电泳,湿转法将蛋白转移至NC膜,5%脱脂牛奶封闭1 h,1∶200稀释的IL-10一抗,4 ℃孵育过夜;TBST洗3次,每次5 min;1∶1 000稀释的二抗,室温孵育l h,TBST洗3次,每次10 min;用ECL发光剂室温孵育l min,化学发光成像系统照相,体积法测定各条带的光密度值。同样方法测定β-actin的光密度值,各条带IL-10与相应β-actin的光密度值比值为该条带的相对光密度值。各组取3只小鼠的样本,重复试验3次,每次以模型组条带相对光密度值为1进行数据标准化,所得9次数据进行统计学分析。
3 结果
3.1 HIS对S180肉瘤小鼠瘤重、抑瘤率及脾指数的影响 见表1。
表1 HIS对S180肉瘤小鼠瘤重、抑瘤率及脾指数的影响(±s,n=10)
3.2 HIS对S180肉瘤小鼠血清IL-6水平的影响 见图1。
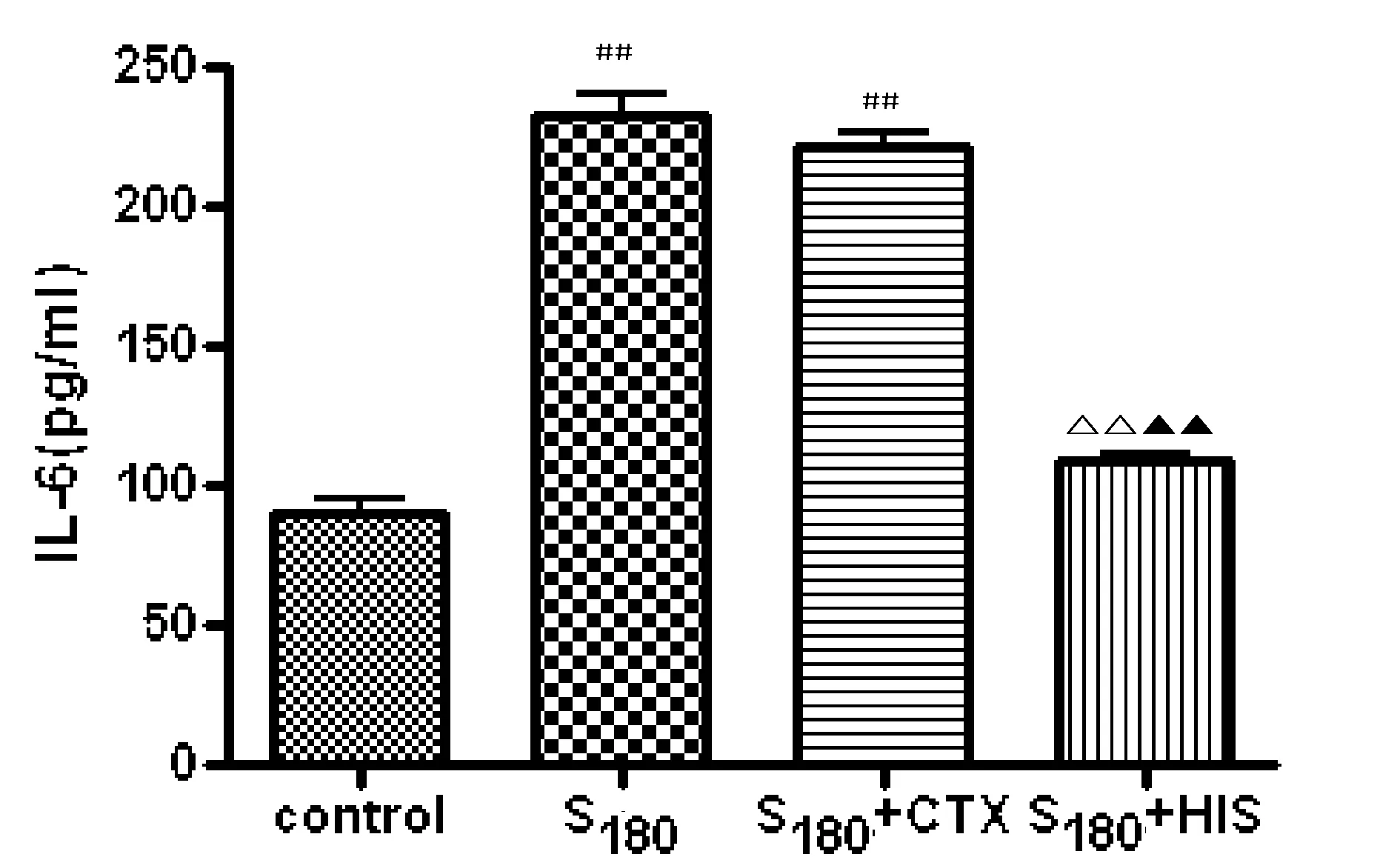
注:与正常对照组比较,##P<0.01;与肿瘤模型组比较,△△P<0.01;与CTX组比较,▲▲P<0.01。
3.3 HIS对S180肉瘤小鼠肿瘤组织细胞因子IL-10表达的影响 见图2。
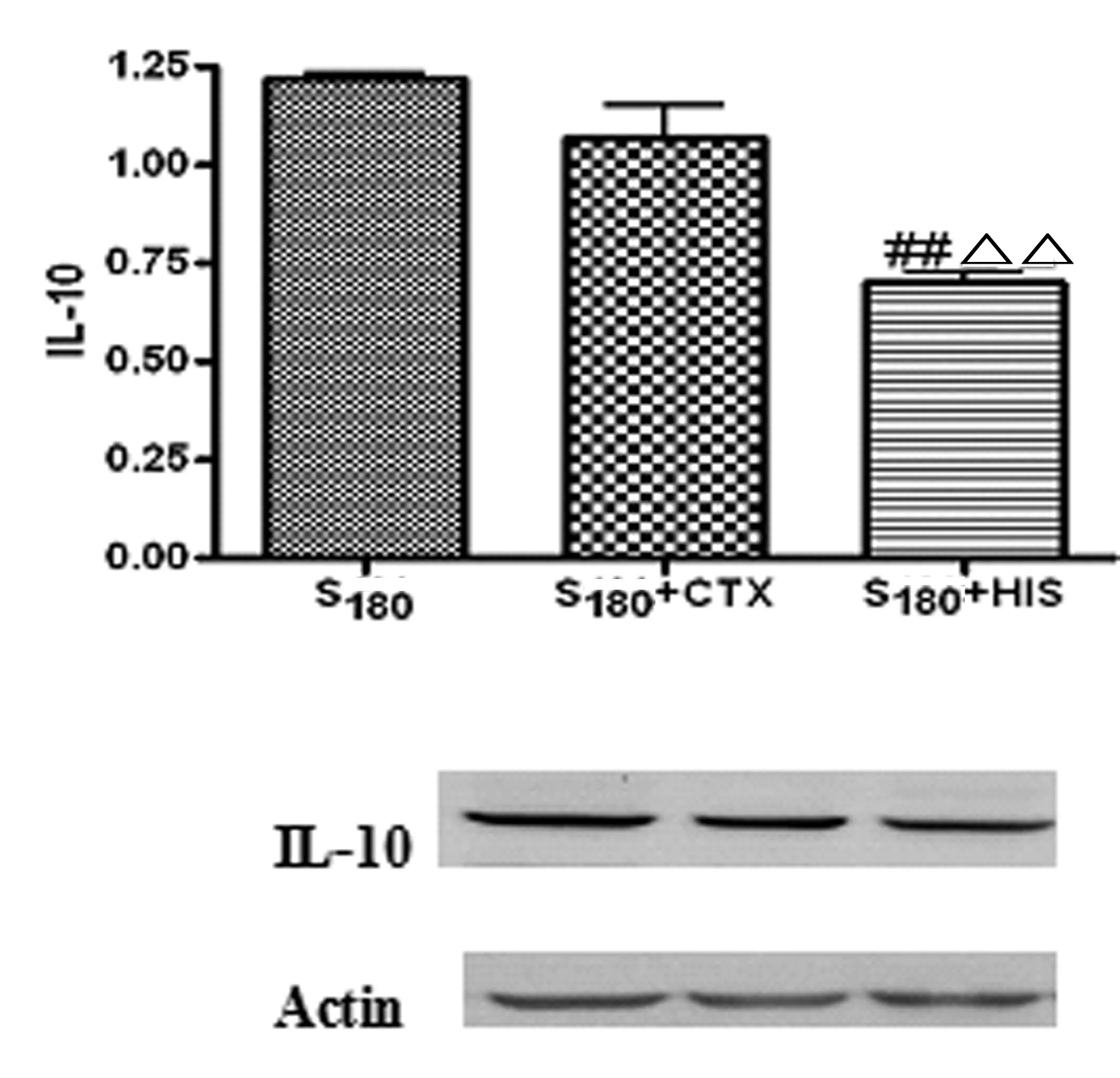
注:与肿瘤模型组比较,##P<0.01;与CTX组比较,△△P<0.01。
4 讨论
本实验结果表明,HIS可明显抑制S180肉瘤的生长,同时小鼠的脾指数升高,提示HIS可通过提高机体的免疫功能起到抗肿瘤作用。
免疫机制的失能是肿瘤形成的重要因素。其中Th1/Th2细胞的平衡向Th2细胞漂移是肿瘤免疫机制失能的主要表现之一。Thl类细胞分泌IL-2、INF-γ和TNF-β等细胞因子,是机体抗癌、抗病毒的主要参与者;Th2类细胞分泌IL-4、IL-6和IL-l0等细胞因子,在体内可抑制免疫应答[4]。而肿瘤宿主处于Th2细胞因子优势状态是肿瘤免疫逃逸的机理之一。IL-6是一种多效应的细胞因子,也是重要的免疫抑制因子[5],主要由淋巴细胞、激活的巨噬细胞和血管内皮细胞产生。IL-6与多种肿瘤发生、发展关系密切,它通过干预细胞的黏附性、血栓形成、肿瘤特异性抗原的表达及肿瘤细胞的增值从而影响肿瘤的进展[6]。IL-10作为重要的免疫抗炎因子,也被称为人类细胞因子合成抑制因子。它能抑制T细胞的增殖分化,抑制单核细胞和自然杀伤细胞的生物活性,抑制Th1细胞产生IL-2、INF-γ等,从而下调机体的抗肿瘤反应[7-9]。实验结果表明,HIS可明显降低小鼠外周血IL-6水平,降低肿瘤组织中IL-10表达。提示HIS可抑制肿瘤形成过程中Th1/Th2细胞的平衡向Th2细胞漂移,减轻肿瘤机体的免疫机制的失能,从而有效抑制肿瘤的生长。
综上所述,HIS可提高机体免疫功能并有抑瘤效果。作用机理可能与HIS降低了免疫抑制因子IL-6、IL-10表达水平,抑制Th1/Th2细胞平衡向Th2细胞漂移有关。从而为进一步在临床推广和使用HIS提供了理论依据。
[1]杨威,曹春霞,刘青光,等.自体肿瘤瘤苗对荷瘤鼠Th1、Th2型细胞因子及细胞毒作用的影响[J].肿瘤,2005,25(3):205-207.
[2]林卡莉,徐鹰,黄志华,等.香菇多糖对荷瘤鼠白细胞介素-2和白细胞介素-6表达及肿瘤细胞周期影响的研究[J].时珍国医国药,2010,21(6):1436-1437.
[3]侯立男,何向辉,章志翔.细胞因子基因治疗肿瘤的现状和展望[J].临床和实验医学杂志,2008,7(1):145-147.
[4]任蕊,赵金茹,连媛媛,等.膈下逐瘀汤联合环磷酰胺对Hca-f肝癌小鼠抗肿瘤作用的实验研究[J].吉林中医药,2010,30(3):257-259.
[5]寇小格,Liu M Y.细胞因子与肿瘤临床表现及转归的关系[J].国际肿瘤学杂志,2010,37(3):188-190.
[6]王治伟,迟琼,万利.乳腺癌患者血清IL-6、IL-8、IL-10和TNF-α的水平变化及临床意义[J].广州医药,2012,43(3):45-47.
[7]黄爱民,陈方,林卡莉.香菇多糖对荷瘤鼠血清IL-10、TNF-和肿瘤DC表达的影响[J].时珍国医国药,2012,23(3):665-666.
[8]王欣,赵化荣,顾霞,等.血浆白细胞介素6和10水平与不同类型淋巴瘤的关系及其临床意义[J].南方医科大学学报,2011,31(8):1360-1364.
[9]Boyano MD,Garcia-Vázquez MD,López-Michelena T,et al.Soluble interleukin-2 receptor,intercellular adhesion molecule-1 and interleukin-10 serum levels in patients with melanoma[J].Br J Cancer,2000,83(7):847-852.

