不同驯化年限野生线叶野豌豆种子特性及幼苗耐寒性
张凡凡,于 磊,鲁为华,万娟娟
(石河子大学动物科技学院,新疆 石河子 832000)
线叶野豌豆(Viciatenuifolia)为多年生旱中生半攀援性根蘖型豆科植物,自然分布于新疆天山、阿尔泰山的中低山带。该豆科牧草在自然状态下株丛高、地上生物量大,并且品质优良、茎枝细嫩、叶片柔软、营养丰富、粗蛋白含量高、适口性佳,是各类家畜均喜食的一种优质野生豆科牧草,有非常好的开发利用前景[1-2]。把线叶野豌豆引入绿洲区进行驯化的工作已开展数年,前人分别就其生物学特征[3]、栽培条件下的经济性状[4]、施肥对其产草量的促进作用,以及种子生产[5]等进行了研究,初步认识和掌握了线叶野豌豆在绿洲区驯化过程中所表现的性状特点,为驯化栽培种的培育创造了必要条件。本研究在上述工作的基础上,对野生线叶野豌豆在绿洲区驯化过程中各驯化年限采收的种子及幼苗的理化性质加以分析,以揭示该豆科牧草在新环境下的适应性和变异性的特征,为驯化栽培种的培育提供科学依据和理论指导。
1 材料与方法
1.1试验材料 试验主要以各线叶野豌豆种子及其幼苗为研究对象。
种子分别为:采自裕民县巴尔鲁克山的野生线叶野豌豆原种(A)、驯化第1代生长第2年收获的种子(B)、驯化第1代生长第3年(C)和生长第4年收获的种子(D)。各采收种子均干燥到5%水分保藏在超低温冰箱里(-80 ℃)。种子在使用前进行40 ℃的解冻[6],以打破种子的休眠。
幼苗分别为各种子盆栽试验种植30 d后取得,A种出的幼苗称为野生线叶野豌豆原种的子代幼苗(A1)、B种出的幼苗称为驯化第1代第2年收获种的子代幼苗(B1)、C和D种出的幼苗分别称为驯化第1代第3年收获种的子代幼苗(C1)和驯化第1代第4年收获种的子代幼苗(D1)。盆栽试验方法:试验前采用化学方法打破种子的硬实,即将各种子分别用浓硫酸进行15 min的浸种[7],浸种处理后将各种子洗至中性,催芽后分别点播在塑料花盆中,挑选大小相似、发芽好的种子每盆种25粒,每类种子种15盆,共60盆;后统一放置于人工气候箱中管理,昼/夜温度25 ℃/15 ℃,光照时数12 h·d-1,平均每3~5 d浇一次水,期间浇水量、浇水方式及管理方式相同。盆栽试验所用土壤采自石河子大学牧草试验站,土壤为重壤;花盆为普通塑料花盆(上口径20 cm,下口径15 cm,高15 cm)。
1.2测定与分析方法
1.2.1线叶野豌豆种子特性变化测定 主要测定的项目为种子千粒重、种子硬实率、种子发芽率和发芽势。
种子千粒重:取各试样8个重复,每个重复100粒,分别称取8个重复的质量,并计算千粒重[7]。种子硬实率:将供试种子不做任何处理放置于种子培养箱内恒温[(25±0.5)℃]发芽,各试样取100粒,重复3次,待发芽结束后,仍未吸胀的种子作为硬实种子,统计其数量[7]。种子发芽率和发芽势:取各供试种子100粒分别用浓硫酸进行15 min的浸种,处理后将种子洗至中性,均匀的放置在垫有滤纸的培养皿中,并放入发芽床中进行发芽[(25±0.5)℃],重复3次,发芽期间保证充足的水分,按种子检验规程方法计算发芽率和发芽势[8],但由于不同牧草种子末次计算发芽的天数相差很大,所以结合种子检验规程和此牧草发芽的规律,发芽试验初期设定为3 d,并以每个处理发芽末期连续5 d发芽数不超过1%作为发芽结束。按照下列公式计算发芽率和发芽势。
发芽率=[发芽试验末期全部正常发芽种子数/供检种子数]×100%;
发芽势=[发芽试验初期(3 d)正常发芽种子数/供检种子数]×100%。
1.2.2线叶野豌豆幼苗耐寒性变化测定 将A1、B1、C1、D1定苗后(保留植株大小、高度相似的材料)分别放置在20、15、10、5和0 ℃的人工气候箱中,处理时间统一为2 h。处理后将各幼苗地上部分剪下进行生化指标的测定,重复3次。参考有关植物耐寒性研究的文献[9-20],并通过预试验对供试幼苗的可溶性蛋白质、叶绿素、游离脯氨酸、可溶性糖及丙二醛的含量进行测定,通过预试验发现可溶性蛋白质(SP)、丙二醛(MDA)及可溶性糖(WSS)3个指标对线叶野豌豆耐寒性影响相对较大,故选取SP、MDA和WSS 3个生化指标作为线叶野豌豆耐寒性的主控因子。其中SP含量测定采用考马斯亮蓝G-250法[20],MDA含量测定采用硫代巴比妥酸法[19],WSS含量测定采用蒽酮比色法[20]。
1.2.3线叶野豌豆幼苗生长状况测定 主要测定的项目为株高及生长速度。株高:盆栽试验期内从不同驯化种的每盆线叶野豌豆中随机选择10株,用普通卷尺测量株高(精确到毫米),算出10株株高的平均值。生长速度:相邻两次测定株高之差除以间隔生长时间。
1.2.4数据处理 试验数据采用Excel 2010进行数据记录与作图,DPS 7.05数据处理软件进行单因素方差分析。
2 结果与分析
2.1各驯化年限线叶野豌豆种子特性变化分析 试验结果表明,线叶野豌豆种子随驯化年代的延长,千粒重逐渐下降,千粒重排序依次为A>B>C>D。经过驯化的线叶野豌豆随驯化年限延长,硬实率逐渐降低,硬实率排序为A>B>C>D。随驯化年限延长发芽率和发芽势逐渐增高,排序为D>C>B>A,这表明驯化后的线叶野豌豆种子的硬实率、出苗的速度和整齐度均较野生种有显著的提高(P<0.05)(表1)。
2.2各驯化年限线叶野豌豆幼苗生长变化分析 试验结果表明,各供试线叶野豌豆幼苗在播种后0~15 d内生长变化明显(P<0.05),到20 d左右各供试幼苗生长均趋于平缓。随着驯化年限的延长,A1、B1、C1幼苗日生长速度有所升高,而D1幼苗日生长速度显著高于其他幼苗(P<0.05),日生长速度排序为D1>C1>B1>A1(表2)。
2.3各驯化年限线叶野豌豆幼苗耐寒性变化分析
2.3.1低温胁迫下各驯化年限线叶野豌豆幼苗中可溶性蛋白(SP)含量变化规律 在10~20 ℃内幼苗A1、B1、C1、D1中SP的含量随温度的降低而降低,10 ℃ SP含量均下降到最低(P<0.05),而10 ℃以下随温度的降低幼苗中SP含量较10 ℃又有所提高(P<0.05),这表明各供试幼苗均在10 ℃左右开始受到低温胁迫的影响,在0~10 ℃较敏感。总体来看,各供试幼苗SP含量在低温胁迫期内均呈“U”型曲线变化(图1)。各驯化种与原种对比SP的总积累含量均显著降低(P<0.05),在低温胁迫期内幼苗中SP总积累含量排序依次为A1>B1>C1>D1(表3)。

表1 各驯化年限线叶野豌豆种子特性变化特征Table 1 The seed trait of Vicia tenuifolia in different growth year
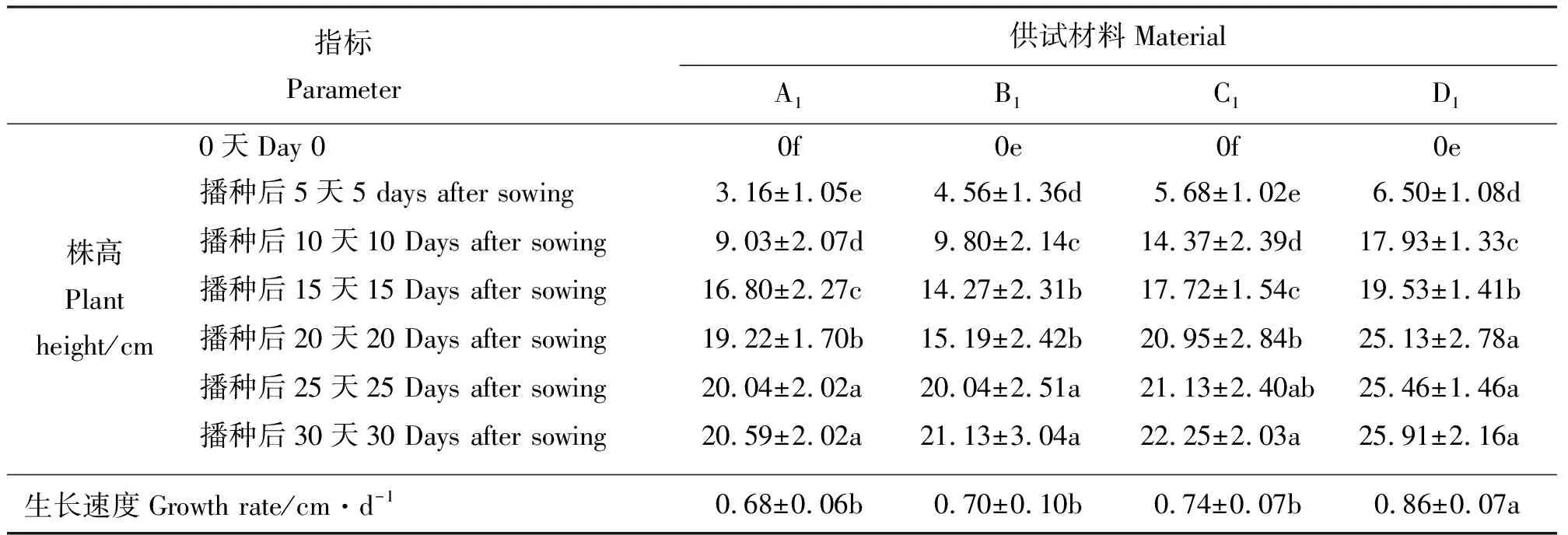
表2 各驯化年限线叶野豌豆幼苗株高变化及日生长速度情况Table 2 Seedling height and daily growth rate of different Vicia tenuifolia accessions
2.3.2低温胁迫下各驯化年限线叶野豌豆幼苗中丙二醛(MDA)含量变化规律 幼苗A1,B1,C1,D1中MDA含量总体呈现“S”曲线变化,在整个胁迫温度内MDA含量变化明显,在10和15 ℃时出现两个折点,10~20 ℃内MDA含量先上升后下降,10 ℃以下,随温度的降低MDA的含量较其它温度下显著升高(P<0.05)。总体变化趋势表现为随温度降低MDA含量增高(图2),且不同驯化年限幼苗中MDA总积累含量存在差异(图2),各供试幼苗MDA总积累含量排序依次为D1>C1>B1>A1(图2、表3)。
2.3.3低温胁迫下各驯化年限线叶野豌豆幼苗中可溶性糖(WSS)含量变化规律 幼苗A1,B1,C1,D1中WSS的含量变化规律同SP含量变化相似,10 ℃左右WSS含量下降到最低(P<0.05),在0~5 ℃、10 ℃左右及15~20 ℃这3个温度段WSS含量变化显著(P<0.05)(图3)。从试验结果看,各试验材料中WSS含量对温度感受极敏感,在低温胁迫条件下,线叶野豌豆幼苗中WSS总积累含量随着驯化年限的延长呈下降趋势(P>0.05)(表3)。

图1 低温下各驯化年限线叶野豌豆幼苗可溶性蛋白的变化Fig.1 Seedling SP of different Vicia tenuifolia accessions under low temperatures
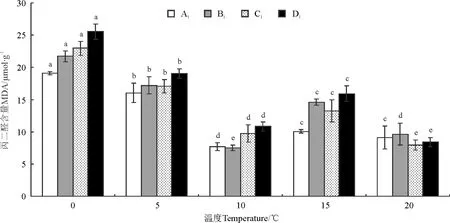
图2 低温下各驯化年限线叶野豌豆幼苗丙二醛的变化Fig.2 Seedling MDA of different Vicia tenuifolia accessions under low temperature
2.4各驯化年限线叶野豌豆幼苗耐寒性变化综合分析 变异系数大小可以反映各指标在胁迫温度期间离散的程度,进而可以反映该牧草在胁迫温度下各指标含量的变化程度[21-22]。综合考虑各指标含量及变异系数两方面,对各幼苗的耐寒性进行排序,可溶性蛋白、可溶性糖含量高且变化平缓,MDA含量低、变化平缓,耐寒性强(表3、表4),耐寒性强弱排序结果为A1>B1>C1>D1。
3 讨论
3.1驯化对线叶野豌豆种子特性特征及幼苗生长情况的影响 植物的驯化是一个繁琐而又漫长的过程,经过多年的驯化,植物的“野性”才会逐渐消失,但在长期的自然选择过程中,植物在劣境下已有一套完整的保留机制,主要表现在种子休眠的存在,以延续种质[23-24]。而休眠的种子均存在较高的硬实率,发芽率低影响生产利用[25],尤其是豆科牧草,由于其硬实率一般较高,限制了种子的萌发和出苗,造成种子萌发慢或不萌发,这就直接导致了出苗不齐或不出苗;另外,千粒重、发芽率和发芽势几个指标也可以很好地反映种子的饱满程度以及发芽的速度和整齐度。本试验中经过绿洲区驯化后的野生线叶野豌豆种子的发芽率、发芽势提高,而硬实率下降,这一结论与许多研究者的结果相同[23,26-27],而驯化后的种子千粒重下降,这与偃麦草(Elytrigiarepen)的驯化规律有所不同[26]。植物幼苗的高度及生长快慢可以反映出植物生长形态的特征,也可以反映出植物后期的生长状况,本试验中经过绿洲区驯化后的线叶野豌豆幼苗表现出随年限的延长其生长速度加快的规律,这与贺海洋等[27]的研究是相同的。这些变化规律一方面取决于种子特性,另外可能还与绿洲区的高温干燥气候有密切关系。

图3 低温下各驯化年限线叶野豌豆幼苗可溶性糖的变化Fig.3 Seedling WSS of different Vicia tenuifolia accessions under low temperatures
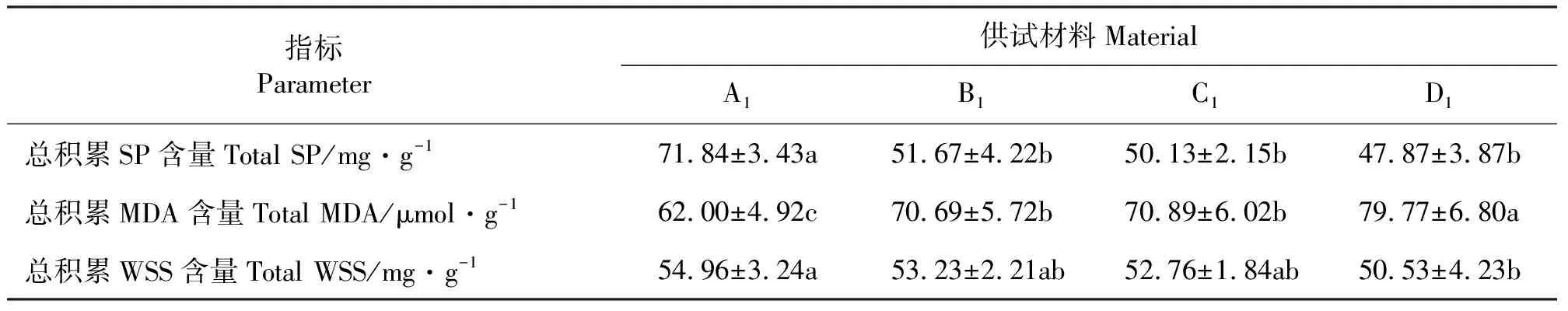
表3 各驯化年限线叶野豌豆幼苗抗寒生理指标低温胁迫温度内总积累量变化Table 3 Seeding total accumulation of different Vicia tenuifolia accessions in three Physiological indices

表4 各驯化年限线叶野豌豆耐寒性指标胁迫期内变异系数Table 4 The variation coefficient of Vicia tenuifolia cold resistance index in different growth year %
3.2驯化对线叶野豌豆幼苗耐寒性的影响 选择3个生理指标SP、MDA和WSS作为主控因子。其中,SP含量的变化可以很好地反映植物在受到低温冷害时的变化规律[9-12],随着温度的降低SP含量增加,以提高冰点,抵御低温冷害[12-13]。在低温冷害下SP含量的增加一方面是由于细胞膜或其他结合物质释放出的蛋白质,另一方面有可能是由于低温诱导产生了新的冷调节蛋白。MDA含量也是判断植物耐寒性指标的一个重要标准,它是植物遭受逆境胁迫时生物膜系统膜脂过氧化的最终产物,其浓度的高低代表膜脂过氧化强度及膜系统的伤害程度,直接关系到植物抗寒能力的强弱[13-16]。关于低温驯化对膜脂过氧化作用的影响,以往的研究中大部分结论认为MDA含量与耐寒性呈负相关[15],而本试验各供试幼苗在15 ℃出现了一个峰值,随着温度的持续降低又有所下降,10 ℃左右下降到最低,10 ℃以下又继续升高,原因可能为在15 ℃左右膜脂过氧化严重出现峰值,当胁迫温度降低到10 ℃左右,各供试幼苗暂时适应了低温环境,但随着胁迫加重,各幼苗在短时间内不能适应新的低温环境,所以MDA含量又有所升高。另外,10 ℃下,随温度降低,WSS含量提高,可能是因为低温降低了细胞内水势,增加保水能力,从而降低冰点,保持细胞不至遇冷凝固;同时,更易于植物细胞氧化供能,从而提高植物的抗寒能力[17-19]。
综合低温胁迫期内3个生理指标的总积累量可以作为判断植物耐寒性的指标,但是这只是综合评价的一个方面,另一方面,植物的耐寒性也与低温胁迫期内各指标变化的程度有关。因此将各指标在低温下的变化趋势加以分析,可综合评判出植物的耐寒性,本试验中,耐寒性表现出随驯化年限延长下降的规律,其原因可能是野生线叶野豌豆所处生境气候湿润冷凉,在长期的自然选择过程中,野生线叶野豌豆的抗寒力一直处于“激发”状态,而本研究选择的驯化条件是在绿洲区环境下,其生态条件与原生境截然不同,所以抗寒力有所减弱,在今后的研究中可尝试原生地驯化或分阶段逐级驯化和过度驯化(即选择与原生地气候相似的地带作为引种中转站)[28]。另外,本试验仅将自然选择下培育出4个子代的种子和幼苗进行耐寒性对比分析得出结果,其种性及抗寒性的突变是否是由环境效应所引起的,其表现的优良性状是否能够遗传,还有待进一步的深入研究。
4 结论
在绿洲区栽培驯化条件下,野生线叶野豌豆为适应新的环境,改变了其生存策略,其种子性状、幼苗的生长特征及耐寒性均发生了变异,随着在绿洲区驯化年限的延长种子的千粒重和硬实率下降,发芽率和发芽势提高;幼苗的生长速度加快,耐寒性下降。
目前,对于牧草引种驯化的成功与否,没有统一的衡量标准,仅满足了人们的某种特定目的就被认定为引种驯化成功,由此来看,可以选择驯化种进行栽培和选育,并加以人工选择的方式以得到更为优良的牧草种质资源。
[1] 崔乃然.新疆主要饲用植物志[M].乌鲁木齐:新疆科技卫生出版社,1994.
[2] 张仁平,于磊.线叶野豌豆的研究利用[J].畜牧兽医科技,2007(5):95-96.
[3] 陈明辉,涂志平,于磊,等.线叶野豌豆生长规律及克隆植株扩展性能研究[J].草食家畜,2010(4):58-61.
[4] 林祥群,于磊,马彩梅,等.田间驯化野生线叶野豌豆的经济性状分析[J].石河子大学学报(自然科学版),2010(3):274-277.
[5] 郭江松,于磊,鲁为华,等.施肥对驯化条件下线叶野豌豆饲草和种子生产的影响[J].草原与草坪,2010(1):61-63,67.
[6] 李荣辉.草坪与牧草种质的超低温保存研究[D].杨凌:西北农林科技大学,2007.
[7] 杜永吉,张仁平,于磊.野生线叶野豌豆种子特性实验室测定研究[J].石河子大学学报(自然科学版),2005(4):100-102.
[8] 国家技术监督局.GB/T3543.1.农作物种子检验规程总则[S].北京:中国标准出版社,1995.
[9] Guy C L.Cold acclimation and freezing stress tolerance:Role of protein metabolism[J].Annual Review of Plant Physiology and Plant Molecular Biology,1990,41:187-223.
[10] Huang T,Duman J G.Cloning and characterization of athermal hysteresis (antifreeze) protein with DNA-binding activity from winter bittersweet nightshade,Solanumdulcamara[J].Plant Molecular Biology,2002,48(4):339-350.
[11] Hajela R K,Horvath D P,Gilmour S J,etal.Molecular cloning and expression of cor (cold-regulated)genes inArabidopdidthalina[J].Plant Physiology,1990,93:1246-1252.
[12] 王丹,宣继萍,郭海林,等.结缕草的抗寒性与体内碳水化合物、脯氨酸、可溶性蛋白季节动态变化的关系[J].草业学报,2011,20(4):98-107.
[13] 赵玉宏.两种草坪草抗寒性的探究[J].湖北民族学院学报(自然科学版),2005(4):381-383.
[14] 陈秀晨,熊冬金.植物抗逆性研究进展[J].湖北农业科学,2010(9):2253-2256.
[15] 王以柔,曾韶西,刘鸿先.冷锻炼对水稻和黄瓜幼苗SOD、GR活性及GSH、ASA含量的影响[J].植物学报,1995,37(10):776-780.
[16] 李晶,阎秀峰,祖元刚.低温胁迫下红松幼苗活性氧的产生及保护酶的变化[J].植物学报,2000(2):148-152.
[17] 袁淑珍,栗淑媛,乔辰.低温胁迫对螺旋藻体内可溶性糖含量的影响[J].中国农学通报,2008(5):113-116.
[18] 林艳,郭伟珍,徐振华,等.大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J].中国农学通报,2012,28(25):68-72.
[19] 严青,马玉寿,施建军,等.低温胁迫对3种牧草幼苗抗性生理指标的影响[J].青海大学学报(自然科学版),2007(1):54-57.
[20] 邹奇.植物生理学实验指导[M].北京:中国农业出版社,2000.
[21] 罗良清,魏和清.统计学[M].北京:中国财政经济出版社,2011:49.
[22] 张慧荣.不同生活型草原植物环境适应特征研究[D].呼和浩特:内蒙古大学,2008.
[23] 孙海莲.脉野豌豆种子资源的开发利用[J].内蒙古畜牧科学,2000,21(4):34-35.
[24] 韩建国.实用种子学[M].北京:中国农业大学出版社,1997:145-146.
[25] 宋敏.吉林省野豌豆属植物遗传多样性研究[D].长春:吉林农业大学,2011.
[26] 武保国,杜利民,薛凤华.偃麦草引种驯化[J].种子,1991(1):12-16.
[27] 贺海洋,董玉芝,昝少平,等.新疆野生鸢尾的引种驯化及应用研究[J].园林科技信息,2005(4):2-8.
[28] 张长芹,冯保钧,赵革英,等.常绿杜鹃花引种方法初探[J].园艺学报,1992(3):256-260.

