抗转移性乳腺癌新药伊沙匹隆的研究进展
陆二梅, 马菱蔓, 周科成,3, 胡 伟, 孙莉莉
抗转移性乳腺癌新药伊沙匹隆的研究进展
陆二梅1,2, 马菱蔓2, 周科成2,3, 胡 伟4, 孙莉莉1*
(第四军医大学:1西京医院神经内科,4学员旅, 西安 710032; 中国药科大学 :2天然药物活性组分与药效国家重点实验室,3中药复方研究室, 南京 211198)
转移性乳腺癌(MBC)患者普遍使用蒽环类和紫杉烷类药物治疗,但部分患者对紫杉烷类药物过敏,还有一些患者在治疗后对紫杉烷类产生耐药性,病症会在短期内迅速复发。对于这些患者,很难找到其他有效治疗方案。伊沙匹隆作为新一代微管抑制剂类抗肿瘤药物在对蒽环类和紫杉烷类药物耐药的MBC患者的治疗中作用显著,现对伊沙匹隆的药理学和临床方面的研究进行综述。
伊沙匹隆; 转移性乳腺癌; 微管抑制剂; 埃博霉素
乳腺癌是女性最常见的恶性肿瘤之一,2008年全世界新发病例约1 400 000例,另有近458 000例乳腺癌患者死亡[1]。在美国,30%~50%的早期乳腺癌患者会发展成转移性乳腺癌(metastatic breast cancer,MBC),而MBC患者的中位生存时间只有2~4年[2]。MBC患者可单独或联合使用蒽环类、紫杉烷类、烷化剂类和抗代谢物类药物等进行化疗。但这些化疗药物的长期使用常会导致多药耐药性的出现,使病情反复,难以长期控制。尤其对于普遍使用的蒽环类和紫杉烷类耐药的乳腺癌患者,病情复发后,相同的治疗方案基本无效[3]。此前,世界范围内只有卡培他滨被批准用于治疗上述两类药物耐药的MBC患者[4]。然而,新出现的卡培他滨耐药性再次向我们提出了挑战[5]。
伊沙匹隆(ixabepilone)属于第2代的半合成埃博霉素B衍生物,是继紫杉烷类药物后百时美施贵宝(Bristol-Myers Squibb)公司开发的新型微管抑制剂类抗肿瘤药物,于2007年10月16日获得FDA批准在美国上市。化学名(1s,3s,7s,10r,11s,12s,16r)-7,11-二羟基-8,8,10,12,16-五甲基-3-[(1e)-1-甲基-2-(2-甲基-4-噻唑)乙烯基]-17-氧杂-4-氮杂[14.1.0]十七烷-5,9-二酮。分子式:C27-H42-N2-O5-S。相对分子质量:506.70388。结构式见图1。
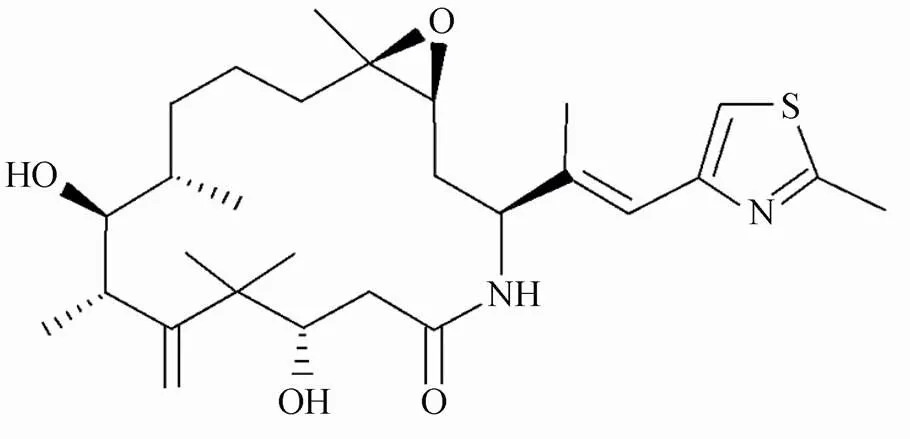
图1 伊沙匹隆的化学结构
Figure 1 Chemical structure of ixabepilone
1 临床前药理学研究
1.1 作用机制
伊沙匹隆又称氮杂埃博霉素B,是埃博霉素B中的O原子(连接C1与C15)被N原子取代所得,是一类非紫杉醇类的新型微管抑制剂类抗肿瘤药物,与紫杉烷类似,具有稳定细胞微管的活性。与紫杉醇相比,伊沙匹隆抗肿瘤活性更强,水溶性更好,耐药性更低,结构简单,易于化学合成与衍生化。其稳定性比天然埃博霉素B大大增加,并且不易被肝酯酶降解。
微管是组成细胞骨架的重要成分,各种真核细胞及部分原核细胞中都有存在,与其他相关蛋白作用,组成中心粒、神经管、鞭毛、纺锤体等结构。它参与了很多的细胞生理活动过程,如细胞信号传导,细胞形态的维持和细胞分裂等。微管内在的动力学特征决定了其功能的多样性,这对于在有丝分裂各期维持染色体的正常运动十分重要[6−10]。微管是由α,β-微管蛋白异二聚物组成的聚合物,需要解聚以形成有丝分裂纺锤体。伊沙匹隆是目前唯一经FDA批准用于治疗转移性乳腺癌的埃博霉素类药物,它通过作用于β-微管蛋白亚单位,促进了微管聚合,使细胞受阻于细胞周期的G2/M期,从而导致DNA复制的终止,并最终促使细胞程序性死亡。伊沙匹隆促进微管聚合的能力为紫杉醇的两倍,它在极低浓度下就具有杀灭肿瘤细胞的作用[8]。尽管伊沙匹隆和紫杉烷类的作用机制非常相似,但在结构和功能上却是完全新型种类的微管抑制剂,并具有特异性的β-微管蛋白结合位点[4],可竞争性地抑制紫杉烷类的促微管聚合作用[5]。由于受过表达的多药耐药蛋白P-糖蛋白和用于调节细胞毒素药物外向通量的多药耐药关联蛋白Ⅰ的影响比较小,伊沙匹隆对多药耐药机制不敏感[6],因此对先天性或获得性紫杉醇耐药的肿瘤细胞株仍具有抗肿瘤活性。
1.2 毒理学研究
目前研究表明,伊沙匹隆不会诱导遗传突变。0.2mg/(kg·d)的伊沙匹隆对雌、雄小鼠的交配及繁殖都没有影响,但其对人类生育能力的影响未见报道。
动物毒理学表明,小鼠接受伊沙匹隆单一剂量静脉给药60~180mg/m2,5~14d后部分小鼠死亡。毒性反应主要见于周围神经系统、淋巴系统、雄性生殖系统、胃肠反应、骨髓造血功能降低。犬接受伊沙匹隆单一剂量静脉给药100mg/m2后出现严重胃肠毒性并在3d后死亡。
2 临床研究
2.1 Ⅰ期临床试验
在多个Ⅰ期临床试验中伊沙匹隆都作为单一用药,用于治疗400例不同类型的肿瘤患者[11−17]。Mani等[12]针对25例晚期实体瘤患者进行Ⅰ期临床试验,12例剂量设定为40mg/m2,所有患者出现1~2级中性粒细胞下降,其中2例为剂量限制性中性粒细胞下降,1例出现3级腹痛、乏力、腹泻和神经病变,发生率为7.7%;另有9例给予50mg/m2,4例出现剂量限制性毒性反应,如中性粒细胞下降、腹痛、恶心。
一项Ⅰ/Ⅱ期临床试验评估了伊沙匹隆联合卡培他滨给药对使用了蒽环类和紫杉烷类药物后复发的MBC患者的影响,给出了Ⅱ期和Ⅲ期临床试验的推荐剂量为伊沙匹隆静脉注射40mg/m2、每3周1次,卡培他滨口服2000mg/(m2·d)、每3周前2周[13,18]。
基于以上结果,设定Ⅱ期临床试验剂量为40mg/m2,每3周3h输液。上述试验的毒性主要反应包括中性粒细胞下降、胃肠道不适、疲劳乏力和神经病变[17]。
2.2 Ⅱ期临床试验
2.2.1 伊沙匹隆单药治疗 近几年,一些Ⅱ期临床试验已经评估了伊沙匹隆作为单一用药治疗MBC的疗效(表1)。
Perez等[5]对伊沙匹隆单独给药用于治疗蒽环类、紫杉烷类、卡培他滨耐药的MBC患者的有效性和安全性进行了评价。Thomas等[20]评价了伊沙匹隆治疗49例紫杉烷耐药的MBC患者的疗效。Lee等[8]对23例紫杉烷耐药的MBC患者使用伊沙匹隆的情况进行了Ⅱ期临床研究。Shimizu等[17]观察了伊沙匹隆治疗MBC患者的疗效与安全性。
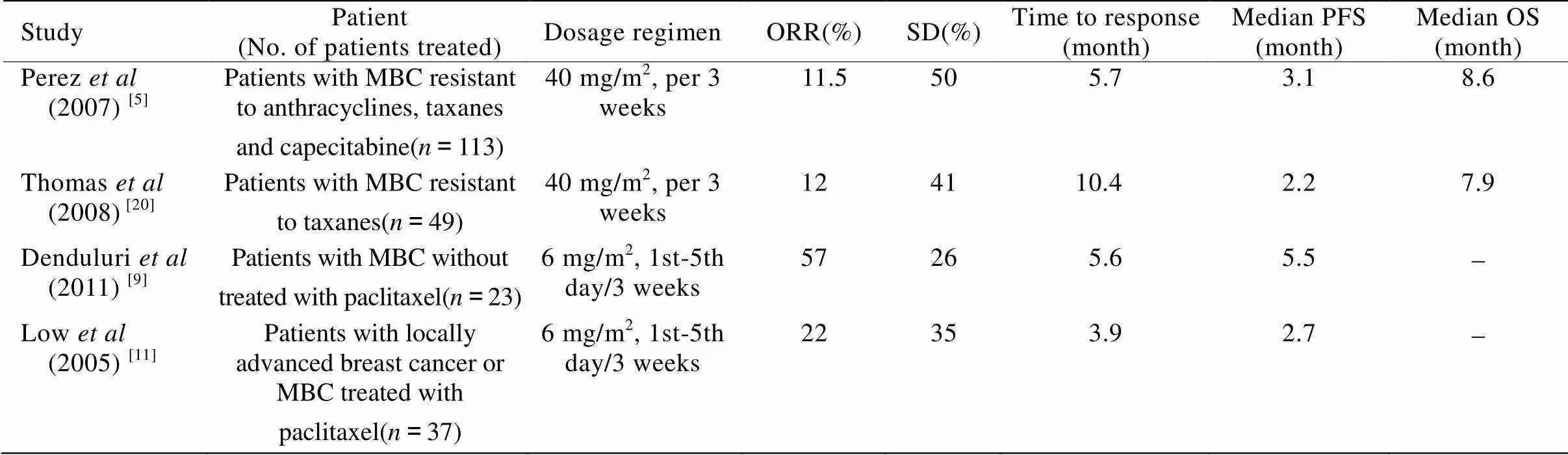
表1 伊沙匹隆单一用药试验的数据统计
MBC: metastatic breast cancer; ORR: objective response rate; SD: stable disease; PFS: progression-free survival; OS: overall survival
上述试验结果证明,伊沙匹隆可以用于治疗局部或转移性乳腺癌,并且不易产生耐药性。而且伊沙匹隆单独用于接受过蒽环类治疗或对紫杉烷类耐药的“三阴性”(雌激素受体、孕激素受体和人表皮生长因子受体2均阴性)乳腺癌患者同样有效[18]。
2.2.2 伊沙匹隆联合治疗 在联合治疗的研究中,伊沙匹隆多用于联合卡培他滨。有Ⅰ/Ⅱ期临床试验结果表明,伊沙匹隆联合卡培他滨能增强抗癌作用,提高对蒽环类和紫杉烷类耐药的MBC患者的疗效。Rugo等[19]的研究表明伊沙匹隆联合贝伐珠单抗治疗MBC的疗效优于紫杉醇联合贝伐珠单抗。比较伊沙匹隆联合贝伐珠单抗与紫杉醇联合贝伐珠单抗用于治疗(局部复发的)MBC的疗效和比较伊沙匹隆联用曲妥单抗与多西紫杉醇(多西他赛)联用曲妥珠单抗的疗效的研究都在进行中。
2.3 Ⅲ期临床试验
目前已经完成的Ⅲ期临床试验主要是046研究和048研究两项关于伊沙匹隆联合卡培他滨用药的大型研究[20,21]。046研究是一项国际性多机构参与的开放式随机临床试验,研究对象为752例对紫杉烷类和(或)蒽环类耐药的MBC患者,结果显示治疗组优于对照组。但是,3/4级毒性反应治疗组均高于对照组,而卡培他滨相关的不良反应则两组类似。此外,治疗组有5%出现发热性中性粒细胞减少症,毒性相关死亡率为3%,高于对照组(1%)。
048研究和046研究只有很小的区别,046研究对象首先要对紫杉烷类耐药,而在048研究中并没有严格限定。在046研究中病情必须是可度量的,而048研究还允许不可度量存在[21]。两项临床研究的给药方案和分组方式基本一致。
在总生存数(overall survival,OS)方面,两项研究都没有显示出重大进展。但是通过用于调整预定义基线处预后因素的Cox回归分析后,显示两项研究在OS方面有了长足进展[22]。可见,伊沙匹隆联合卡培他滨用于治疗对蒽环类和紫杉烷类耐药的MBC患者是很有前景的。伊沙匹隆与靶向治疗药物联合是否具有协同作用,以及疗效及安全性的保障是进一步研究的方向。
2.4 临床应用
2.4.1 临床应用 一项针对1221例紫杉烷类和(或)蒽环类耐药的MBC癌患者的Ⅳ期临床试验对伊沙匹隆进行了评估。其中43%的MBC患者接受过2个方案,治疗组:伊沙匹隆40mg/m2静脉滴注>3h,卡培他滨口服1000mg/m2(每天2次,每3周前2周);对照组:卡培他滨1250mg/m2(每天2次,每3周前2周)。按FDA敏感性分析的要求,分析无进展生存期(progression-free survival,PFS)数据如下。治疗组PFS中位时间为5.8个月,对照组为4.2个月[死亡风险比(hazard ratio for death,HR)=0.75,=0.0003];12周后治疗组与对照组PFS分别为71%和55%(<0.0001);客观有效率(objective response rate,ORR)分别为35%和14%(<0.0001)。亚组结果也显示治疗组优于对照组[23]。
2.4.2 主要不良反应 与同为微管抑制剂的紫杉烷类药物类似,伊沙匹隆在推荐的用法用量下常见不良反应(≥20%)主要包括中性粒细胞下降、白细胞减少、乏力、手足综合征、肌痛、恶心、呕吐、外周神经病变和腹泻等。伊沙匹隆与其他药物联合治疗时常发生的不良反应(≥20%)为手足综合征、厌食、腹痛、指甲疾病和便秘。周围神经病变为最常见的不良反应[24]。对于过敏反应,必需提前使用H1受体拮抗剂(如苯海拉明)和H2受体拮抗剂(如西咪替丁)。伊沙匹隆对胎儿有损伤,故在接受伊沙匹隆治疗时应注意避孕。若用药过量,无相应的解药,只能针对临床表现进行相应支持治疗。特别值得注意的是,一项研究表明伊沙匹隆可能会引起严重心脏不良反应[25]。
2.4.3 药物相互作用 伊沙匹隆作为CYP3A4的底物,受CYP3A4d抑制剂和诱导剂作用,会改变其在血浆中的浓度,从而增加不良反应的发生率并降低疗效。因此,伊沙匹隆应避免与CYP3A4抑制剂或诱导剂合用,若合用应适当调整伊沙匹隆的剂量,并密切注意临床观察和实验室检查,以监控急性不良反应。此外,贯叶连翘也可能降低伊沙匹隆的血药浓度,应该避免两者同时使用。
3 结 论
由于MBC患者的OS仍然较低,新的治疗手段的研发十分必要。伊沙匹隆作为新一代微管抑制剂类抗肿瘤药物,其对蒽环类、紫杉烷类和卡培他滨耐药的MBC患者的疗效已得到肯定,并在很大程度上解决了MBC患者抗癌治疗失败的难题。如今有关伊沙匹隆对其他癌症治疗作用的研究正在进行[26,27],有望为其他癌症的治疗提供新的手段。
[1] Ferlay J, Shin HR, Bray F,. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893−2917.
[2] Chung CT, Carlson RW. Goals and objectives in the management of metastatic breast cancer[J]. Oncologist, 2003, 8(6): 514−520.
[3] Conte P, Guarneri V, Bengala C. Evolving nonendocrine therapeutic options for metastatic breast cancer: how adjuvant chemotherapy influences treatment[J]. Clin Breast Cancer, 2007, 7(11): 841−849.
[4] Gelmon K, Chan A, Harbeck N. The role of capecitabine in first-line treatment for patients with metastatic breast cancer[J]. Oncologist, 2006, 11 (Suppl 1): 42−51.
[5] Perez EA, Lerzo G, Pivot X,. Efficacy and safety of ixabepilone (BMS-247550) in a phaseⅡ study of patients with advanced breast cancer resistant to an anthracycline, a taxane, and capecitabine[J]. J Clin Oncol, 2007, 25(23): 3407−3414.
[6] Margolis RL, Wilson L. Opposite end assembly and disassembly of microtubules at steady state[J]. Cell, 1978, 13(1): 1−8.
[7] Howard J, Hyman AA. Dynamics and mechanics of the microtubule plus end[J]. Nature, 2003, 422 (6933): 753−758.
[8] Lee FY, Borzilleri R, Fairchild CR,. BMS-247550: a novel epothilone analog with a mode of action similar to paclitaxel but possessing superior antitumor efficacy[J] Clin Cancer Res, 2001, 7(5): 1429−1437.
[9] Denduluri N, Swain S. Ixabepilone: clinical role in metastatic breast cancer[J]. Clin Breast Cancer, 2011, 11(3): 139−145.
[10] Rowinsky EK, Calvo E. Novel agents that target tublin and related elements[J]. Semin Oncol, 2006, 33(4): 421−435.
[11] Low JA, Wedam SB, Lee JJ,. PhaseⅡ clinical trial of ixabepilone (BMS-247550), an epothilone B analog, in metastatic and locally advanced breast cancer[J]. J Clin Oncol, 2005, 23(12): 2726−34.
[12] Mani S, McDaid H, Hamilton A, et al. PhaseⅠ clinical and pharmacokinetic study of BMS-247550, a novel derivative of epothilone B, in solid tumors[J]. Clin Cancer Res, 2004, 10(4): 1289−1298.
[13] Aghajanian C, Burris HA 3rd, Jones S,. PhaseⅠ study of the novel epothilone analog ixabepilone (BMS-247550) in patients with advanced solid tumors and lymphomas[J]. J Clin Oncol, 2007, 25(9): 1082−1088.
[14] Gadgeel SM, Wozniak A, Boinpally RR,. Phase Ⅰ clinical trial of BMS-247550, a derivative of epothilone B, using accelerated titration 2B design[J]. Clin Cancer Res, 2005, 11(17): 6233−6239.
[15] Abraham J, Agrawal M, Bakke S,. Phase Ⅰ trial and pharmacokinetic study of BMS-247550, an epothilone B analog, administered intravenously on a daily schedule for five days[J]. J Clin Oncol, 2003, 21(9): 1866−1873.
[16] Zhuang SH, Agrawal M, Edgerly M,. A phase Ⅰ clinical trial of ixabepilone (BMS-247550), an epothilone B analog, administered intravenously on a daily schedule for 3 days[J]. Cancer, 2005, 103(9): 1932−1938.
[17] Shimizu T, Yamamoto N, Yamada Y,. Phase Ⅰ clinical and pharmacokinetic study of 3-weekly, 3-h infusion of ixabepilone (BMS-247550), an epothilone B analog, in Japanese patients with refractory solid tumors[J]. Cancer Chemother Pharmacol, 2008, 61(5): 751−758.
[18] Bunnell C, Vahdat L, Schwartzberg L,. PhaseⅠ/Ⅱ study of ixabepilone plus capecitabine in anthracycline- pretreated/resistant and taxane-resistant metastatic breast cancer[J]. Clin Breast Cancer, 2008, 8(3): 234−241.
[19] Rugo HS, Campone M, Amadori D,. A randomized, phaseⅡ, three-arm study of two schedules of ixabepilone or paclitaxel plus bevacizumab as first-line therapy for metastatic breast cancer[J]. Breast Cancer Res Treat, 2013, 139(2): 411−419.
[20] Thomas ES. Ixabepilone plus capecitabine for metastatic breast cancer progressing after anthracycline and taxane treatment[J]. J Clin Oncol, 2008, 26(13): 2223.
[21] Roche H, Conte P, Perez EA,. Ixabepilone plus capecitabine in metastatic breast cancer patients with reduced performance status previously treated with anthracyclines and taxanes: a pooled analysis by performance status of efficacy and safety data from 2 phaseⅢ studies[J]. Breast Cancer Res Treat, 2011, 125(3): 755−765.
[22] Jassem J, Fein L, Karwal M,. Ixabepilone plus capecitabine in advanced breast cancer patients with early relapse after adjuvant anthracyclines and taxanes: a pooled subset analysis of two phase Ⅲ studies[J]. Breast, 2012, 21(1): 89−94.
[23] Valero V, Vrdoljak E, Xu B,. Maintenance of clinical efficacy after dose reduction of ixabepilone plus capecitabine in patients with anthracycline- and taxane-resistant metastatic breast cancer: a retrospective analysis of pooled data from 2 phaseⅢ randomized clinical trials[J]. Clin Breast Cancer, 2012, 12(4): 240−246.
[24] Santiago MJ, Hayes BD, Butler KH. Severe cardiotoxicity associated with ixabepilone use in metastatic breast cancer[J]. Ann Pharmacother, 2013, 47(4): e17.
[25] Valero V. Managing ixabepilone adverse events with dose reduction[J]. Clin Breast Cancer, 2013, 13(1): 1−6.
[26] Dizon DS, Blessing JA, McMeekin DS,. PhaseⅡ trial of ixabepilone as second-line treatment in advanced endometrial cancer: Gynecologic Oncology Group Trial 129-P[J]. J Clin Oncol, 2009, 27(19): 3104−3108.
[27] Rivera E, Lee J, Davies A. Clinical development of ixabepilone and other epothilones in patients with advanced solid tumors[J]. Oncologist, 2008, 13(12): 1207−1223.
(编辑: 张青山)
Progress of clinical research on ixabepilone, a new anti-metastatic drug for breast cancer
LU Er-Mei1,2, MA Ling-Man2, ZHOU Ke-Cheng2,3, HU Wei4, SUN Li-Li1*
(Fourth Military Medical University:1Department of Neurology, Xijing Hospital,4Cadet Brigade, Xi’an 710032, China; China Pharmaceutical University:2State Key Laboratory of Natural Medicines,3Department of Compound Prescription of Traditional Chinese Medicine, Nanjing 211198, China)
Generally, anthracyclines and taxanes are applied to treat metastatic breast cancer (MBC) as chemotherapeutic agents. However, some patients are over-sensitive to taxanes, or experience rapid relapse due to resistance to taxanes, for whom, anthracyclines and taxanes have poor therapentic efficacy. Fortunately, ixabepilone, a novel microtubules inhibitor, exerts great effects on MBC patients who are resistant to anthracyclines and taxanes. In this article, we reviewed the pharmacology of ixabepilone and its progress in clinical research.
ixabepilone; metastatic breast cancer; microtubules inhibitor; epothilone
(2012K18-01-08).
R969.4
A
10.3724/SP.J.1264.2013.00202
2012−12−28;
2013−07−04
陕西省社发攻关课题省级基金(2012K18-01-08)
孙莉莉, E-mail: sunlili@fmmu.edu.cn

