基于石墨烯-氧化锌复合物的乙酰胆碱酯酶生物传感器用于辛硫磷的测定
景雁凤,刘志敏,赵振江,郑莹莹,展海军
(河南工业大学 化学化工学院,河南 郑州 450001)
0 引言
辛硫磷是农业生产中应用广泛的一种有机磷农药,它可以抑制乙酰胆碱酯酶的活性,导致体内神经递质乙酰胆碱的大量蓄积,从而产生恶心、头疼等中毒症状,严重的可以导致死亡[1],因此对其快速检测显得非常重要.传统的检测方法主要是色谱法,但这些方法样品处理复杂,不适于进行现场检测[2].基于电化学方法的传感器,由于仪器易于微型化,为实现现场检测分析提供了可能.
石墨烯是由单层碳原子密集排列成的二维蜂窝晶格结构的一种碳材料,具有导电性能好、比表面积大和电子转移速率快等优点,目前已用作制备电化学传感器的电极材料[3-5].但石墨烯的团聚限制了它的广泛应用.研究表明,石墨烯-氧化物复合材料具有良好的分散性和稳定性[6],这些特性使其有望用于电化学传感器的构建并用于实际测定研究.基于此,本文构建了一种基于石墨烯-ZnO(GR-ZnO)复合物的乙酰胆碱酯酶生物传感器,并用于快速灵敏的检测辛硫磷农药.
1 材料与方法
1.1 仪器与试剂
Prestige-21 傅立叶变换红外光谱仪:日本岛津公司;Hitachi-800 透射电子显微镜:日本日立公司;X-射线粉末衍射仪:XRD,D/max 2550,日本理学公司;CHI650C 电化学工作站:上海辰华仪器有限公司.采用三电极系统:玻碳电极(GCE,Φ=3 mm)及复合物修饰电极为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝电极为对电极.
氯化乙酰胆碱(ATCl)和乙酰胆碱酯酶(AChE,C3389,236 U/mg)购于Sigma 公司;辛硫磷(纯度≥99.99%)购自北京上立方联合化工技术研究院;戊二醛(25%)由上海国药集团提供;其他试剂均为分析纯.试验用水为二次蒸馏水.
1.2 GR-ZnO 复合物的制备
首先采取文献[7]中方法合成石墨氧化物(GO)和石墨烯(GR).
GR-ZnO 复合物采用改进的文献方法合成[8].在200 mL 蒸馏水中首先加入0.2 g GO,超声2 h,然后与100 mL 含有0.2 g Zn(NO3)2的溶液混合均匀,之后加入3 mL 氨水和0.2 mL 水合肼,120 ℃反应4 h.产物用蒸馏水洗至中性,60 ℃干燥12 h,即制得GR-ZnO 复合物.
1.3 乙酰胆碱酯酶生物传感器的制备
壳聚糖(CHI)首先溶解在1%的冰醋酸中制得0.5%g/mL 壳聚糖分散液.然后将适量GR-ZnO 复合物加入到上述分散液中,超声分散后得到GRZnO/CHI 分散液.
GR-ZnO/CHI 分散液与0.5%戊二醛等体积混合,之后取5 μL 溶液滴加至电极表面,晾干后再滴加5 μL 的乙酰胆碱酯酶溶液,冰箱中干燥即得乙酰胆碱酶生物传感器(AChE/ZnO-GR/CHI/GCE).
1.4 抑制率的计算方法
乙酰胆碱酯酶能够催化底物氯化乙酰胆碱水解,催化活性受有机磷农药的抑制,导致水解产物硫代胆碱浓度减小,故电流减小.农药的浓度越大,电流减小的越显著,即对酶的抑制率增加.抑制率可由下式计算[9]:
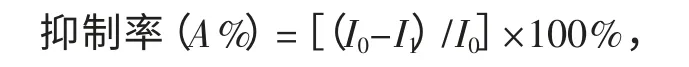
式中:I0为ATCl 在AChE/ZnO-GR/CHI/GCE 的响应电流;I1是辛硫磷抑制后ATCl 在AChE/ZnO-GR/CHI/GCE 的响应电流.
2 结果与讨论
2.1 谱学表征
2.1.1 GR 的透射电镜表征
采用透射电镜研究了合成GR 的表面形貌,如图1 所示,石墨烯呈现透明的,有小褶皱的薄片状.

图1 石墨烯的透射电镜图
2.1.2 GO、GR 和GR-ZnO 复合物的红外光谱表征
图2 中(a)为GO 的红外图谱,其中1 725 cm-1处的吸收峰为C=O 的伸缩振动吸收峰,1 389 cm-1对应于C—O—H 的变形振动峰,1 063 cm-1处归属于C—O—C 伸缩振动吸收峰.GO 被水合肼还原后的红外图谱如图2 中(b)所示,含氧官能团的吸收峰大大降低,说明GO 还原为GR 后,含氧基团基本上已被脱去.图2 中(c)为GR-ZnO 复合物的红外图谱,与图2 中(b)相比较,新增加的432 cm-1吸收峰为Zn-O 振动吸收峰[10].
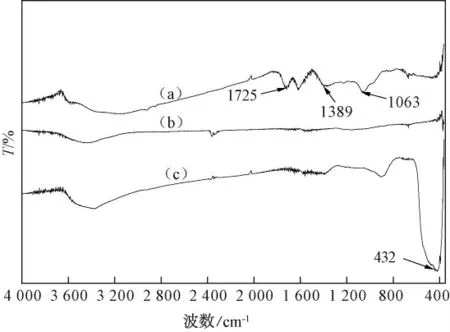
图2 GO(a)、GR(b)和GR-ZnO(c)复合物的红外图谱
2.1.3 GR 及GR-ZnO 的粉末衍射图谱
GR,ZnO and GR-ZnO 的粉末衍射图谱如图3所示.GR 在25° 和44°出现衍射峰,与文献报道一致[11].GR-ZnO 复合物的主要衍射峰与纯ZnO 的衍射峰相同(JCPDS,65-3411),说明GR 的存在并没有改变ZnO 的晶型.
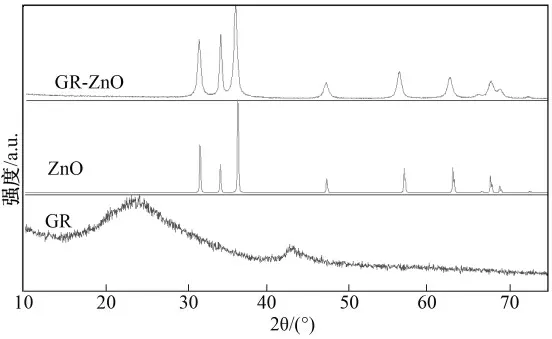
图3 GR,ZnO and GR-ZnO 的粉末衍射图谱
2.2 修饰电极的电化学表征
2.2.1 不同电极的循环伏安图
不同电极在5.0 mmol/L K3Fe(CN)6(含有0.1 mol/L KCl)溶液中的循环伏安曲线如图4 所示.与裸玻碳电极(曲线a)相比,CHI 修饰后的电极峰电流(曲线b)稍增大,主要因为壳聚糖的导电性较差,使用GR-CHI 修饰电极后,峰电流增大(曲线c),这归因于石墨烯较大的比表面积和良好的导电性.使用ZnO-GR/CHI 复合物修饰电极后,峰电流继续增大(曲线d),这主要是由于石墨烯和氧化锌的协同效应引起的.由于石墨烯非凡的电子传递性,改善了电极的导电性,加快了电极上电子的交换速度,而且高导电率的氧化锌的存在又能使石墨烯的分散性得到极大提高.
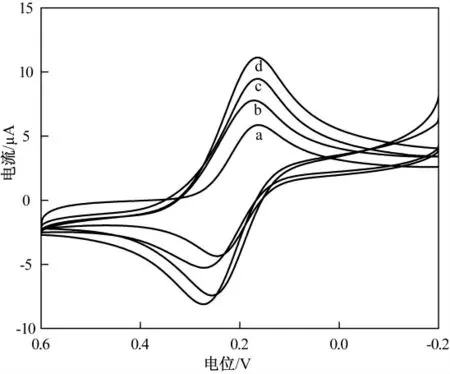
图4 不同电极在5.0 mmol/L K3Fe(CN)(6含有0.1 mol/L KCl)溶液中的循环伏安图
2.2.2 AChE/ZnO-GR/CHI/GCE 的电化学行为
图5 为不同修饰电极在含有1.0 mmol/L ATCl的PBS(pH 7.5)中的循环伏安图,可以看出,裸GCE 电极没有峰(曲线a);而修饰电极AChE-CHI/GCE 有微弱的峰出现(曲线b),这个峰是AChE 催化底物ATCl 的水解产物巯基胆碱产生的氧化峰;电极经过GR 修饰后,峰电流增加(曲线c),而经过复合材料(ZnO-GR)修饰后的电极,其峰电流显著增加,说明纳米级氧化锌和GR 具有较高的比表面积和电催化作用使基底和电极表面的电子转移速度加快.同时也说明GR 和纳米氧化锌复合物具有很好的协同作用.
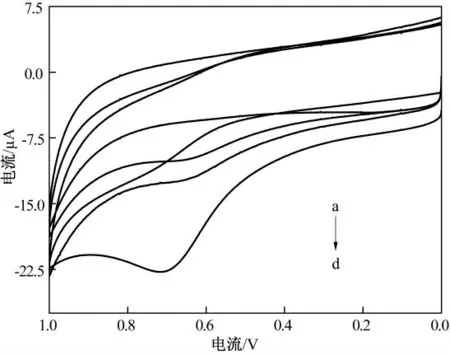
图5 不同电极在pH 7.5 PBS 中含1.0 mmol/L的ATCl 的循环伏安图
2.3 试验条件的优化
2.3.1 pH 的优化
溶液的pH 值决定固定AChE 的生物活性,图6 显示了pH 值对1.0 mmol/L ATCl 在AChE/ZnOGR/CHI/GCE 上响应电流的影响.可以看出,在pH 7.5 时峰电流值最大.考虑到检测农药的灵敏度,本试验选择pH 值为7.5.
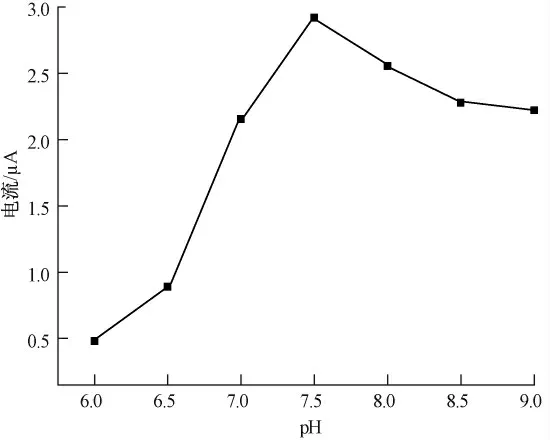
图6 缓冲溶液的pH 对峰电流的影响
2.3.3 AChE 用量的优化
酶的固定量影响生物传感器的响应信号.试验在含有1.0 mmol/L ATCl(pH 7.5 PBS)中考察了固定不同量的酶对响应信号的影响.如图7 所示,当酶固定量达到50 U 时,响应电流值达到最大,进一步增加酶用量峰电流却减小.因此,试验选择酶的固定量为50 U.
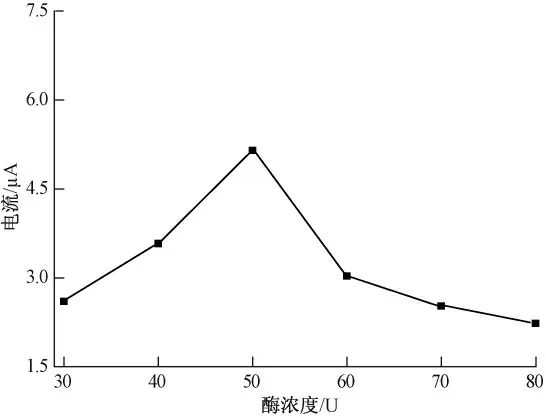
图7 酶浓度对传感器响应的影响
2.3.5 抑制时间的选择
在农药分析中抑制时间是最有影响力的参数之一,图8 显示了抑制时间对生物传感器响应的影响.很显然,随着在辛硫磷溶液中抑制时间的增加,ATCl 在传感器上的响应电流逐渐减小.当抑制时间大于11 min,响应电流值趋向一个稳定值,表明辛硫磷和AChE 之间的结合位点达到平衡.因此抑制时间为11 min,从而使抑制率最大.
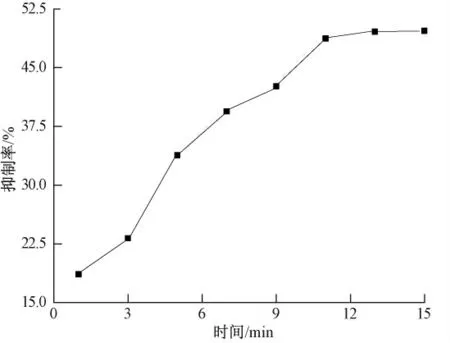
图8 农药的抑制率与抑制时间的关系
2.4 辛硫磷的检测
在优化的试验条件下,AChE/ZnO-GR/CHI/GCE 在不同浓度的辛硫磷溶液中的差分脉冲伏安图如图9 所示.由图9 可看出,随着辛硫磷浓度的增加,电流逐渐减小,响应电流的减少值与辛硫磷的浓度成正比关系,这样就得到了用于分析的工作曲线.如图10 所示,抑制率与辛硫磷浓度的对数值在1.0×10-11mol/L~1.0×10-6mol/L 范围内呈良好的线性关系,线性方程为:A(%)=109.56+8.66 lgc,相关系数为0.988 0,检出限为3.4×10-12mol/L(S/N=3).
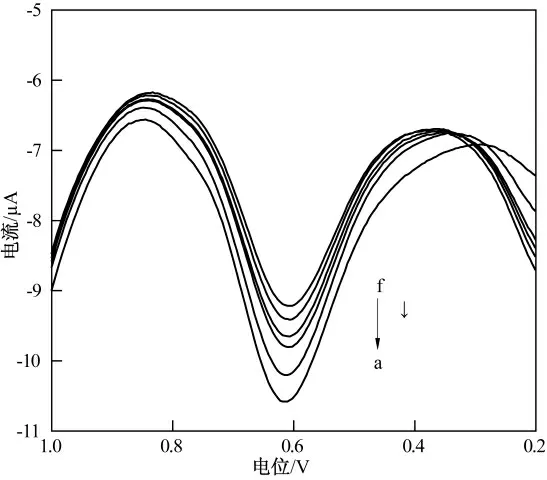
图9 传感器在不同浓度辛硫磷溶液中的差分脉冲伏安图
2.5 实际样品检测
称取10 g 新鲜白菜菜叶,用研钵研碎,然后置于表面皿中,用微量注射器吸取100 μL 10-5mol/L辛硫磷农药标准溶液,将其喷撒于菜叶上,加盖放置10 h,然后用丙酮萃取样品中的辛硫磷,过滤并转移至50 mL 的容量瓶中,定容摇匀,得到样品溶液.样品溶液进行加标回收率试验,回收率的范围在91.0%~110.0%之间.结果表明本试验所用的检测方法具有很高的准确性,可以用于实际样品的直接分析.
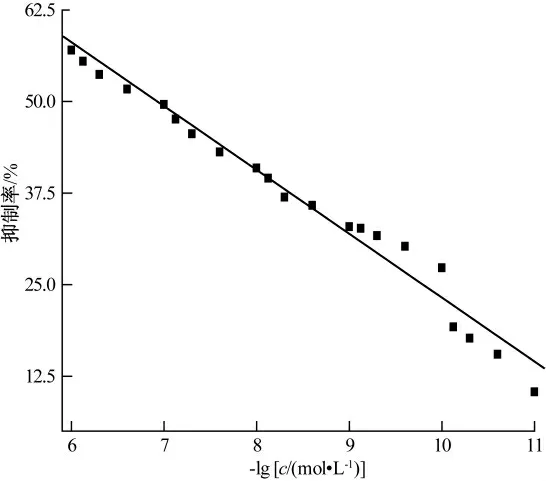
图10 辛硫磷的工作曲线图
3 结论
本文中提出了一种基于石墨烯-氧化锌复合物固定乙酰胆碱酯酶的新型生物传感器(AChE/ZnO-GR/CHI/GCE),并将其用于农药辛硫磷的测定.采用循环伏安法对不同修饰电极的电化学行为进行了表征,结果表明ZnO-GR/CHI 复合膜修饰于碳玻电极表面,能有效地提高玻碳电极的电化学响应能力及保持乙酰胆碱酯酶的生物活性.由于乙酰胆碱酯酶能催化底物氯化乙酰胆碱的水解,水解产物巯基胆碱在电极上发生氧化产生电流,农药的加入会使该电流减小,产生抑制作用,抑制率与加入农药浓度的对数在一定范围内有良好的线性关系,据此建立了测定辛硫磷的新方法.
[1]Li C Y,Wang C F,Ma Y,et al.A novel amperometric sensor and chromatographic detector for determination of parathion[J].Analytical Bioanalytical Chemistry,2005,381(2):1049-1055.
[2]Kandimalla V B,Ju H X.Binding of acetylcholinesterase to multiwall carbon nano -tube -cross-linked chitosan composite for flow-injection amperometric detection of an organophosphorous insecticide[J].Chemistry-A European Journal,2006,12(3):1074-1080.
[3]Wu P,Shao Q,Hu Y J,et al.Direct electrochemistry of glucose oxidase assembled on graphene and application to glucose detection[J].Electrochimica Acta,2010,55(28):8606-8614.
[4]Wei Q,Mao K X,Wu D,et al.A novel labelfree electrochemical immunosensor based on graphene and thionine nanocomposite[J].Sensors and Actuators B,2010,149(1):314-318.
[5]Wu J F,Xu M Q,Zhao G C.Graphene-based modified electrode for the direct electron transfer of Cytochrome c and biosensing[J].Electrochemistry Communication,2010,12(1):175-177.
[6]Paek S M,Yoo E J,Honma I.Enhanced cyclic performance and lithium storage capacity of SnO2/graphene nanoporous electrodes with three-dimensionally delaminated flexible structure[J].Nano Letters,2009,9(1):72-75.
[7]Li F H,Chai J,Yang H F,et al.Synthesis of Pt/ionic liquid/graphene nanocomposite and its simultaneous determination of ascorbic acid and dopamine[J].Talanta,2010,81(3):1063-1068.
[8]Xu T G,Zhang L W,Cheng H Y,et al.Significantly enhanced photocatalytic performance of ZnO via graphene hybridization and the mechanism study [J].Applied Catalysis B,2011,101(3-4):382-387.
[9]Ilaria P,Andrea C,Michele D C,et al.Determination of anticholineserase pesticides in real samples using a disposable biosensor[J].Analytica Chimica Acta,1997,354(1-3):179-187.
[10]Lepot N,Van Bael M K,Van den Rul H,et al.Synthesis of ZnO nanorods from aqueous so-lution[J].Material Letters,2007,61(13):2624-2627.
[11]Tang L H,Wang Y,Li Y M,et al.Preparation,structure and electrochemical properties of reduced graphene sheet films[J].Advanced Functional Materials,2009,19(17):2782-2789.

