慢性阻塞性肺疾病急性加重患者痰液病原体分布特征及与血气分析相关性的研究
冯 敏,季颖群,张中和
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的肺部疾病,急性加重及其并发症将加速患者的病情进展[1]。它是由多种因素构成的疾病,包括肺脏内外结构和功能的改变,炎症在疾病发病进展过程中起着核心作用[2]。有研究显示,COPD加重的频率平均为2.5~3.0次/年,加重频率随着疾病严重程度的增加而增加,而约有一半的加重并未引起患者的重视[2]。在过去十年,对慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)发病机制的理解已有了相当大的提高。反复急性加重是COPD重要的临床特征,不仅与显著的生理功能减退相关,而且也与病毒、细菌和大气污染等诱因增加气道炎症有关。反复加重不仅影响个体健康状况,还导致医疗费用和死亡率的增加[3-4]。2011年COPD全球策略修订版对其定义进行了修订,COPD的新定义为:“COPD是一种可以预防和可以治疗的常见疾病,其特征是持续存在的气流受限。气流受限呈进行性发展,伴有气道和肺对有害颗粒或气体所致慢性炎性反应的增加。急性加重和合并症影响患者整体疾病的严重程度”[5]。在冬季数月急性加重更为常见,这可能是低气温和病原微生物感染、大气污染等诱因相互作用的结果。然而,气道炎症、微生物病原体和加重的严重程度间的关系还没有确立。血气分析是评估AECOPD患者病情严重程度和指导机械通气等治疗的重要检查,在危重病抢救与监护过程中发挥着至关重要的作用。COPD血气分析异常首先表现为轻、中度低氧血症,随疾病进展,低氧血症逐渐加重,并出现高碳酸血症[6]。本研究对AECOPD患者进行痰培养和细菌学检查,同时行动脉血气分析检测,了解AECOPD患者的痰液病原体分布特征,并探讨其与动脉血氧分压(PaO2)、二氧化碳分压(PaCO2)的关系,以期指导临床经验性抗感染治疗。
1 对象与方法
1.1研究对象2008年12月—2010年3月入住大连医科大学附属第一医院呼吸科共有214例AECOPD患者,有184例患者采集到合格痰标本,其中男122例,女62例;年龄48~93岁,平均年龄(76±9)岁。所有患者COPD的诊断符合2011版《慢性阻塞性肺疾病全球倡议》中的标准[5],AECOPD的诊断参照Anthonisen标准[7]。按痰培养细菌检测结果,分为痰培养阳性组56例和阴性组128例。痰培养阳性组中,男32例,女24例,平均年龄(77±8)岁;痰培养阴性组中,男90例,女38例,平均年龄(75±9)岁。两组性别、年龄间有均衡性。
1.2研究方法
1.2.1痰标本收集和培养方法患者入院后在抗生素使用前及机械通气治疗前,先以无菌0.9%氯化钠溶液漱口3次,用力咳出深部的痰,弃去第一口痰,第二口痰留入无菌痰杯中。挑取痰液脓性部分涂抹于干净玻片上,经固定后革兰染色,在低倍镜(10×10)下观察鳞状上皮细胞和多核白细胞数,如鳞状上皮细胞数<10个/低倍视野和多核白细胞数>25个/低倍视野,为合格的痰标本[8],否则重新留取。假使收集到不止一次可分析痰标本,采用下列标准选择一个标本:低倍镜下多核白细胞越多和上皮细胞越少的痰越好[9]。如果咳不出痰,参照Sutherland等[10]的方案,吸入沙丁胺醇200 μg,10 min后经超声雾化器吸入3%无菌高渗氯化钠溶液10~20 min,用力咳痰至无菌痰杯中。雾化前0.9%氯化钠溶液漱口3次,以减少唾液污染,诱导出的痰同上处理。
按卫生部微生物操作规程,进行微生物常规分离培养。使用Aris型全自动细菌鉴定分析仪(先德公司,英国)进行细菌的鉴定。质控菌株:大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853,金黄色葡萄球菌ATCC25923,肺炎链球菌ATCC49619及白色念珠菌ATCC60193(菌株由美国BD公司提供)。
1.2.2血气分析检测所有患者入院后,签署知情同意书。在安静的环境中,患者卧床休息3~5 min,不吸氧或停止吸氧30 min后,取桡动脉或股动脉血1 ml。血标本严格隔绝空气,标本20 min内送检[11]。所使用的血气分析仪为西门子Rapidlab1245系列血气分析仪。
1.2.3机械通气治疗AECOPD患者留取合格痰后,根据症状、血气、胸部影像学检查等评估病情的严重程度,合理选择控制性氧疗、抗生素、支气管舒张剂、糖皮质激素及机械通气等治疗方案。综合评价所有入组AECOPD患者的病情,并参照2011版《慢性阻塞性肺疾病全球倡议》中急性加重期治疗建议[5],由两名以上的高年资医师决定是否进行机械通气治疗。
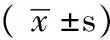
2 结果
2.1痰标本培养结果和病原体分布情况收集到合格痰标本的184例患者中,痰培养共检出56株致病病原体,培养阳性率为30.4%。56株病原体中,革兰阴性菌34株(占60.7%),其中非发酵菌16株(占28.6%);革兰阳性菌8株(占14.3%);真菌14株(占25.0%),见表1。

表1 AECOPD患者痰液病原体的分布情况
注:AECOPD=慢性阻塞性肺疾病急性加重
2.2两组患者PaO2和PaCO2比较痰培养阳性组与阴性组的PaO2和PaCO2比较,差异均有统计学意义(P<0.05,见表2)。
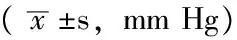
表2 两组患者PaO2和PaCO2的比较
注:PaO2=动脉血氧分压,PaCO2=二氧化碳分压;1 mm Hg=0.133 kPa
2.3两组患者进行机械通气治疗的情况比较184例患者中,共有24例入院后接受无创或有创辅助通气治疗。痰培养阴性组有6.2%(8/128)的患者接受机械通气治疗,痰培养阳性组有28.6%(16/56)的患者接受机械通气治疗,两组间比较差异有统计学意义(χ2=17.113,P=0.000)。
3 讨论
呼吸道感染是COPD发病和加剧的一个重要因素。Goddard等[12]报道,50%~70%的AECOPD由感染引起,包括细菌、真菌和病毒等,其中40%~50%的感染是由细菌感染引起。关于AECOPD的细菌谱,目前各研究报道存在一定的差异。2002年的一篇回顾性文献指出,按第1秒用力呼气容积占预计值百分比(FEV1%pred)分层,肺功能较好的患者(FEV1%pred≥50%)以肺炎链球菌和流感嗜血杆菌感染为主,而肺功能较差的患者(FEV1%pred<50%)以肠杆菌科和假单胞菌属细菌感染为主[13]。许建英等[14]对64例住院和门诊就医的AECOPD患者进行痰定量培养,48例患者痰中检测出病原体(菌落计数≥107cfu/ml),阳性率为75.0%,检测出的病原体以肺炎链球菌(37.5%)、肠杆菌(12.6%)、卡他莫拉菌(10.4%)及假单胞菌(8.4%)为多。其中38例同时进行了痰定性培养,细菌阳性检出率为68.4%,感染病原体以肺炎链球菌(30.4%)、表皮葡萄球菌(13.0%)、不动杆菌(10.9%)及肠杆菌(8.8%)为多,真菌感染率为6.5%,主要是白色念珠菌。把痰定量培养和痰定性培养结果比较,检测出的病原体均以肺炎链球菌等革兰阳性菌及肠杆菌、不动杆菌等条件致病菌为主,两者培养结果细菌菌株分布的一致率为55.3%。如果按上述肺功能分层来看,FEV1%pred≥50%的患者痰定性培养阳性率为30.8%,感染菌以革兰阳性菌为主,而FEV1%pred<50%的患者阳性率为88%,革兰阴性菌及非发酵菌感染率明显增加。从以上研究结果可以看出,不同国家地区AECOPD患者的感染病原体不完全一致,并且病情不同的患者感染的细菌种类也不同。一般认为,AECOPD患者经口痰标本定量培养中,菌落计数≥107cfu/ml(肺炎链球菌≥106cfu/ml),才能定为潜在的下呼吸道致病菌[15]。如果严格按照痰标本收集和送检流程,定性培养与定量培养阳性结果有较高的一致性,定性培养阳性菌也可以认为是有意义的潜在致病菌。
在本研究中,AECOPD患者痰定性培养阳性率为30.4%,致病菌以革兰阴性菌为主,其中肺炎克雷伯杆菌和鲍曼不动杆菌的检出率较高;真菌感染率偏高;而革兰阳性菌检出率较低,并且主要为金黄色葡萄球菌感染,与上述资料显示的AECOPD感染病原体不完全一致。考虑可能原因有:(1)本地区致病菌地域分布及其流行病学特征与上述研究不同;(2)本研究入选患者均为住院患者,年龄较大,并且病情较重(入选患者中有13.0%在住院期间接受机械通气治疗);(3)入选患者在住院前多有不规律口服或静脉使用抗生素治疗的病史;(4)有些病原体,如肺炎链球菌和流感嗜血杆菌等,为苛养菌,营养要求高,不易体外常规培养检出。鲍曼不动杆菌、嗜麦芽假单胞菌和铜绿假单胞菌等非发酵菌已经成为本地区住院AECOPD患者的常见致病菌。非发酵菌是条件致病菌,对常用抗生素多重耐药,甚至是泛耐药,给临床治疗带来困难。最近国内报道各地区非发酵菌感染有逐年上升的趋势[16-17],应引起临床高度重视。
经支气管镜肺泡灌洗或肺组织活检等侵袭性检查能提高肺部侵袭性真菌感染诊断的正确性和有效性。但有文献报道,进行侵袭性采样带来的危险要高于经验性抗真菌治疗带来的不利作用[18]。并且AECOPD患者可疑真菌感染时,一般状况均较差,无法耐受侵袭性检查采样。所以本研究采用痰涂片镜检筛查合格痰标本,再对合格痰标本用无菌0.9%氯化钠溶液充分洗涤以去除口咽部正常定植菌污染,这样获取的痰标本可以反映下呼吸道细菌感染情况。易震南等[19]报道,在119例AECOPD患者中,22例检测到下呼吸道真菌感染,占病例总数的18.5%,致病菌主要为白色念珠菌感染。这与本研究痰真菌培养结果是一致的。COPD患者易并发真菌感染可能与下列因素有关:(1)COPD患者,特别是频繁加重住院的患者,多是老年人群,体质较差,机体抵抗力下降,易导致本来寄存在上呼吸道条件致病菌如真菌向下蔓延引致感染;(2)长期应用广谱抗生素和不规范应用抗生素,导致机体菌群失调;(3)糖皮质激素的不规范使用,致使机体免疫功能下降,呼吸道防御机制破坏。在临床诊治过程中,应提高对真菌感染的认识和警惕性,避免医源性危险因素的产生。
细菌性病原体促成AECOPD的潜在途径包括:下呼吸道的初次感染;病毒感染后的二次感染;细菌抗原诱发的气道高反应和嗜酸粒细胞性炎症。研究已经证实不仅有细菌的存在,而且细菌数目[20]、新菌株获取[21]和可能与病毒的相互作用[22]都与COPD加重的特征相关。这些证据表明感染是AECOPD的主要原因,还可能参与了 COPD 的发病。
在细菌感染期间,细菌病原体、宿主及其体内复杂的相互作用导致气道炎症增加,从而引起AECOPD症状出现。气道上皮细胞损伤,破坏正常的纤毛活性而降低黏膜纤毛清除率,同时腺体黏液分泌增加。这些因素的综合作用将导致气道阻力增加,气流受限加重,临床上表现为患者加重期肺功能显著下降。在小气道固有狭窄基础上的气道阻力增加,是导致加重期病理生理紊乱的关键环节。通气量减少和气体交换功能受损,进而可以引起PaO2下降和二氧化碳潴留,甚至导致加重期呼吸功能衰竭。所以,本研究中细菌培养阳性患者的PaO2和PaCO2水平与细菌培养阴性患者相比有显著差异,并且在机械通气治疗的应用上也有显著的区别。
总之,本研究显示,本地区住院AECOPD患者的痰液病原体以革兰阴性菌为主,痰培养阳性患者通气和换气功能障碍进一步加重。初始抗生素的选择要充分考虑致病菌地域分布及其流行病学特征的不同,重视条件致病菌和真菌感染的治疗。血气分析提示病情危重的AECOPD患者,在细菌学结果回报前,应尽早给予合理抗生素治疗,避免延误治疗时机。
1Global Initiative for Chronic Obstructive Lung Disease.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease,updated 2008[Z].
2Wedzicha JA,Donaldson GC.Exacerbations of chronic obstructive pulmonary disease[J].Respir Care,2003,48(12):1204-1213.
3McGuire A,Irwin DE,Fenn P,et al.The excess cost of acute exacerbations of chronic bronchitis in patients aged 45 and older in England and Wales[J].Value Health,2001,4(5):370-375.
4Soler-Cataluna JJ,Martinez-Garcia MA,Roman Sanchez P,et al.Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease[J].Thorax,2005,60(11):925-931.
5GOLD Executive Committee.Global strategy for the diagnosis,management and prevention of chronic obstructive pulmonary disease[Z].2011.
6蔡柏蔷,李龙芸.协和呼吸病学[M].北京:中国协和医科大学出版社,2005:804-834.
7Anthonisen NR,Manfreda J,Marren CP,et al.Antibiotic therapy in exacerbation of chronic obstructive pulmonary disease[J].Am Intern Med,1987,106(2):196-204.
8Bathoorn E,Liesker JJ,Postmal DS,et al.Change in inflammation in out-patient COPD patients from stable phase to a subsequent exacerbation[J].International Journal of COPD,2009,4:101-109.
9Miravitlles M,Espinosa C,Fernández-Laso E,et al.Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD[J].Chest,1999,116(1):40-46.
10Sutherland ER,Pak J,Langmack EL,et al.Safety of sputum induction in moderate-to-severe chronic obstructive pulmonary disease[J].Respir Med,2002,96(7):4824-4886.
11钱桂生.动脉血气分析的判断[J].中华肺部疾病杂志:电子版,2008,1(2):173-178.
12Goddard RD,McNeil SA,Slayter KL,et al.Antimicrobials in acute exacerbations of chronic obstructive pulmonary disease-An analysis of the time to next exacerbation before and after the implementation of standing orders[J].Can J Infect Dis,2003,14(5):254-259.
13Miravitlles M.Exacerbations of chronic obstructive pulmonary disease:When are bacteria important?[J].Eur Respir J,2002,20(Suppl36):9s-19s.
14许建英,李筱妍,杜永成,等.慢性阻塞性肺疾病急性加重期病原学与肺功能关系的研究[J].中国呼吸与危重监护杂志,2007,6(2):88-92.
15Van der Valk P,Monninkhof E,van der Palen J,et al.Clinical predictors of bacterial involvement in exacerbations of chronic obstructive pulmonary disease[J].Clin Infect Dis,2004,39(7):980-986.
16黄成龙,张红.我院2011年常见细菌耐药性监测结果统计分析[J].实用心脑肺血管病杂志,2012,20(8):1377.
17王中新,徐元宏,李家斌,等.非发酵菌临床分布及耐药性的动态分析[J].中华医院感染学杂志,2005,15(2):203-206.
18中国侵袭性肺部真菌感染工作组.侵袭性肺部真菌感染的诊断标准与治疗原则(草案)[J].中国实用内科杂志,2006,26(21):1748-1751.
19易震南,黄仁清,宋泽庆,等.慢性阻塞性肺疾病急性加重期病情评估与真菌感染的研究[J].中华医院感染学杂志,2009,19(16):2099-2101.
20Stockley RA,O′Brien C,Pye A,et al.Relationship of sputum color to nature and outpatient management of acute exacerbations of COPD[J].Chest,2000,117(6):1638-1645.
21Sethi S,Evans N,Grant BJ,et al.New strains of bacteria and exacerbations of chronic obstructive pulmonary disease[J].N Engl J Med,2002,347(7):465-471.
22Papi A,Bellettato CM,Braccioni F,et al.Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations[J].Am J Respir Crit Care Med,2006,173(10):1114-1121.

