细胞重编程及其在再生医学中的应用前景 ——写在2012 年诺贝尔生理学或医学奖颁布之际
周军年,裴雪涛
2012 年 10 月 8 日,英国发育生物学家约翰·格登爵士(John B. Gurdon)和日本生物医学家山中伸弥(Shinya Yamanaka)因“发现成熟细胞可以被重编程(reprogrammed)为多能性(pluripotency)”而获奖,这次获奖是在短短五年时间内干细胞领 域的第二次获奖,上一次获奖是在 2007 年,马 丁·埃文斯因 1981 年成功分离出小鼠胚胎干细胞(embryonic stem cells,ESCs)而与另外两名从 事“基因打靶”(gene targeting)的科学家马里 奥·卡佩基、奥利弗·史密斯共享诺贝尔生理学或医学奖。
在 2006 年之前,通过体细胞重编程获得多能干细胞的办法有两个,即核移植(nuclear transfer)和细胞融合(cell fusion)。而核移植领域正是由 1962 年约翰·格登的具有划时代意义的实验所开 辟的,时年 29 岁的格登在完成博士学位时通过实验把蝌蚪分化细胞的细胞核移植进入卵母细胞质中,并培育出成体爪蟾,这是人类第一次从动物的成体细胞中克隆出一个新的动物,当 1997 年多利羊诞生之后,这种克隆技术才被人们广为所知。第一个进行细胞核移植的科学家是德国的汉斯·斯 佩曼(Hans Spemann,1935 年诺贝尔生理学或医学奖获得者),他在 1938 年时发现,把发育早期的蝾螈细胞核移植到去除了细胞核的发育晚期蝾螈胚胎中,胚胎细胞可以继续发育成为一个完整的蝾螈。既然单独的细胞核移植就可以让生物由一个细胞逐渐分化发育为一个完整的个体,那么这种现象就一定不会局限于胚胎细胞中。成体细胞是否也可采用类似技术重新发育成一个完整个体?因为在当时看来,胚胎细胞和成体细胞至少在基本结构上没有什么本质性的区别,都是由细胞核与细胞质构成的。毫无疑问,格登为这个问题提供了圆满的答案。核移植技术具有非常好的临床应用前景,尤其是在制备患者特异性的细胞来源方面,这也是约翰·格登获得诺贝尔奖的重要原因。
既然核移植和细胞融合能够使体细胞重编程,那么卵母细胞质和 ESCs 中必然存在某些因子能赋予体细胞多能性。然而在相当长的一段时间里,科学家们一直认为发育生物学上的“金科玉律”是不可打破的,即已经分化了的细胞是不可能逆转其发育生物学命运的。1987 年,Davis 等[1]报道通过过表达 MyoD,可以将成纤维细胞转分化为肌细胞,这对后来的山中伸弥是一个很大的启发,提示可以通过过表达特定的转录因子将体细胞重编程为多能干细胞。基于此推测,1999 年,在山中伸弥申请到奈良科学与技术学院助教授职位后即开始从事相关研究。在经过 7 年的痛苦历程后,终于从 24 个候选基因中筛到了 4 个与 ESCs 多能性密切相关的转录因子 Oct4、Sox2、c-Myc、Klf4,即 Yamanaka 因子,结果显示通过逆转录病毒转染这 4 个分子到小鼠成纤维细胞中,能够获得与 ESCs 特性基本相同的多能性干细胞系,将其称为诱导性多能干细胞(induced pluripotent stem cells, iPS cells),该研究结果在 2006 年发表后引起了极大的轰动[2],随后在 2007 年底,人 iPS 细胞同样被三个不同的研究小组成功建立[3-5]。从第一次获得小鼠胚胎干细胞[6]到 1998 年 Thomson 第一次获得人类胚胎干细胞[7],经历了 17 年,然而在这次里程碑式的发现浪潮中,科学家们用了很短的时间即实现了从小鼠 iPS 细胞到人 iPS 细胞的飞越。
但此前已有的关于 iPS 的研究,无一例外地采用了逆转录病毒载体将特定组合的编码转录因子的基因导入体细胞,存在潜在的致癌风险,这是人们最为担心的问题之一,也是 iPS 技术从实验室推向临床应用所面临的巨大障碍,因此在后续的以应用为目的的研究过程中,研究者主要是紧紧围绕两个问题展开研究,即“安全性”和“有效性”,其中,以“安全性”为主,兼顾“有效性”,因而在重编程方法上进行了很多卓有成效的改进和研究(表 1)。

表1 重编程方法总结和比较[8]
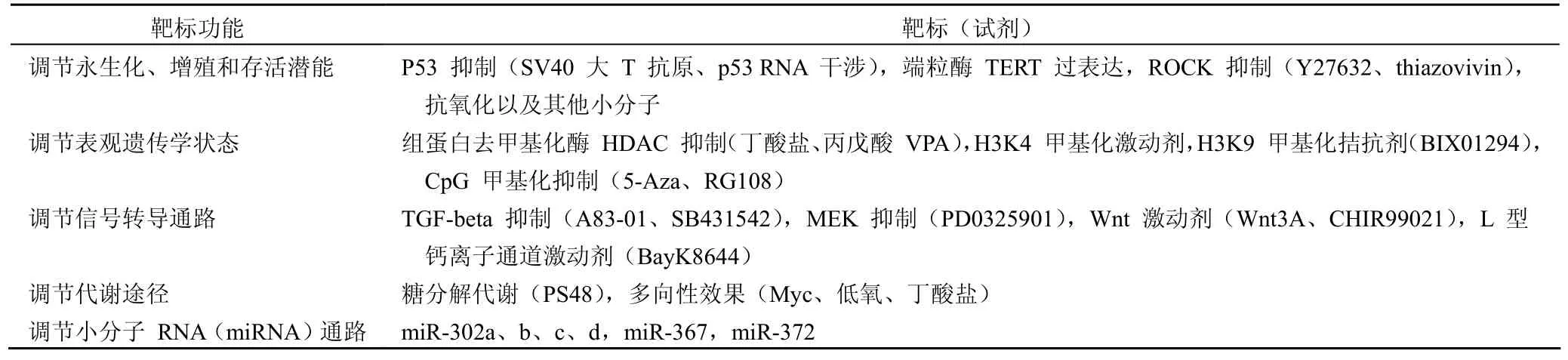
表2 重编程中使用的激活因子及靶标[8]
除了转染方法和手段的改进,在重编程因子上也实现了去除 c-Myc 的因子组合[9],并筛选了新的因子组合如 Oct4、Nanog、Sox2、Lin28[10]等,大大提高了 iPS 的安全性,但与此同时 iPS 产生效率也大大下降,因此研究者们根据重编程机制的研究筛选了一系列可以提高重编程效率的激活因子,包括小分子化合物、特异性 miRNAs、RNA 干涉策略等(表 2),尤其是小分子化合物大大加速了未来潜在的临床应用,而避开了繁琐的遗传转录因子介导的缓慢的重编程过程。
在 iPS 起源的种子细胞上,目前为止已经成功地从成纤维细胞[2-5]、B 淋巴细胞[11]、T 淋巴细 胞[12]、胰腺细胞[13]、胃细胞[14]、肝细胞[14]、甚至肿瘤细胞[15]等几乎所有类型的成体细胞获得了 iPS 细胞。
与核移植不同的是,与已分化细胞相比,成体干/祖细胞更容易被重编程为 iPS。如 Hochedlinger 实验室发现,造血干/祖细胞形成 iPS 的效率是终末分化的 B 细胞和 T 细胞的 300 多倍,形成率超过 28%[16]。而采用人脐血来源的 CD133+ 造血干/祖细胞,只需要 Sox2 和 Oct4 两个因子即可获得 iPS 细胞[17]。Kim 等[18]发现,仅需要两个转录因子 Oct4 和 Klf4 就足以诱导成年小鼠神经干细胞获得 iPS 细胞。此外,George Daley 实验室发现相比于皮肤细胞生成的 iPS 细胞,利用血细胞生成的 iPS 细胞更容易重新分化为血细胞,iPS 细胞的这种特性被称为“表观遗传记忆”(epigenetic memory)[19]。上述发现对于高效率获得 iPS 细胞或者高效诱导 iPS 细胞获得目的细胞具有重要的指导意义和应用价值。
目前,利用 iPS 分化来源的造血细胞[20]、神经细胞[21]、肝细胞[22]、心肌细胞[23]等在动物模型上进行相关疾病的治疗也已获得成功,从而表明其在体内具有良好的多向分化潜能。此外,目前可以通过 iPS 技术将患者的体细胞重编程为 iPS 细胞,用来研究疾病的发生机制或进行相关药物的筛 选[24]。iPS 的成功还意味着可以不用卵子或胚胎就能得到与胚胎干细胞系具有相似分化潜能,同时又可能获得与患者具有相同免疫配型的特异性的多能干细胞系,该项里程碑式的研究将有可能开启未来个体化治疗的发展之路。日本神户的科学家已经向政府申请开展世界上第一例 iPS 人体试验——利用患者自身来源的 iPS 细胞治疗视网膜疾病,如果治疗申请被批准,将是 iPS 细胞技术的世界首例临床应用。血液系统虽然目前还没有进入临床实验的报道,但其在 iPS 细胞应用方面的优势显而易见,由于血液细胞产品(红细胞、血小板)的无细胞核特性,使得 iPS 细胞基因组中一些潜在的危 险因素在分化获得的目的细胞中降至最低。同时,也使得进行血液患者来源的 iPS 细胞的基因纠正 (gene correction)成为目前较为安全的潜在应用之一[25-26]。
同样,我国在细胞重编程领域也取得了令人瞩目的成就,据统计,2011 年,中国在细胞重编程和诱导性多能干细胞领域发表的论文数量已位居世界第三位。我国中科院动物所周琪、上海交大曾凡一和北京生命科学研究所高绍荣等研究团队,于 2009 年分别利用 iPS 细胞克隆出小鼠,从而在世界上首次证明了 iPS 细胞的全能性[27-28]。在细胞重编程的机制研究领域,中科院广州生物医药与健康研究院裴端卿等在 Cell Stem Cell 上报道了间质表皮转换对重编程的发生是必需的[29]。
而在个体化治疗尚未真正启动之前,目前具有临床应用价值的一个工作是建立符合临床应用标准的人 iPS 细胞库。iPS 细胞储存计划是山中伸弥一直倡导的,该计划于 2012 年 7 月获得了日本卫生部委员会的支持,批准其利用来自日本全国保存的数千份胎儿脐带血样本建立一个细胞系库。山中伸弥计划到 2020 年建立一个包含 75 种 iPS 细胞系的标准库,从而匹配日本 80% 的人口。
之所以将细胞重编程技术视为再生医学发展的基础和重要突破,是因为它为多能干细胞获得提供了新的途径。此前实验室研究的干细胞主要来源为胚胎干细胞和成体干细胞,前者虽具有多向分化潜能,但因伦理、技术、资源、免疫、致瘤等问题使其研究和应用受到限制;而后者虽然较易获得,但其分化效率、组织整合等并不理想。综合而言,诱导性多能干细胞则集合了两者的优点,淡化了两者的缺点:来源为成熟细胞,获得相对广泛、数量充足;通过细胞重编程,可使其获得多向分化潜能;可以来源于患者自体,因此免除了伦理和免疫排斥等问题的困扰。
总之,iPS 细胞在其诞生的短短 6 个年头里,发展势头迅猛,虽然目前在应用的道路上还存在着众多问题,但来自不同国家的众多科学家们在快速而有效地解决着一个又一个束缚其潜在临床应用的问题,为其在不久的将来进行临床实验乃至临床应用奠定了坚实的科学基础,体细胞重编程诺贝尔奖的授予必将进一步加快这种应用基础研究的步伐。
[1] Davis RL, Weintraub H, Lassar AB. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell, 1987, 51(6):987-1000.
[2] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 2006, 126(4):663-676.
[3] Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 2007, 131(5):861-872.
[4] Yu J, Vodyanik MA, Smuga-Otto K, et al. Induced pluripotent stem cell lines derived from human somatic cells. Science, 2007, 318(5858): 1917-1920.
[5] Park IH, Zhao R, West JA, et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature, 2008, 451(7175): 141-146.
[6] Evans MJ, Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos. Nature, 1981, 292(5819):154-156.
[7] Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts. Science, 1998, 282(5391):1145- 1147.
[8] Mali P, Cheng L. Concise review: Human cell engineering: cellular reprogramming and genome editing. Stem Cells, 2012, 30(1):75-81.
[9] Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors. Science, 2008, 322(5903):949-953.
[10] Haase A, Olmer R, Schwanke K, et al. Generation of induced pluripotent stem cells from human cord blood. Cell Stem Cell, 2009, 5(4):434-441.
[11] Hanna J, Markoulaki S, Schorderet P, et al. Direct reprogramming of terminally differentiated mature B lymphocytes to pluripotency. Cell, 2008, 133(2):250-264.
[12] Loh YH, Hartung O, Li H, et al. Reprogramming of T cells from human peripheral blood. Cell Stem Cell, 2010, 7(1):15-19.
[13] Stadtfeld M, Brennand K, Hochedlinger K. Reprogramming of pancreatic beta cells into induced pluripotent stem cells. Curr Biol, 2008, 18(12):890-894.
[14] Aoi T, Yae K, Nakagawa M, et al. Generation of pluripotent stem cells from adult mouse liver and stomach cells. Science, 2008, 321(5889): 699-702.
[15] Carette JE, Pruszak J, Varadarajan M, et al. Generation of iPSCs from cultured human malignant cells. Blood, 2010, 115(20):4039-4042.
[16] Eminli S, Foudi A, Stadtfeld M, et al. Differentiation stage determines potential of hematopoietic cells for reprogramming into induced pluripotent stem cells. Nat Genet, 2009, 41(9):968-976.
[17] Giorgetti A, Montserrat N, Aasen T, et al. Generation of induced pluripotent stem cells from human cord blood using OCT4 and SOX2. Cell Stem Cell, 2009, 5(4):353-357.
[18] Kim JB, Zaehres H, Wu G, et al. Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors. Nature, 2008, 454(7204):646-650.
[19] Kim K, Doi A, Wen B, et al. Epigenetic memory in induced pluripotent stem cells. Nature, 2010, 467(7313):285-290.
[20] Park SW, Jun Koh Y, Jeon J, et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood, 2010, 116(25):5762-5772.
[21] Chambers SM, Fasano CA, Papapetrou EP, et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol, 2009, 27(2):275-280.
[22] Takayama K, Inamura M, Kawabata K, et al. Generation of metabolically functioning hepatocytes from human pluripotent stem cells by FOXA2 and HNF1α transduction. J Hepatol, 2012, 57(3):628- 636.
[23] Mummery CL, Zhang J, Ng ES, et al. Differentiation of human embryonic stem cells and induced pluripotent stem cells to cardiomyocytes: a methods overview. Circ Res, 2012, 111(3):344-358.
[24] Ye Z, Zhan H, Mali P, et al. Human-induced pluripotent stem cells from blood cells of healthy donors and patients with acquired blood disorders. Blood, 2009, 114(27):5473-5480.
[25] Zou J, Mali P, Huang X, et al. Site-specific gene correction of a point mutation in human iPS cells derived from an adult patient with sickle cell disease. Blood, 2011, 118(17):4599-4608.
[26] Raya A, Rodríguez-Pizà I, Guenechea G, et al. Disease-corrected haematopoietic progenitors from Fanconi anaemia induced pluripotent stem cells. Nature, 2009, 460(7251):53-59.
[27] Zhao XY, Li W, Lv Z, et al. iPS cells produce viable mice through tetraploid complementation. Nature, 2009, 461(7260):86-90.
[28] Kang L, Wang J, Zhang Y, et al. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell, 2009, 5(2):135-138.
[29] Li R, Liang J, Ni S, et al. A mesenchymal-to-epithelial transition initiates and is required for the nuclear reprogramming of mouse fibroblasts. Cell Stem Cell, 2010, 7(1):51-63.

