PDGF对哮喘大鼠气道平滑肌细胞中ERK通路的影响研究
卢虹蓓 张维溪 李昌崇
PDGF对哮喘大鼠气道平滑肌细胞中ERK通路的影响研究
卢虹蓓 张维溪 李昌崇
目的 研究血小板源性生长因子(PDGF)对哮喘大鼠气道平滑肌细胞(ASMC)中ERK信号通路的调控作用。 方法建立哮喘大鼠模型,原代分离培养ASMC,设未干预组(A组)、ERK阻断剂组(B组)、PDGF组(C组)和PDGF+ERK阻断剂组(D组)。A组不加干预;B组又分为B1、B2、B3、B4组,分别加入浓度为0.1、1、5、10μmol/L的ERK阻断剂U0126;C组又分为C1、C2、C3、C4组,分别加入浓度为1、10、25、50μg/L的PDGF同二聚体PDGF-BB;D组加入10μmol/L的U0126和50μg/L的PDGF-BB。以RT-PCR法检测各组ERK1和TGF-β1的mRNA表达,免疫组化法检测A、B4、C4和D组中以上蛋白的表达。 结果 RT-PCR提示B1、B2、B3、B4组ERK1 mRNA表达均显著低于A组(均P<0.01),U0126以浓度依赖的方式抑制PDGF诱导的ASMC中ERK的活化,C1、C2、C3、C4组ERK1 mRNA表达均显著高于A组(均P<0.01),ERK1 mRNA的表达与PDGF-BB存在明显的浓度依赖关系,D组与A组比较无统计学差异(P>0.05)。免疫组化提示B4组ASMC中ERK1蛋白表达显著低于A组,C4组显著高于A组(均P<0.01),D组与A组相比无统计学差异(P>0.05);B4组TGF-β1蛋白表达显著低于A组,C4组显著高于A组,同时C4组显著高于B4组(均P<0.01),D组与A组相比无统计学差异(P>0.05)。 结论 PDGF可剂量依赖性激活哮喘大鼠ASMC内的ERK通路,同时伴随TGF-β1信号通路的活化。ERK通路参与了ASMC增殖的细胞内信号转导过程,PDGF可能经ERK环节促进TGF-β1通路活化。
哮喘 气道平滑肌细胞 细胞外调节激酶 气道重塑 转化生长因子-β1
作为支气管哮喘(简称哮喘)的特征性病理生理改变之一,气道重塑(airway remodelling)的概念于1992年被明确提出。气道平滑肌细胞(airway smooth muscle cells,ASMC)增殖在气道重塑中占有十分重要的地位,有报道显示哮喘患者气道平滑肌厚度是对照组的3倍[1]。本实验以血小板源性生长因子(platelet-derived growth factor,PDGF)刺激哮喘大鼠ASMC增殖,并以ERK特异性抑制剂U0126阻断ERK通路后,观察ERK1和TGF-β1 mRNA及其蛋白在ASMC内的表达情况,探讨ERK信号通路对哮喘气道重塑的作用。
1 材料和方法
1.1 实验动物 SPF级健康雄性SD大鼠24只,4~6周龄,体重120~160g,由温州医科大学动物实验中心提供,饲养于SPF级实验动物饲养室。
1.2 主要试剂 DMEM培养基、胎牛血清和胰蛋白酶购于法国Biowest公司,小鼠抗大鼠TGF-β1单克隆抗体、小鼠抗大鼠磷酸化ERK1(p-ERK1)单克隆抗体购于美国Santa Cruz公司,小鼠抗大鼠α-actin单克隆抗体购于武汉博士德公司,重组大鼠PDGF-BB(PDGF的同二聚体之一)为美国R&D公司产品,U0126购于美国Cell Signal Technology公司,ERK1和GAPDH引物由上海生工公司合成,引物序列如下:ERK1上游:5′-GACTCCTACCTGAAGCATAC-3′,下游:5′-TCCTTGACACGCAGAATG-3′,产物203bp。TGF-β1上游:5′-GCAACAACGCAATCTATGAC-3′,下游:5′-CCCTGTATTCCGTCTCCTT-3′,产物 301bp。GAPDH上游:5′-CAAGTTCAACGGCACAGTCAA-3′,下游:5′-TGGTGAAGACGCCAGTAGACTC-3′,产物140bp。
1.3 哮喘大鼠模型的建立和ASMC的培养[2]
1.3.1 哮喘大鼠模型建立 按随机数字表法选取12只大鼠,依据既往报道方法建立哮喘大鼠模型[3-4]。致敏阶段:第1天和第8天腹腔注射卵清白蛋白OVA/Al(OH)3混合液1.5ml[内含OVA 1mg和Al(OH)3100mg]。激发阶段:第15天开始以含1%OVA的0.9%氯化钠溶液雾化吸入,隔天一次,每次30min,共60d。另外12只大鼠为对照组,致敏和激发时均以0.9%氯化钠代替OVA,其余与哮喘组相同。各组均于末次激发后2h处死大鼠,留取血清并立即开胸,右肺经支气管肺泡灌洗留取支气管肺泡灌洗液(BALF),分离左肺组织用于病理切片、免疫组织化学检测。
1.3.2 哮喘大鼠ASMC的培养和鉴定 从12只哮喘大鼠中平均分离提取气管、支气管平滑肌组织,以胶原酶-胰酶混合消化法培养哮喘大鼠ASMC。细胞生长融合后,0.25%的胰蛋白酶消化,以107~108/L的密度传代培养。光镜和电镜下观察细胞形态学并对细胞内平滑肌肌动蛋白α-actin进行免疫组织化学染色。>95%的细胞着色呈阳性,证实为ASMC。取生长状态良好的3~5代细胞用于实验。
1.4 ASMC的分组和药物干预
1.4.1 ASMC的分组 哮喘大鼠ASMC按是否加入药物及药物浓度的不同分为未干预组(A组),加入无血清DMEM 2ml;ERK阻断剂组(B组),根据药物干预浓度不同分为B1、B2、B3、B4四组,分别加入含U0126浓度为0.1、1、5、10μmol/L的DMEM 2ml;PDGF组(C组),根据药物干预浓度不同分为C1、C2、C3、C4四组,分别加入含PDGF-BB浓度为1、10、25、50μg/L的DMEM 2ml;PDGF+ERK阻断剂组(D组),加入含U0126和PDGFBB的浓度分别为10μmol/L和50μg/L的DMEM 2ml。
1.4.2 ASMC的药物干预 细胞按6×103/ml的密度接种于6孔板,待生长至接近融合时,吸出培养液,DHanks液洗细胞,加入含1%胎牛血清的DMEM/F12培养液,维持培养24h,使细胞同步化于G0期,加入不同浓度的U0126和PDGF-BB作用2h后,以无血清培养基洗涤细胞,以备进一步实验。
1.5 RT-PCR法测ASMC内TGF-β1及ERK1的mRNA表达 提取总RNA,采用紫外分光光度法检测RNA纯度后行RT-PCR,用Smart View凝胶数字成像系统扫描分析PCR产物电泳条带。目的mRNA的相对含量以目的条带与GAPDH条带吸光度比值表示。
1.6 免疫组化SP法检测ASMC内ERK1蛋白及TGF-β1蛋白表达 从6孔板内取出细胞爬片,免疫组化SP法染色,胞质内有棕黄色沉淀为阳性结果。应用imagepro plus图像分析软件测定阳性部位的平均吸光度(MOD),用以代表阳性部位的蛋白表达水平。
1.7 统计学处理 采用SPSS 10.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,进一步以LSD-t检验进行两两比较。
2 结果
2.1 各组大鼠一般情况及病理改变 哮喘组大鼠在激发时均出现不同程度的烦躁不安、呼吸急促、腹肌抽搐、大小便失禁等症状,严重者呼吸减慢或节律不齐,行动迟缓或俯伏不动,而对照组大鼠无上述表现。经过多次激发后,哮喘组上述症状反而有所减轻,但体重增长减慢,毛色无光泽。光镜示哮喘组黏膜下、支气管及血管周围大量炎症细胞浸润,气道上皮黏液腺增生,支气管壁明显增厚、管腔狭窄,嗜酸粒细胞增多;电镜下示哮喘组肺泡Ⅱ型上皮细胞内质网扩张,胶原纤维增生,肺泡隔增宽,见图1。

图1 哮喘组大鼠气管及肺泡病理切片(A:光镜观察,HE染色,×200;B:光镜观察,HE染色,×400;C:电镜观察,×6 000)
2.2 RT-PCR检测ASMC中ERK1和TGF-β1 mRNA的表达 B1、B2、B3、B4组大鼠ASMC中ERK1 mRNA表达均显著低于A组,且B组内两两比较,均有统计学差异;C1、C2、C3、C4组大鼠ASMC中ERK1 mRNA表达均显著高于A组,且C组内两两比较,也均有统计学差异(均P<0.01),D组与A组相比无统计学差异(P>0.05)。各组间TGF-β1 mRNA表达比较均无统计学差异(均P>0.05),见表1及图2。
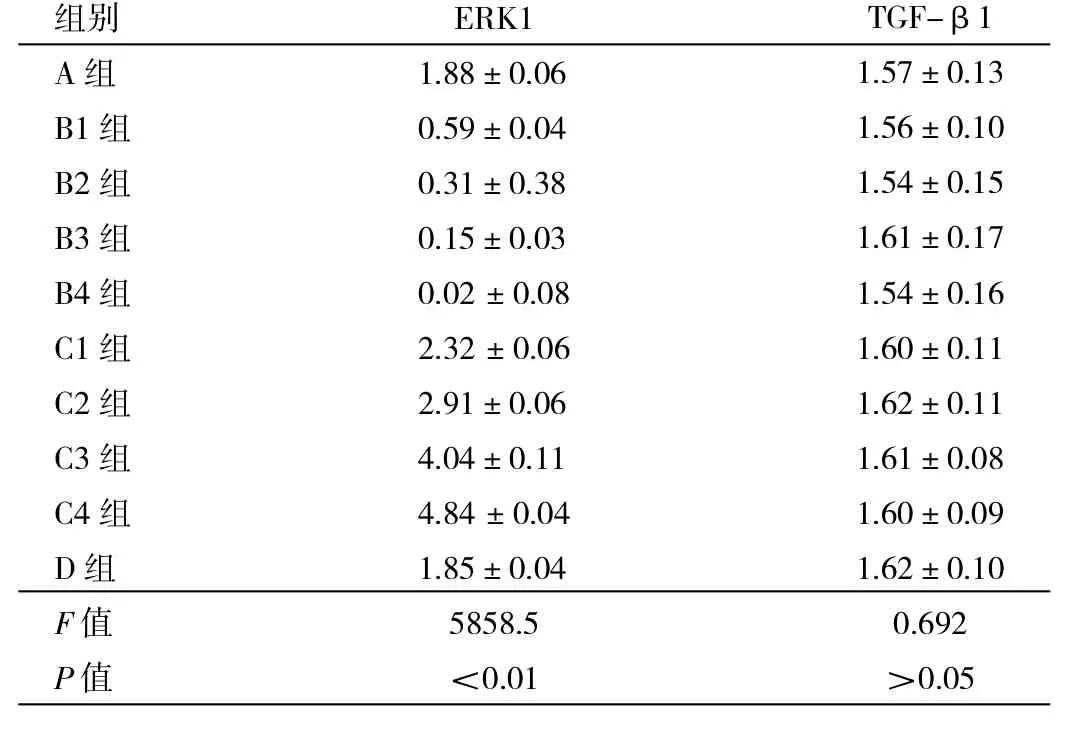
表1 各组大鼠ASMC中ERK1和TGF-β1 mRNA的表达
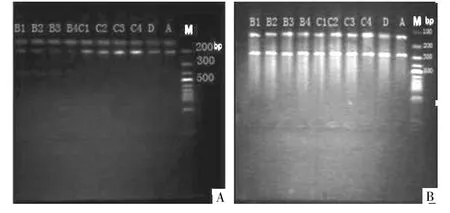
图2 RT-PCR检测ASMC中ERK1和TGF-β1 mRNA的表达(A:ERK1;B:TGF-β1)
2.3 免疫组化检测ASMC内ERK1和TGF-β1蛋白表达 大鼠ASMC中ERK1蛋白的表达B4组(0.18±0.05)显著低于A组(0.31±0.03),C4组(0.68±0.02)高于A组及B4组(均P<0.01),D组(0.33±0.02)与A组相比无统计学差异(P>0.05)。TGF-β1蛋白表达B4组(0.10± 0.02)显著低于A组(0.28±0.04),C4组(0.55±0.03)显著高于A组和B4组(均P<0.01),D组(0.29±0.02)与A组相比无统计学差异(P>0.05)。
3 讨论
ERK信号转导通路广泛存在于多种细胞内,是MAPK信号通路的3个家族成员之一,目前已发现它在ASMC上广泛分布,主要以ERK1、ERK2两种亚型存在[5-6]。目前认为ASMC释放很多细胞因子都通过ERK通路激活[7]。早期的很多研究发现ras-ERK通路的激活对于细胞增殖、DNA合成和细胞周期调控有重要意义。笔者既往研究也表明,ERK介导的信号转导通路在ASMC增殖中发挥着十分重要的作用[3-4]。
PDGF包括4个同二聚体(PDGF-AA、PDGF-BB、PDGF-CC、PDGF-DD)及1个异二聚体(PDGF-AB)五个亚型。PDGF能促进成纤维细胞、神经胶质细胞、平滑肌细胞(SMC)的有丝分裂,尤其对SMC的作用更明显,使细胞由静止的G1/G0期进入到细胞周期的增殖期[8],但其具体机制尚不十分明确。笔者前期研究发现,制作哮喘大鼠模型后,对哮喘组、激素组、对照组进行研究,哮喘组大鼠血清PDGF-AB浓度和p-ERK以及c-Fos浓度高于对照组和激素组,糖皮质激素能抑制哮喘大鼠ERK以及c-Fos的磷酸化,并在一定程度上减低支气管壁和平滑肌的厚度[4]。Liu等[9]发现重度哮喘患者支气管上皮细胞和SMC中磷酸化ERK1/2强表达,与中度哮喘患者和健康志愿者有显著差异,得出ERK1/2通路调节上皮细胞的分泌和增殖功能的结论。
本研究发现,以PDGF-BB作用于ASMC后,ASMC内的ERK1蛋白及ERK1 mRNA表达均明显增多,且ERK1 mRNA表达增多与PDGF-BB存在明显的浓度依赖关系。使用U0126阻断ERK通路后,PDGF诱导ERK1蛋白表达增强的效应完全被阻断,ERK1 mRNA表达明显减少,U0126以浓度依赖的方式抑制PDGFBB诱导上皮细胞ERK的活化,说明PDGF可剂量依赖地激活哮喘大鼠ASMC内的ERK通路,ERK通路则参与了ASMC增殖的细胞内信号转导过程。
既往研究发现,ERK通路和TGF-β1通路都可促进ASMC增殖,且在许多细胞中ERK途径和TGF-β1途径存在交互作用,共同协调细胞的生物学行为[10-13]。本实验中以PDGF作用于哮喘大鼠ASMC后,随着ERK通路的激活,TGF-β1蛋白表达增加;而以U0126阻断ERK通路后,TGF-β1蛋白表达随之减少。由此笔者得出如下推论:PDGF-Ras-Raf-MAPK-ERK通路可能经ERK环节促进TGF-β1通路活化,其中的具体干预机制仍有待进一步研究。
[1]Cokugras H,Akcakaya N,Seckin,et al.Ultrastructural examination of bronchial biopsy specimens from children with moderate asthma[J].Thorax,2001,56(1):25-29.
[2]卢虹蓓,张维溪,李昌崇.哮喘大鼠气道平滑肌细胞培养方法探讨[J].温州医学院学报,2009,39(3):264-266.
[3]李昌崇,管小俊,张维溪,等.细胞外信号调节激酶信号转导途径在哮喘大鼠气道重塑中作用及糖皮质激素的调控[J].中华儿科杂志,2007,45 (4):288-292.
[4]管小俊,张维溪,李昌崇,等.细胞外信号调节激酶和转换生长因子β1在哮喘气道重塑中的作用以及糖皮质激素的调控[J].中华医学杂志, 2007,87(25):1767-1772.
[5]Corbel M,Caulet-Maugendre S,Germain N,et al.Enhancement of gelatinase activity during development of subepithelial fibrosis in a murine model of asthma[J].Clin Exp Allergy,2003,33(5):696-704.
[6]Masuda T,Tanaka H,Komai M,et al.Mast cells play a partial role in allergen-induced subepithelial fibrosis in a murine model of allergic asthma[J].Clin Exp Allergy,2003,33(5):705-713.
[7]Gerthoffer W T,Singer C A.MAPK regulation of gene expression in airway smooth muscle[J].Respir Physiol Neurobiol,2003,137(2-3): 237-250.
[8]Stiles C D.The molecular biology of platelet-derived growth factor [J].Cell,1983,33(3):653-655.
[9]Liu W,Liang Q,Balzar S,et al.Cell-specific activation profile of extracellular signal-regulated kinase 1/2,Jun N-terminal kinase, and p38 mitogen-activated protein kinases in asthmatic airways [J].J Allergy Clin Immunol,2008,121(4):893-902.
[10]Song C Y,Kim B C,Hong H K,et al.TGF-beta type II receptor deficiency prevents renal injury via decrease in ERK activity in crescentic glomerulonephritis[J].Kidney Int,2007,71(9):882-888.
[11]Risbud M V,Di Martino A,Guttapalli A,et al.T oward an optimum system for intervertebral discorgan culture:TGF-beta 3 enhances nucleus pulposus and anulus fibrosus survival and function through modulation of TGF-beta-R expression and ERK signaling[J].Spine,2006,31(8):884-890.
[12]Imamichi Y,Waidmann O,Hein R,et al.TGF beta-induced focal complex formation in epithelial cells is mediated by activated ERK and JNK MAP kinases and is independent of Smad4[J].Biol Chem,2005,386(3):225-236.
[13]Kim E S,Kim M S,Moon A.TGF-beta-induced upregulation of MMP-2 and MMP-9 depends on p38 MAPK,but not ERK signaling in MCF10A human breast epithelial cells[J].Int J Oncol, 2004,25(5):1375-1382.
PDGF induces proliferation of airway smooth muscle cells of asthmatic rats through activation of ERK signal pathway
Objective To investigate the effect of platelet-derived growth factor(PDGF)on proliferation of airway smooth muscle cells(ASMC)in asthmatic rats and its relation to external signal regulated kinase(ERK)signal pathway.Methods Asthma model was established in Sprague-Dawley rats.ASMCs separated from asthmatic rats were divided into four groups:group A without any intervention served as control,group B was treated with ERK blocking agent U0126 0.1μmol/L(B1),1μmol/L(B2), 5μmol/L(B3)or 10μmol/L(B4),group C was treated with recombinant rat PDGF-BB 1μg/L(C1),10μg/L(C2),25μg/L(C3)or 50μg/L(C4),group D was treated with 10μmol/L U0126 and 50μg/L PDGF.The mRNA expressions of ERK1 and TGF-β1 in ASMCs of asthmatic rats were detected by RT-PCR.The protein expressions of ERK1 and TGF-β1 were detected by immunohistochemistry(group A,B4,C4 and D only). Results Compared to group A,the expressions of ERK1 mRNA in ASMCs of groups B1,B2,B3 and B4 were significantly decreased(P<0.01)in a concentration-dependent manner;while the expressions of ERK1 mRNA in groups C1,C2,C3 and C4 were significantly increased(P<0.01)in a concentration-dependent manner.There was no significant difference in expressions of ERK1 mRNA between group D and group A(P>0.05).Immunohistochemistry showed that the expression of P-ERK1 in ASMCs of group B4 was significantly lower and that of group C4 was higher than that in group A(both P<0.01);while there was no significant difference between group D and group A(P>0.05).Conclusion PDGF can induce the proliferation of airway smooth muscle cells of asthmatic rats,in which the activation of ERK signal pathway is involved.
Asthma Airway smooth muscle cells External signal regulated kinase Airway remodeling TGF-β1


2012-12-10)
(本文编辑:胥昀)
国家自然科学基金项目(30571981;30271383)
325027 温州医科大学育英儿童医院呼吸科(卢虹蓓系硕士研究生,现在丽水市中心医院儿科工作)
李昌崇,E-mail:wzlichch@21cn.com

