马铃薯抗青枯病和低温糖化体细胞杂种的鉴定
李琼,王海波,蔡兴奎,雷婷,柳俊
(华中农业大学生命科学技术学院,园艺植物生物学教育部重点实验室,国家蔬菜改良中心华中分中心,湖北武汉430070)
遗传育种
马铃薯抗青枯病和低温糖化体细胞杂种的鉴定
李琼,王海波,蔡兴奎,雷婷,柳俊*
(华中农业大学生命科学技术学院,园艺植物生物学教育部重点实验室,国家蔬菜改良中心华中分中心,湖北武汉430070)
ACC-1-1和ACC-1-2再生株系由来自马铃薯二倍体栽培种(Solanum tuberosum)品系AC142-01(2n= 2x=24)和二倍体野生种S.chacoense的一个无性系C9701(2n=2x=24)经原生质体融合获得,经鉴定为体细胞杂种。流式细胞仪分析和染色体计数显示,ACC-1-1为混倍体,ACC-1-2为八倍体。两个株系均能正常开花但花粉活力较低。花粉母细胞减数分裂观察显示,两个系在减数分裂各个时期均出现广泛的异常染色体行为,可能是花粉活力低的原因。青枯病接种鉴定表明,ACC-1-2对青枯病表现为高抗,而ACC-1-1表现为中感,同时这两个株系均具有“低温糖化”抗性,证明体细胞融合加上适当选择可以有效聚合有性杂交不亲和双亲的优良性状。
马铃薯;体细胞杂种;青枯病;低温糖化
马铃薯原始栽培种和野生种具有众多优良性状,如对各种病虫害的抗性、对逆境的耐性及其他重要的经济性状等,是马铃薯巨大的种质资源库[1]。将这些原始栽培种和野生种的优良性状导入栽培种中愈来愈被世界各国的育种家所重视。然而,由于胚乳平衡数(Endosperm balance number,EBN)[2]及杂交不亲和性等障碍,导致野生种和普通栽培种之间直接杂交很难成功,限制了这些野生种在杂交育种中的应用。体细胞融合技术可以有效的克服种间杂交障碍,为野生种的利用提供了有效途径。随着体细胞杂交技术的不断成熟和完善,这一技术已逐渐成为育种资源创制的重要途径。利用该技术,已创制出大量的马铃薯种内、种间、属间甚至是科间的体细胞杂种[3-7]。
马铃薯抗病优质是新品种选育的基本要求,但目前的育种资源中同时具有抗病性和优质性的基因型很少,虽然利用杂交重组理论上可以将两个性状互补,但其组合频率很低,育种几率有限。特别是前期在进行体细胞杂交过程中,受培养反应的限制,一般栽培种亲本以考虑容易培养的基因型为主,对其优良性状考虑不多,导致创制的体细胞杂种直接利用受到限制。本实验室前期利用抗“低温糖化”二倍体栽培种系AC142-01和抗青枯病的二倍体野生种Solanum chacoence的一个无性系C9701通过原生质体融合获得了两个体细胞杂种系,但它们是否同时具有青枯病抗性和抗低温糖化能力目前还不清楚。本研究在进一步确定其杂种特征的基础上,对其抗青枯病和抗低温糖化特性及其与育种相关的性状进行了鉴定,为育种利用奠定基础。
1 材料与方法
1.1 试验材料
二倍体栽培种无性系AC142-01(2n=24),二倍体野生种S.chacoense的一个无性系C9701(2n= 24),原生质体融合获得的两个融合子[8]ACC-1-1、ACC-1-2。
1.2 材料种植
2012年将继代培养3周的再生植株及其亲本试管苗移栽到网室花钵中(AB 380 mm)。每个株系种植8株。待收获后的块茎打破休眠后,继续钵栽种植于网室用于性状观察。
1.3 融合植株的分子鉴定
利用SSR标记和RAPD标记鉴定两个再生株系是否为体细胞杂种。基因组DNA抽提方法参见Ghislain等[9]的方法。SSR引物来自于CIP数据库(http:∕∕research.cip.cgiar.org∕IPD∕SSR-primer),PCR扩增反应体系、程序及产物的检测参照Chen等[10]。
1.4 倍性检测
杂种植株的倍性检测采用根尖染色体压片和流式细胞仪检测。根尖染色体压片参照叶文宣[11]的方法;流式细胞仪检测参照郭鲜蒲[12]的方法。
1.5 花粉母细胞的细胞学观察
从2013年5月12日开始,于晴天上午8∶30~10∶00采集杂种及亲本不同大小的花蕾。采集后的花蕾的处理及观察等参照郭鲜蒲[12]的方法。
1.6 花粉活力测定
在2013年5月的晴天上午取刚刚开放的花蕾(花药刚裂开,花药裂口处未变黑),采用醋酸洋红染色的方法测定体细胞杂种及其亲本的花粉活力。检测方法参照郭鲜蒲[12]的方法。
1.7 青枯病室内鉴定
青枯病抗性鉴定方法参见蔡兴奎[13]的方法。菌株采用本实验室分离并鉴定的青枯菌生理小种1号(生化3号),以马铃薯栽培种‘中薯二号’孤雌生殖无性系8#作为感病对照,体细胞杂种3C28-1作为抗性对照。抗性评价参照梁远发等[14]的方法。
1.8 低温糖化检测
油炸薯片的加工、色泽分析及还原糖含量的测定参照欧庸彬[15]的方法。
2 结果与分析
2.1 杂种鉴定
研究对两个融合子同时采用RAPD标记和SSR标记进行了鉴定。RAPD引物OPI-10(ACA ACG CGA G)在两融合亲本中可以扩增出差异条带,栽培种亲本AC142-01的特征带显示在800 bp左右,野生种亲本C9701的特征带大小约为600 bp,融合子均同时显示了互补的特征带(图1 a),说明二者均为体细胞杂种。进一步采用一个在两融合亲本中可以扩增出差异条带的SSR标记引物STI0057对体细胞杂种进行鉴定,结果显示引物STI0057在栽培种亲本AC142-01的特征片段大小约为140 bp,野生种亲本C9701的特征片段大小约为160 bp,在变性胶上呈现大小不同的清晰带(图1 b)。两个融合子同时具有双亲的特异片段,进一步说明再生株系是双亲融合的体细胞杂种。
2.2 体细胞杂种倍性分析
2.2.1 流式细胞仪分析
本研究首先采用流式细胞仪对两个体细胞杂种的倍性进行了初步鉴定。以二倍体栽培种融合亲本为对照,峰值定位于50。结果显示,ACC-1-1呈现出两个明显的主峰,峰值分别为123和211,表明其为混倍体;ACC-1-2只有一个明显的主峰,峰值为187,按照对照峰值推算可能为八倍体(图2)。
2.2.2 体细胞杂种的染色体计数
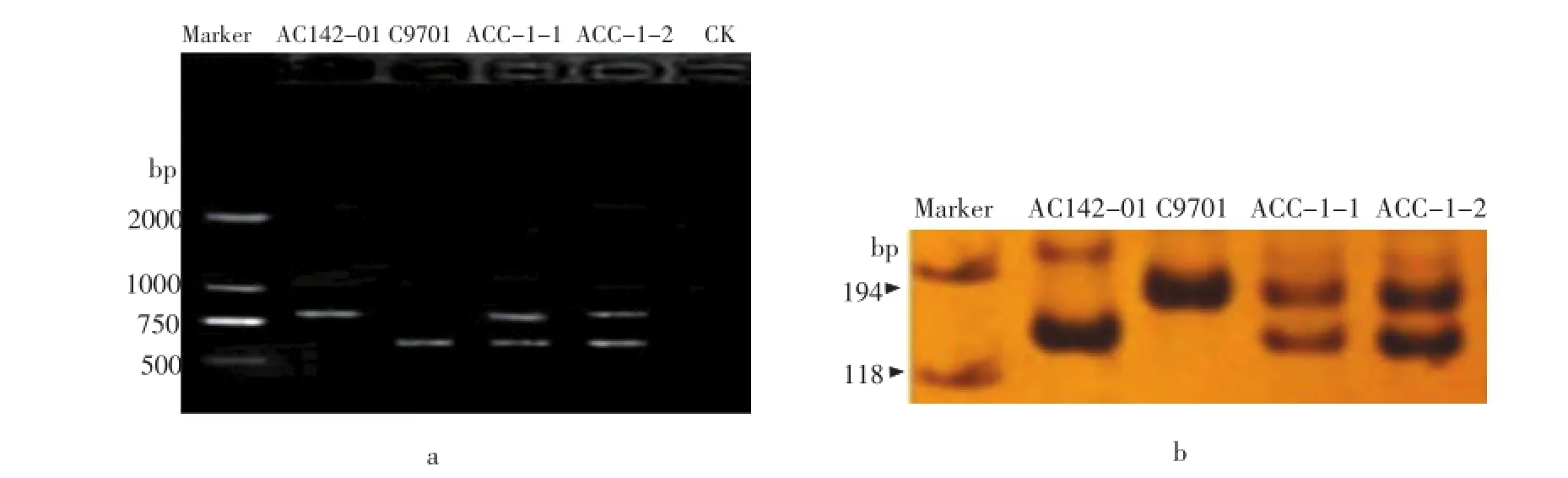
图1 体细胞杂种鉴定Figure 1 Identification of somatic hybrids by RAPD and SSR markers
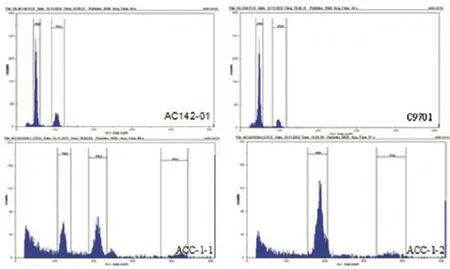
图2 流式细胞仪检测亲本及体细胞杂种植株的倍性水平Figure 2 Ploidy determination of in vitro plants of fusion parents C9701 and AC142-01 and their somatic hybrids by flow cytometer
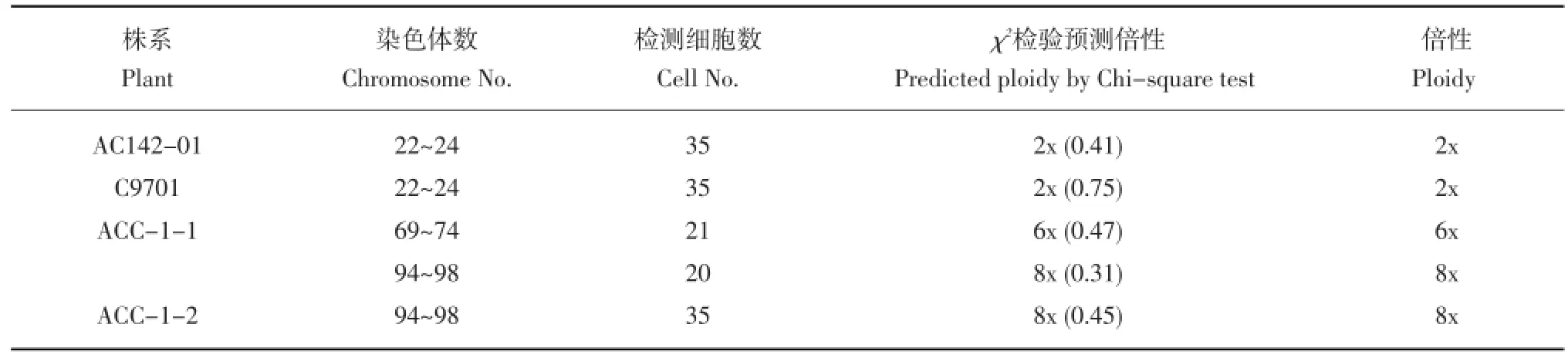
表1 体细胞杂种的染色体数Table 1 Chromosome number of somatic hybrids
进一步对两个亲本和两个体细胞杂种系进行了染色体计数,每个材料至少统计35个细胞。统计分析结果列于表1。染色体计数结果表明,AC142-01(图3 a)和亲本C9701(图3 b)染色体数在22~24之间,卡方检测证明其与二倍体(2n=2x= 24)显著符合。杂种ACC-1-1有两种细胞类型,一类为染色体数69~74,卡方检测与六倍体(2n=72)显著符合(图3 c),另一类为染色体数94~98,卡方检测与八倍体(2n=96)显著符合(图3 d)。这一结果与上述流式细胞仪检测结果一致,说明该系为六倍体至八倍体的混倍体。ACC-1-2的染色体数94~98,卡方检测表明该系为八倍体(图3 e)。
2.3 体细胞杂种花粉母细胞(PMC)减数分裂观察
将2012年秋季收获的杂种及亲本的块茎催芽,于2013年2月种植在网室花钵中,均能够正常现蕾开花。在现蕾期取亲本和体细胞杂种不同大小的花蕾用于小孢子减数分裂观察。观察结果表明,融合双亲小孢子形成过程中,减数分裂各时期染色体行为大多正常,二分体、四分体形成正常。但体细胞杂种小孢子减数分裂过程中的染色体行为大多不正常,各个时期均能观察到异常的染色体行为(表2)。从表2可以看出,两个杂种小孢子减数分裂的各个时期均观察到非正常细胞学现象,整体看第二次减数分裂的非正常细胞比例高于第一次减数分裂。混倍体杂种ACC-1-1异常染色体细胞比例高于八倍体ACC-1-2。
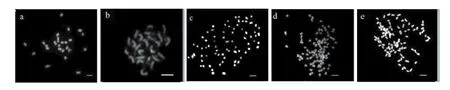
图3 体细胞杂种及其融合亲本的染色体数目Figure 3 Chromosomes of somatic hybrids and their fusion parents
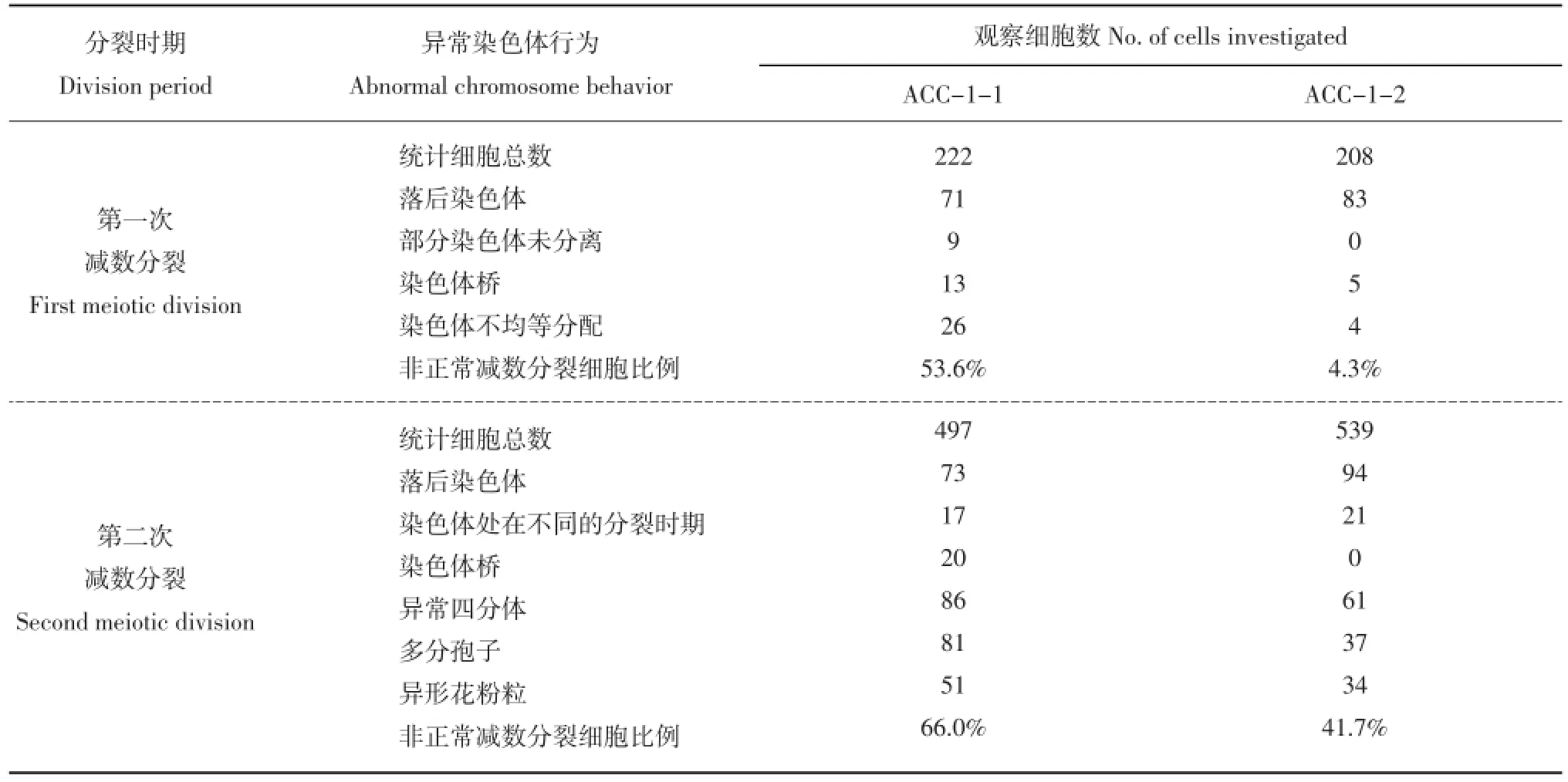
表2 体细胞杂种花粉母细胞的异常染色体行为Table 2 Abnormal meiosis of somatic hybrids
在终变期对杂种染色体配对形式进行观察统计,结果显示,终变期体细胞杂种花粉母细胞的染色体构型复杂,大部分花粉母细胞含有“8”字形、“X”形、单价体等异常染色体配对构型(图4 a,b);杂种第一次减数分裂的异常行为主要包括落后染色体(图4 c,f,h)同源染色体不分离(图4 d),末期I的异常行为有染色体不均等分裂(图4 e),染色体桥(图4 g)等。在第二次减数分裂中,出现两极染色体行为不同步(图4 i,j,n),落后染色体(图4 k),互相垂直的纺锤体(图4 l),个别细胞的纺锤体呈品形分布(图4 m),染色体桥(图4 p)等,在末期II,体细胞杂种的表现较为复杂,有不同数目微核的异常四分体(图4 o,r),多分孢子(图4 q),此外,如图4 s所示,同一花药中既有正常的四分体,也有五分体。在花粉粒时期,可以观察到异常的花粉粒(图4 t)。
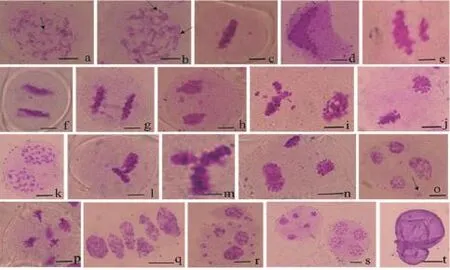
图4 马铃薯体细胞杂种的小孢子发育Figure 4 Microsporogenesis of somatic hybrids
2.4 体细胞杂种的花粉活力
采用醋酸洋红染色法对体细胞杂种及其亲本的花粉活力进行检测。结果显示,融合亲本C9701的花粉染色率为91.4%,AC142-01为85.9%,而体细胞杂种ACC-1-1和ACC-1-2分别只有28.8%和40.2%(图5)。从图5还可以看出,两亲本的花粉形态大多呈现饱满的圆形(图5 a,b),只有少数异常的小花粉不能被醋酸洋红染色。而体细胞杂种在同等条件下,能够被染色的花粉少,即使有被染色的花粉着色也较浅,大部分花粉粒呈不规则皱缩形态(图5 c,d)。两个杂种株系相比,ACC-1-2比ACC-1-1的能够着色花粉比例高,亦有少数形态相对饱满的花粉粒。
2.5 体细胞杂种表型
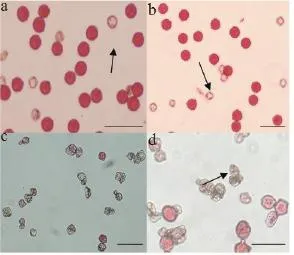
图5 融合亲本及体细胞杂种的花粉特征(标尺代表100 μm)Figure 5 Pollen characteristics of fusion parents and two somatic hybrids(bars=100 μm)
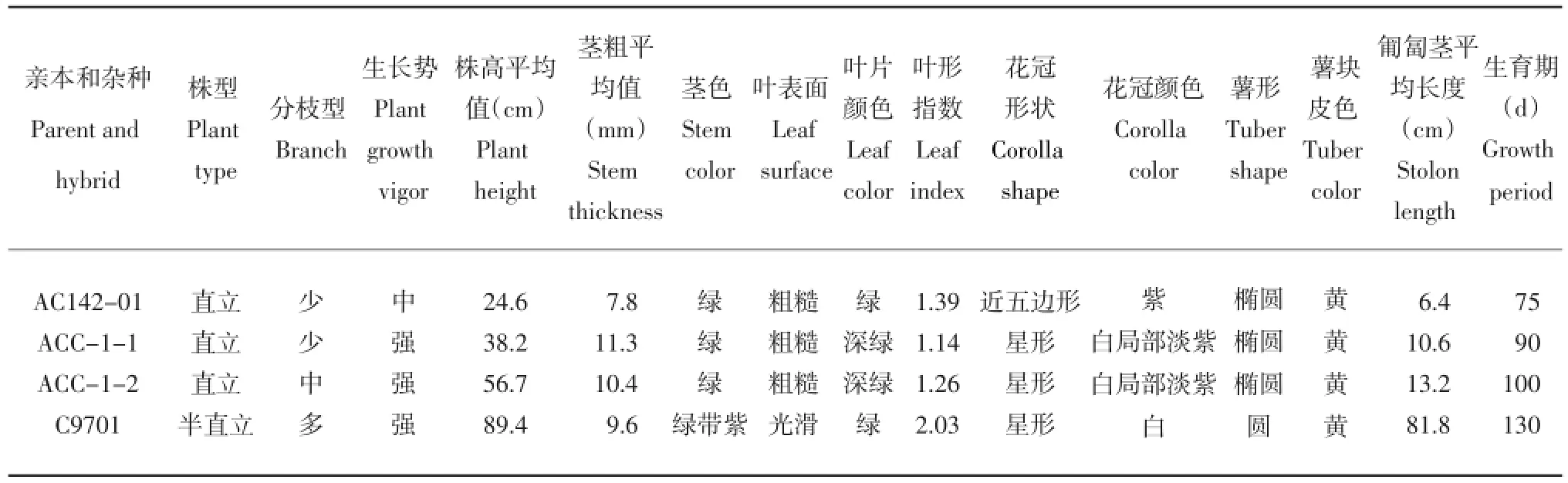
表3 体细胞杂种及亲本的形态学特征Table 3 Morphology of somatic hybrids and their parents
在植株生长期间,对杂种植株及其亲本部分植物学性状进行对比观察。结果表明,从整体看,两个体细胞杂种系的大部分性状介于融合亲本之间(表3),从生长势的角度讲杂种表现出较强的杂种优势。其株型直立(图6 A),叶片肥厚浓绿,茎秆粗壮,生长势强。叶形、花形、花色、株高、匍匐茎长度均表现为中间类型。两个杂种系的匍匐茎长度,虽长于栽培种亲本,但比野生种亲本匍匐茎短得多。两杂种间的大部分性状相似,但有少数性状有一定差异,如分枝数、株高、生育期等存在一定差异(表3,图6)。
2.6 青枯病抗性和低温糖化抗性鉴定
2.6.1 青枯病抗性鉴定
试验以融合亲本、体细胞杂种及两个对照系先后进行了3次青枯病抗性鉴定。结果表明,感病亲本AC142-01和感病对照8#表现为高度感病,植株全部萎蔫。抗病亲本C9701和抗病对照3C28-1表现为抗病。体细胞杂种ACC-1-1较多叶片萎蔫,但其感病程度低于感病亲本。体细胞杂种ACC-1-2表现为抗病,其抗病程度高于抗病亲本和抗病对照(表4,图7)。
2.6.2 杂种块茎抗低温糖化能力鉴定
将收获后的亲本AC142-01及体细胞杂种的块茎,分别在4℃和20℃贮藏,在0 d、15 d及30 d后进行油炸加工品质鉴定(图8)。结果表明,随着贮藏时间的延长,无论是20℃贮藏还是4℃贮藏,其油炸薯片的色泽与0 d对比均有加深,但4℃贮藏条件下的加深程度要比20℃严重。但从图8可以看出,两个体细胞杂种与抗低温糖化对照AC142-01相比没有显著差异。

图6 体细胞杂种和亲本的植株性状Figure 6 Plant characteristics of somatic hybrids and parents

表4 青枯菌生理小种1号菌株接种体细胞杂种及其亲本21 d后的植株发病情况Table 4 Disease indices and disease incidence recorded 21 d after root inoculation by race 1 of R.solanacearum
在油炸鉴定的同时,相同贮藏时间样品进行还原糖含量分析。结果显示,块茎中还原糖含量的变化趋势与薯片色泽的变化趋势基本一致(图9)。20℃贮藏期间,块茎还原糖含量无明显变化,均低于0.5 mg∕g FW。4℃贮藏30 d时,亲本C9701的块茎还原糖含量呈显著上升的趋势,达到了4.97± 0.08 mg∕g FW。
另外3个基因型块茎还原糖含量也随着低温贮藏时间的增加而上升,亲本AC142-01上升速度较缓慢,在整个低温贮藏期间均小于3.0 mg∕g FW。杂种株系ACC-1-1、ACC-1-2在4℃贮藏30 d后,还原糖含量分别为3.40±0.01 mg∕g FW和4.00± 0.04 mg∕g FW。尽管杂种块茎还原糖含量高于亲本AC142-01,但仍然在油炸加工的指标范围内。

图7 体细胞杂种接种21 d后的发病情况Figure 7 Plant morphology of somatic hybrids and their parents 21 d after root inoculation by race 1 of R.solanacearum

图8 油炸薯片颜色Figure 8 Potato chip color
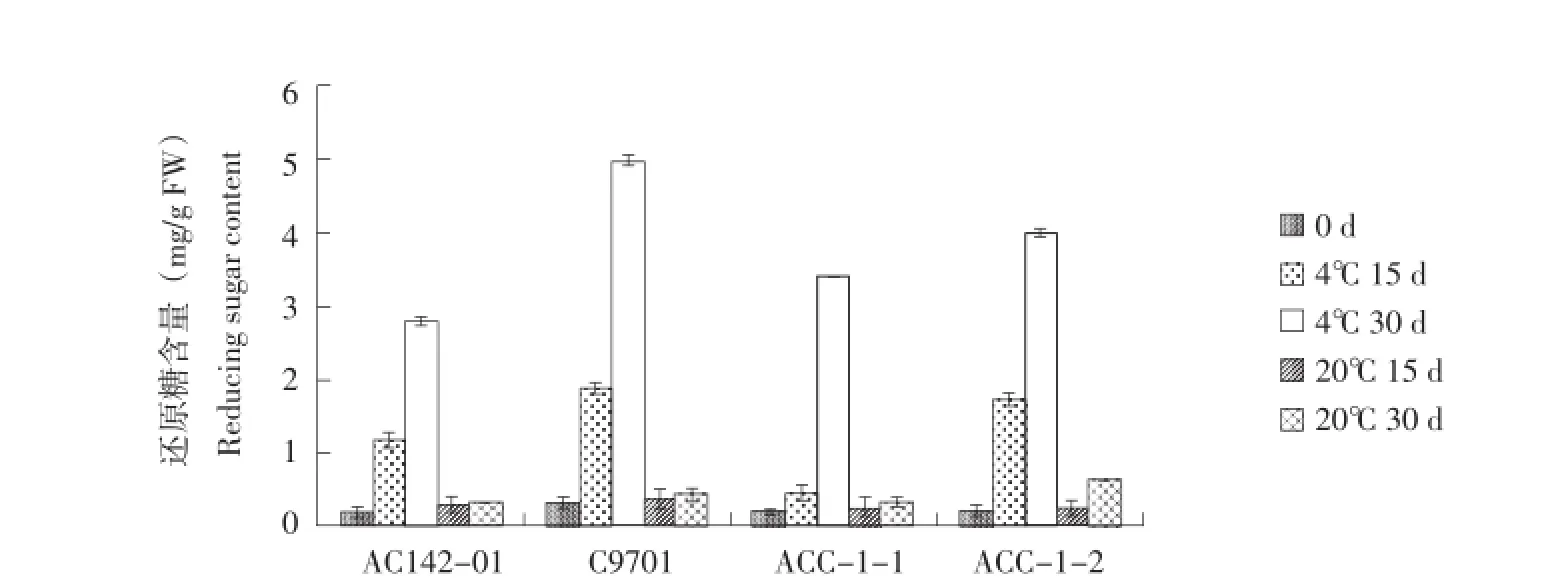
图9 马铃薯块茎还原糖Figure 9 Reducing sugar content of potato tubers
3 讨论
利用原生质体融合技术将野生种或近缘栽培种的优良性状导入栽培种,已成为马铃薯资源创制的重要途径之一[16,17]。然而,由于受培养反应的限制,一般均选择一个原生质体培养相对容易的基因型和一个具有目标性状的基因型进行融合,获得具有单个目标性状的杂种。本研究采用抗低温糖化的二倍体栽培种系AC142-01和抗青枯病野生种C9701通过原生质体融合,以期获得既抗青枯病同时又具有低温糖化抗性的体细胞杂种。前期获得的两个体细胞杂种目标性状鉴定结果表明,杂种ACC-1-2同时整合了双亲的目标性状,ACC-1-1具有较好的抗低温糖化能力,但青枯病抗性只有一定改善。尽管如此,本研究仍然可以说明,通过原生质体融合获得双目标性状的杂种是可能的。从理论上讲,原生质体融合的每个杂种均应含有融合双亲的全部遗传信息,但本研究涉及的两个来自于同一愈伤组织的杂种,其青枯病抗性和抗低温糖化水平均存在差异,表明在融合中发生了遗传信息的丢失,前人的相关研究也认为,体细胞杂种的抗性降低或丧失与来源于亲本的某些染色体片段的丢失或者缺失有关[18]。Chen等[10]通过SSR分析体细胞杂种的遗传组分显示,尽管是对称融合杂种,但同一组合的所有体细胞杂种均不同程度地发生了双亲遗传信息的丢失。
原生质体融合再生的体细胞杂种的染色体数目偏离双亲染色体数目之和的现象在马铃薯上普遍存在[19-21]。超倍性植株产生的原因可能是体细胞融合过程中并非是一对一的细胞发生融合,而是三个或多个细胞的融合,进一步发育成植株的原因[22]。本研究获得的杂种ACC-1-1与ACC-1-2从同一愈伤组织发育而来,但它们却具有不同的倍性水平,说明该愈伤组织可能并不是由单个融合细胞发育形成,而是由不同倍性的细胞形成的嵌合愈伤组织。
体细胞杂种的染色体组成较为复杂,使减数分裂出现染色体配对异常、染色体不分离或染色体不均等,从而使杂种的育性降低甚至完全败育[23]。经观察,本研究的两个体细胞杂种减数分裂过程中有较高频率的多价体、落后染色体等异常现象,形成了大量皱缩的、大小不同的花粉粒,花粉活力较低,表明他们要进行进一步利用还需要进一步改良。
很多报道显示,体细胞杂种总有一些表现为生长势弱的现象,认为是双亲亲缘关系较远导致遗传不平衡所致[10]。本研究的两个体细胞杂种则表现出生长势强的正杂种优势,表明体细胞杂种可能与有性杂种相似也具有杂种优势。
[1]Peloquin S J,Yerk G L,Werner J E,et al.Potato breeding with haploids and 2n gametes[J].Genome,1989,31:1000-1004.
[2]Johnston S A,den Nijs T P M,Peloquin S J,et al.The significance of genic balance to endosperm development in interspecific crosses[J].Theor Appl Genet,1980,57:5-9.
[3]Puite K L,Roest S,Pijnacker L P.Somatic hybrid plants after electrofusion of diploid Solanum tuberosum and Solanum phureja [J].Plant Cell Reports,1986,5:262-265.
[4]Yamada T,Hosaka K,Kaide N,et al.Nuclear genome constitution and other characteristics of somatic hybrids between dihaploid Solanum acaule and tetraploid Solanum tuberosum[J].Euphytica, 1998,102:239-246.
[5]Fock I,Collonnier C,Luisetti J,et al.Use of Solanum stenotomum for introduction of resistance to bacterial wilt in somatic hybrids of potato[J].Plant Physiology and Biochemistry,2001,39:899-908.
[6]Laurila J,Metzler M,Ishimaru C,et al.Infection of plant material derived from Solanum acaule with Clavibacter michiganensis ssp. sepedonicus:Temperature as a determining factor in immunity of S.acaule to bacterial ring rot[J].Plant Pathology,2003,52: 496-504.
[7]Oumèma N E,Radhia G B,Darasinh S,et al.Production of potato intraspecific somatic hybrids with improved tolerance to PVY and Pythium aphanidermatum[J].Journal of Plant Physiology,2006, 63:1321-1332.
[8]雷婷.马铃薯青枯病抗性资源筛选与原生质体融合创制新种质[D].武汉:华中农业大学,2011.
[9]Ghislain M,Rodriguez F,Villamon F,et al.Establishment of microsatellite assays for potato genetic identification[C].CIP Program report 1999-2000,1999,167-174.
[10]Chen L,Guo X P,Xie C H,et al.Nuclear and cytoplasmic genome components of Solanum tuberosum+S.chacoense somatic hybrids and three SSR alleles related to bacterial wilt resistance[J]. Theor Appl Genet,2013,126:1861-1872.
[11]叶文宣.体细胞杂种的染色体组成鉴定和农艺性状调查[D].武汉:华中农业大学,2013.
[12]郭鲜蒲.马铃薯体细胞杂种及其回交后代的遗传稳定性分析[D].武汉:华中农业大学,2011.
[13]蔡兴奎.原生质体融合创造抗青枯病的马铃薯新种质及其遗传分析[D].武汉:华中农业大学,2003.
[14]梁远发,何礼远,冯兰香,等.马铃薯抗青枯病转基因植株抗性鉴定[C].中国马铃薯学术研讨会与第五届世界马铃薯大会论文集,2004.
[15]欧庸彬.马铃薯液泡酸性转化酶基因的表达调控机制研究[D].武汉:华中农业大学,2013.
[16]Kim H,Chae M,Choi S,et al.Identification of somatic hybrids produced by protoplast fusion between Solanum commersonii and S.tuberosum haploid[J].Korean J Plant Tissue Cult,1993,20: 337-344.
[17]Laferriere L,Helgeson J,Allen C.Fertile Solanum tuberosum+S. commersonii somatic hybrids as sources of resistance to bacterial wilt caused by Ralstonia solanacearum[J].Theor Appl Genet, 1999,98:1272-1278.
[18]Polgar Z,Wielgus S M,Horvath S,et al.DNA analysis of potato+ Solanum brevidens somatic hybrid lines[J].Euphytica,1999,105: 103-107.
[19]Austin S,Ehlenfeldt M K,Baer M A,et al.Somatic hybrids produced by protoplast fusion between S.tuberosum and S. brevidens:phenotypic variation under field conditions[J].Theor Appl Genet,1986,71:682-690.
[20]Uijtewaal B A,Suurs L C J M,Jacobsen E.Protoplast fusion of momohaploid(2 n=x=12)potato clones:indentification of somatic hybrids using malate dehydrogenase as biochemical marker[J]. Plant Science,1987,51:277-284.
[21]Fish N,Karp A,Jones M G K.Production of somatic hybrids by electrofusion in Solanum[J].TheorApplGenet,1988,76:260-266.
[22]Waara S,Wallin A,Eriksson T.Production and analysis of intraspecific somatic hybrids of potato(Solanum tuberosum L.)[J]. Plant Science,1991,75:107-115.
[23]Singh R N.Chromosomal abnormalities and fertility in induced autotetraploid Helianthus annuus in the C1 and C2 generations[J]. Cytologia,1992,57:277-281.
Assessment of Potato Somatic Hybrids with Resistances to Bacterial Wilt and Cold-induced Sweetening
LI Qiong,WANG Haibo,CAI Xingkui,LEI Ting,LIU Jun*
(College of Life Science and Technology/Key Laboratory of Horticultural Plant Biology(HAU),Ministry of Education/National Center for Vegetable Improvement(Central China),Huazhong Agricultural University,Wuhan,Hubei 430070,China)
Two potato clones ACC-1-1 and ACC-1-2,derived from the protoplast fusion of diploid Solanum tuberosum AC142-01(2n=2x=24)and an S.chacoense clone C9701(2n=2x=24),were identified as somatic hybrids.ACC-1-1 proved tobeamixoploidandACC-1-2beanoctoploidbylowcytometeranalysisandchromosomecounting.Thesetwohybridscould bloom,but a high frequency of abnormal meiosis of the pollen mother cells was observed in each phase of the pollen development,which might be the reason for a lower pollen vitality.The results also demonstrated thatACC-1-2 exhibited high resistance to bacterial wilt and ACC-1-1 performed a moderate resistance in addition to that they were both resistant to cold-induced sweetening of the tubers,strongly suggesting that protoplast fusion,combined with suitable selection,could stackelitetraitsoftwogeneticdistantparentswhicharesexuallyincompatible.
potato;somatic hybrid;bacterial wilt;cold-induced sweetening
S532
A
1672-3635(2013)06-0321-10
2013-10-25
国家公益性农业科研专项(201303007),国家“863”计划(2006AA100107、2002AA207011)和IRT13065资助。
李琼(1987-),女,硕士研究生,研究方向为马铃薯生物技术育种。
柳俊,教授,研究方向为马铃薯生物技术育种,E-mail:liujun@mail.hzau.edu.cn。

