大花萱草扩繁技术研究及管理
田野 李毅
(甘肃农业大学,甘肃 兰州 730070)
0 前言
1)大花萱草无性繁殖技术研究状况
(1)大花萱草简介
大花萱草根分为肉质根和须根,肉质根呈纺锤状,须根多生长在肉质根上。具短根状茎,叶翠绿狭长,基生呈带状排成两列。花苔从中部抽出,螺旋状聚伞花序,每个花絮可着花数十朵。花蕾似簪,开如漏斗,裂片翻卷,为百合形花冠,花瓣先端裂开。花被基部合生呈筒状,雄蕊6枚,3长3短,花药呈丁字形背着在花丝顶端,除蓝色和纯白色以外其余花色均有栽培品种。花径变化大,花形各异,花期从晚春一直到秋季。大多数品种的花只开一天,但盛花期可以延续几周甚至几个月,有些品种单花寿命可超过24小时。蒴果,黑褐色、多棱形、有光泽,自然结实率低,但大部分品种不结实。
大花萱草抗旱能力强,耐高温,抗低寒,适应温度范围广,在我国从南到北均可种植。抗病性强,对土壤的适应性广,除过酸、过碱、过沙、过粘的土壤外一般都能栽培,PH值以6.5至7.5之间为好。
该类花卉对碱性土具有特别的耐性,是油田及滩涂地带不可多得的绿化材料。可用来布置各式花坛、马路隔离带、疏林草坡等。亦可利用其矮生特性做地被植物。其中有数个品种为“冬青”型,种植在南国,可四季常绿,是优秀的园林绿地花卉。
(2)繁殖方法
分株分割萱草丛块是最常用的繁殖方法。该方法操作简单,植株容易存活,长势比较一致。分株可将母株丛全部挖出,重新分栽;或者是由母株丛一侧挖出一部分植株做种苗,留下的继续生长。
分株多在春季萌芽前或秋季落叶后进行。春季分株移栽,当年即可抽苔开花;秋季分株移栽,翌年才能抽苔开花。移栽时应选用生长旺盛、花蕾多、品质好、无病虫害的植株。
分株时挖取株丛的一部分分蘖作为种苗,挖取部分要带根,从短缩茎处割开,将老根、朽根和病根剪除,尽量保留肉质根,适当剪短(约留10厘米)后即可栽植。栽植应选在晴天进行,边挖苗,边分苗,边栽苗,尽量少伤根,这样缓苗快。一般2-3年分株一次,以保证植株旺盛的生长势。
组培用幼嫩叶片、花丝和花苔等器官培养成植株。方法是先诱导幼嫩器官产生愈伤组织,然后用适当培养基在适宜的温湿光气等条件下培养成幼小植株。再将小苗假植于营养钵,经一段时间培养成植株幼苗,之后定植。但这种方法还没有被广泛接受。
植物的组织培养是利用无性生殖原理,使植物组织在人工控制的条件下,通过细胞的增殖和分化,快速发育成新植株的高新技术手段。近年来,随着科学技术的迅猛发展,植物组织培养技术已进入生产应用阶段。利用这种技术,可以将植物的茎尖、叶片、茎段等切成小片,或用花药、花粉等在无菌条件下,在玻璃器皿中人工配制的培养基上培养,使它们发育成完整的植物体。利用植物组织培养的方法,只需要用少量植物材料,就可以在短期内诱导出大量“试管苗”。
这种方法不仅繁殖速度快,受季节影响小,而且诱导变异也比较容易,为科研和生产带来了很大方便。此外,由于植物的生长点细胞分裂速度快,很少感染病毒。因此,采用茎尖培养还可以有效地脱去病毒,从而获得更加健壮的植株。植物基因工程技术的发展也借助了植物组织培养技术。培养中的植物组织或细胞为外源基因的导入提供了便利;转基因植物的实验室筛选和大量繁殖也离不开植物的组织培养。由于植物的组织培养技术科技含量高,繁殖速度快,在农林业生产中已获得广泛应用。
2)研究的目的与意义
随着社会经济的发展,物质文化生活水平的提高,我国城乡园林绿化得到了飞速发展,这对美化生活、减少环境污染、改善生态环境起到了很大的促进作用,但是,我们也应该充分认识到目前我国城市绿地建设中已存在不少问题,城市园林植物种类较为单一,城市生物多样性建设受到影响,特别是地被植物材料严重匮乏,导致了草坪面积发展过大、用水量过多、养护费用居高不下等问题,影响了城乡建设持续性发展。各级政府和组织对植物的种类和品质提出了更高的要求,迫切要求引进能部分代替草坪、抗旱节水、管理费用低和观赏性强的优质地被植物,以丰富城市园林景观,丰富生物多样性,建设更接近自然的生态型城市。宿根花卉-大花萱草因其观赏期长、观赏性高、适用性强、种类丰富、群体功能强等优点日益受到人们的重视,因而大花萱草的研究和利用面临着一个良好的机遇和发展前景。
大花萱草(Hemerocallis hybrida),为百合科萱草属多年生宿根草本植物。萱草属植物全世界共约有15~18个种(中国科学院中国植物志编辑委员会,1980),主要分布于亚洲温带至亚热带地区,欧洲有少量分布,其中原产我国的就约有11种(北京林业大学园林系花卉教研组,1988),是世界上萱草属植物种类最多、分布最广的国家。大花萱草主要用途是观赏,因其具有既可观花又可观叶的双重价值而广泛用于切花、盆栽及园林绿化等。萱草花蕾可食用,根可入药,集观赏、食用、药用于一身,是极为可贵的植物资源。
3)植物细胞全能性的表达
早在20世纪初,德国著名植物学家Haberlandt根据细胞学的理论就曾预言,植物细胞具有全能性(Totipotency)。也就是说每个体细胞像胚胎细胞一样,可以经过体外培养成为一个完整的植株,这是因为植物体的每个细胞都含有该个体的全部遗传信息,都具有一套完整的基因组,因而具有在适宜条件下可以被诱导分化形成完整植株的潜在能力。直至20世纪50年代末科学家在胡萝卜组织单细胞悬浮培养中发现某些细胞在形态上转变为与合子胚相似的结构,其发育过程也与合子胚类似,但由于它是从体细胞分化而来的因而称之为体细胞胚,并由此形成了再生植株,直到开花结实。这一重大突破不仅证实了植物细胞的全能性,而且为细胞离体培养中研究形态发生机制开拓了一个新的领域。近20余年,植物组织和细胞培养技术得到了迅速发展,大量植物无论是二倍体细胞或单倍体性细胞以及原生质体离体培养均可获得再生植株。大量事实证明,植物体成熟组织中已高度分化的细胞液保留了回复到分生组织状态的能力[6]。当然,细胞能够经历这一回复过程的程度是不同的,这主要取决于细胞所达到的发育上的、生理上的和细胞上的状态。
4)形态发生
所谓形态发生就是生物个体发育或再生过程中,机体及其器官形态结构的形成过程。在生物学领域内已经成为一门学科,而且深入到组织和细胞的形态发生问题。它不用于形态学、生理学和胚胎学,而是在应用这些学科知识的基础上,结合生物化学、生理物理学和遗传学的知识和技术、专门研究形态发生中有关分化、对称、极性和相关性等现象的外界条件因子、内在生理化学及遗传基础,从而了解其机制,已达到控制目的的一门学科。植物组织或细胞离体培养中的形态发生有器官发生和体细胞胚胎发生这俩种途径形成再生植株。这两种形态发生途径都是以细胞分化为基础的,它包含了组织和器官的形成。已分化的细胞各自组成了不同的组织,一般形态和技能相同的细胞组成同一种组织,然后再由机能相关的组织形成器官。形态发生的最后结果是形成以个发育成熟的发育植株。
1 材料与方法
1.1 材料:供试大花萱草植株
1.1.1 试剂
乙醇。
吲哚乙酸(IAA)或 2,4-D(生长素类似物)。
氯化汞(升汞)或次氯酸钠。
6-苄基氨基腺嘌呤(6-BA)
MS培养基
0.1 mol/L NaOH与0.1mol/L HCl
1.1.2 仪器设备
培养室,高压灭菌锅,水浴锅,解剖刀,三角烧瓶(100mL),烧杯,量筒,培养皿,棉线,接种箱或超净工作台,分析天平,长镊子,剪刀,容量瓶,移液管,牛皮纸。
1.2 分株繁殖
分株苗床,宽1-2m,长2-3m,每隔20cm,挖一深约6cm穴。将分蘖苗移植其中,之后覆土,分株苗处理。在萌芽前,将株丛从盆中挖出,去掉伤根、病根,尽量保留肉质根。栽植应选择晴天进行,边挖边分栽,尽量少伤根,一般2-3年分株一次,以保证植株旺盛生长。本实验以10盆为一组,先设计重复。
1.3 组织培养扩大繁殖
植物组织培养的简单过程如下:剪接植物器官或组织——经过脱分化(也叫去分化)形成愈伤组织——再经过再分化形成组织或器官——经过培养发育成一颗完整的植株。
植物组织培养的大致过程是:在无菌条件下,将植物器官或组织(如芽、茎尖、根尖或花药)的一部分切下来,放在适当的人工培养基上进行培养,这些器官或组织就会进行细胞分裂,形成新的组织。不过这种组织没有发生分化,只是一团薄壁细胞,叫做愈伤组织。再适合的光照、温度和一定的营养物质与激素等条件下,愈伤组织便开始分化,产生出植物的各种器官和组织,进而发育成一棵完整的植株。
植物组织培养即植物无菌培养技术,是根据植物细胞具有全能性的理论,利用植物体离体的器官如根、茎、叶、茎尖、花、果实等)组织(如形成层、表皮、皮层、髓部细胞、胚乳等)或细胞(如大孢子、小孢子、体细胞等)以及原生质体,在无菌和适宜的人工培养基及光照、温度等人工条件下,能诱导出愈伤组织、不定芽、不定根,最后形成完整的植株的学科。
1.3.1 配制培养基
配制MS培养基母液和NAA、6-BA等激素母液,比例为大量元素100mL/L,微量元素 10mL/L,有机物 10mL/L,无机盐 10mL/L,NAA0.01mL/L,6-BA4mg/L,琼脂 7.5mg/L,蔗糖 30mg/L,调 pH 值 5.6~5.8,放在三角瓶中,每瓶大致40mL,高压灭菌锅中灭菌,备用。
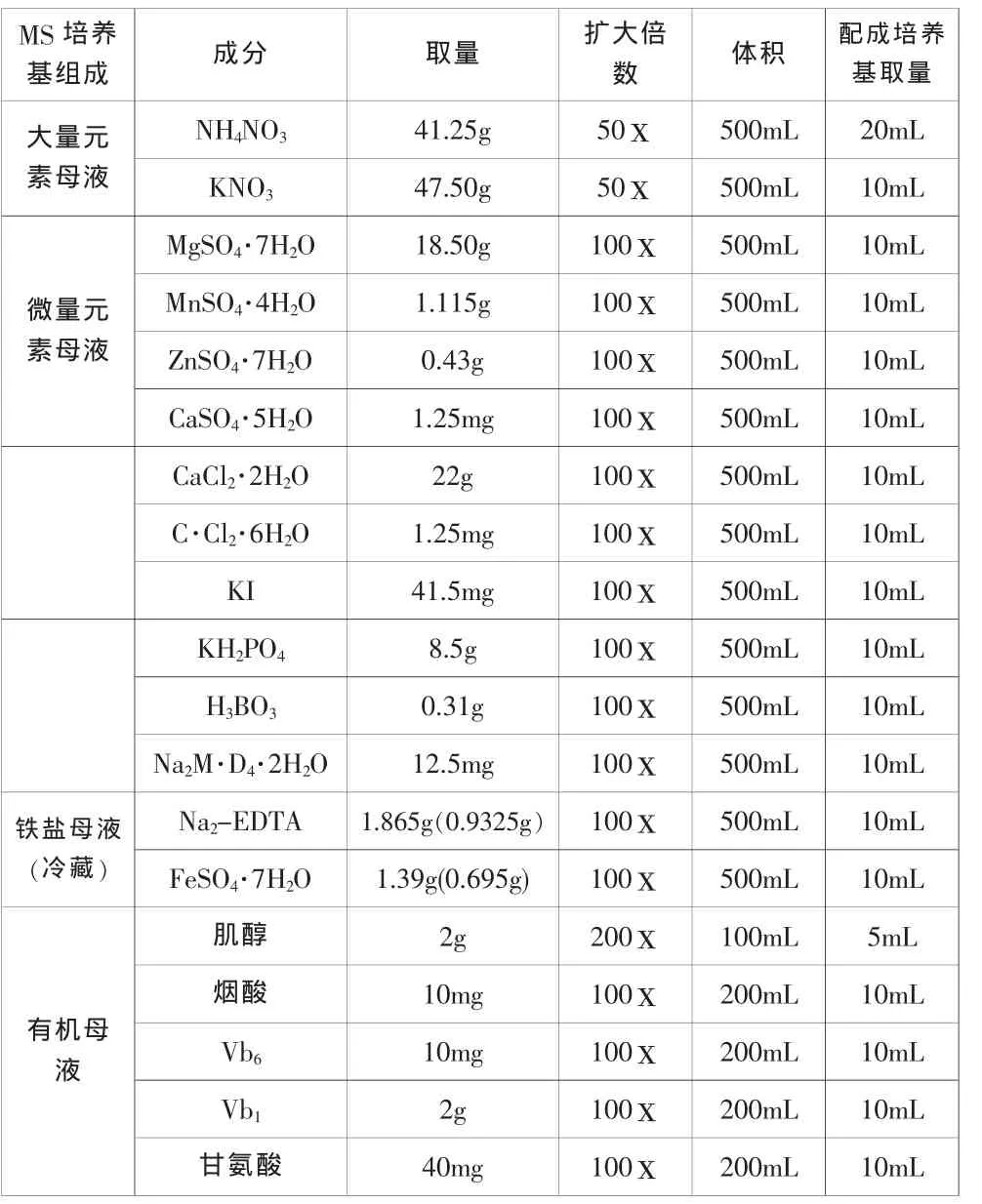
表1 配置MS培养基所需试验材料及配置方法
培养基分类:
(1)愈伤组织诱导培养基:MS培养基(蔗糖含量为 10g/L,2,4-D含量为 2mg/L,琼脂10g/L)。
(2)试验培养基:在 MS培养基中加入 IAA和 6-BA。
吲哚乙酸(IAA)先用少量0.1 mol/L NaOH溶解,6-苄基氨基腺嘌呤先用少量0.1 mol/L HCl溶解,然后用蒸馏水稀释,再加入培养基中。
1.3.2 取材与消毒
取实验材料,用流水冲洗4-5次,用刀将茎外部切掉,并将茎切成小段,取每一段上带有1-2个芽点植株为外植体,再用蒸馏水冲洗,然后放到超净工作台上表面灭菌,流程为70%酒精20s-50mLNaF10min——无菌水冲洗3-5次,然后接种。
1.3.3 接种培养
将消毒过的萱草外植体在消过毒的滤纸上切成0.5cm大小方块,接种到培养基上,每瓶接种三个,接种过程中,所用器具应用75%酒精棉擦拭,酒精灯火焰上消毒。避免工具带菌,造成交叉感染,接种后将培养瓶移入培养箱上培养,温度控制在22度左右,每天光照12-16h,光照强度1000-2000lx,一般培养1-7d后,茎段边缘突起分化成芽。待10d后,继代培养。
1.3.4 初代培养
初代培养旨在获得无菌材料和无性繁殖系。即接种某些外植体后,最初的几代培养。初代培养时,常用诱导或分化培养基,即培养基中含有较多的细胞分裂素和少量的生长素。初代培养建立的无性繁殖系包括:茎梢、芽丛、胚状体和原球茎等。
采用外源的细胞分裂素,可促进使具有顶芽或没有腋芽的休眠侧芽启动生长,从而形成一个微型的多枝多芽的小灌木丛状的结构。在几个月内可以将这种丛生苗的一个枝条转接继代,重复芽苗增殖的培养,并且迅速获得多数的嫩茎。然后将一部分嫩茎转移到生根培养基上,就能得到可种植到土壤中去的完整小植株。
在培养中由外植体产生不定芽,通常首先要经脱分化过程,形成愈伤组织的细胞。然后,经再分化,即由这些分生组织形成器官原基,它在构成器官的纵轴上表现出单向的极性(这与胚状体不同)。多数情况下它形成芽,后形成根。
1.3.5 继代培养
在超净工作台上,将初代培养的芽丛分割,同时用解剖刀将植株底部褐化部分、新叶切除,以减少由于叶片生长而引起营养物质消耗,对芽分化的抑制从而促进芽的分化,达到实验目的同时统计每瓶中外植体分化芽的数目。实验以10瓶为一组,共计10个重复。
2 结果与分析
2.1 分株发芽率和组织培养繁殖率
2.1.1 每一母株分化芽数量统计表
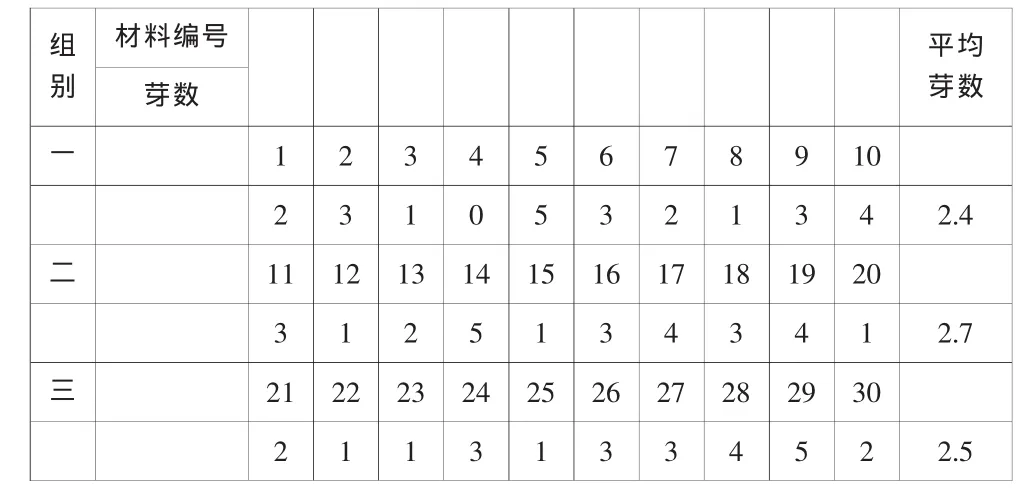
表2
2.1.2 组织培养数量统计表

表3
2.1.3 分株发芽率和组织培养繁殖率比较
分株繁殖一轮发芽率75.3%,繁殖率较高,组培三周左右繁殖率达5.33%。比较得知,组培较分株繁殖率高,而且时间短,可达到短期繁殖目的。
2.2 各因素对大花萱草扩繁的影响
在本实验中,曾出现污染现象,原因可能是:
2.2.1 实验仪器消毒未净
2.2.2 解剖刀钝,杀死组织或引起叶片卷曲
2.2.3 叶片生长接触三角瓶盖,引起植株感染
2.2.4 对外植体消毒时,未将组织病毒全部杀死
2.2.5 每次操作后对仪器灭菌不干净引起交叉感染

图1 组织培养Figure 1 Tissue culture
3 讨论
通过分析,规范操作技术,最终达到无污染,快速繁殖的结果,形成一整套快繁技术。
在结果中,认为分株和组培均可达到繁殖要求,但组培要求过高,实验仪器精密,需要专业人员操作,而且耗费太大。对于一些稀有品种或结实率不高的品种,可以采用组培达到目的,以保存物种;对于普通品种,分株即可达到扩繁目的。
通过实验,了解并掌握了如何快速准确的查找资料,提高了分析问题,解决问题的能力。经过对最初实验失败原因总结,对实验条件,实验过程有了全面的认识,为以后实验的顺利进行打下良好的基础。但由于掌握的知识有限,虽在实验的过程中不断发掘明确实验目的和方法,但试验仍有一些不足之处,希望在今后的实验中完善。
本实验中大花萱草培养的器官分化途径有三种情况:一是,在愈伤组织表面形成芽;二是,在愈伤组织内部形成根;三是,在同一块愈伤组织的内外分别形成根和芽。一般来说,先形成芽的经再培养较易形成根,种植容易成活;而先产生根的在培养45d后仍未见形成芽,至于继续培养下去能否在其上方分化出芽,还需要做进一步深索。
4 结语
通过组培可使大花萱草得到扩繁,快繁无病毒不变异苗木。在实验过程中一定要注意充分消毒,防止感染。组培中容易发生褐化、玻璃化现象。在操作时尽量采用不易变异的外植体扩繁,以缩短继代时间。限制继代次数。每隔一定继代次数后重新开始。切取外植体材料时,采取适当的生长调节物质种类和较低浓度,或少或不使用培养基中易引起变异的化学物质。定期配制,及时处理,跟踪检测,最终形成一套扩繁方法,指导大花萱草在北方地区引种生产及应用,从而使其在园林中更有用。
[1]施冰.大花萱草的引种及栽培试验[OL/D].中国优秀博硕士学位论文全文数据库:硕士,2004(04).
[2]杜娥.大花萱草品种评价及其种苗生产影响因素研究[D].山东农业大学,2006.
[3]李登绚,韩睿.黄花菜优良品种快速扩繁技术[J].北方园艺,2005(5).
[4]路博生,孙育锋,左军锋.黄花菜芽片繁殖技术[J].甘肃农业科技,2003(7).
[5]包满珠.花卉学[M].中国农业出版社,2007.
[6]王金刚.园林植物组织培养[M].东北农业大学出版社,06053.
[7]Boltenko,E.V;Labetskaya,NV;Lauve,L.S.;Zhuravlev,Yu.N.;IntroduetionofI.oxy Petala Bungein to invitroculture[J].Raslitel,nyeResursyZO00,36(1):67-70.
[8]Farquhar G D,Sharkey TD.Stomatal conductance and photosynthesis[J].Annu Rev Plant Physiol,1982(33):317-345.
[9]Munns R.Physiological processes limiting plant growth in saline soils:some dogmas and hypotheses[J].Plant Cell Environ,1993,16:15-24
[10]RiehardH.1981.Plant and Their Atoms Pherie Environment[M].New and London:Aeademie Fress,263-272.
[11]Wees,D.Stratifieation and Primingmayim Proveseed germination of Purplecone flower,Lueflagirisand evening Primrose.AetaHortieulturae[J].International Society for Horticult-Uraeience(ISHS),Leuven,Beigium,2004,629:391-395.
[12]Yabuya,.Buttetinof the Faeully of Agneulture MiyZaki University[J].1985,32(1):181-186.

