不同性别刺五加皂苷合成酶基因表达及其对皂苷含量的影响
邢朝斌,孟春燕,修乐山,劳凤云,庄鹏宇
(河北联合大学a.生命科学学院;b.公共卫生学院;c.药学院,河北 唐山 063000)
刺五加Eleutherococcus senticosus具有多种生理活性和药理作用,是我国医药珍品[1-3]。刺五加具有长、中、短3种不同长度花丝的类型,长花丝类型是雄性,短花丝类型是雌性,中花丝类型是两性的,属非常少见的单全异株性别系统[4]。不同性别的刺五加在形态结构[4-5]、遗传[5]和药用成分含量[6]上均存在一定的差异。其中催化药用成分生物合成的相关酶基因表达量的差异是形成不同性别药用植物中药用成分含量差异的关键[2,7]。
皂苷类化合物是刺五加的主要活性成分之一[1-2]。刺五加的皂苷类化合物的生物合成过程中,催化3-羟基-3-甲基戊二单酰辅酶A生成甲羟戊酸的3-羟基-3-甲基戊二酰CoA还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)[8]、催化甲羟戊酸焦磷酸与ATP进行反应生成异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)的甲羟戊酸焦磷酸脱羧酶(mevalonate diphosphate decarboxylase,MDD)[9]、催化 2个 IPP分子和1个二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate)分子生成法尼基二磷酸(farnesyl diphosphate)的法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPS)[10],三者为重要的限速酶。本文中通过实时定量PCR(quantitative real time PCR,qRT-PCR)法检测了不同性别类型刺五加中HMGR、MDD和FPS的表达情况,并分析了其与皂苷含量的相关性,旨在为阐明不同性别刺五加中皂苷含量差异的机理提供资料。
1 材料与方法
1.1 材 料
材料为采自吉林省梅河口市的3年生不同性别的野生刺五加。经鉴定为五加科植物刺五加E.senticosus。以生产中传统采用的采收时间[6](7月26日)的叶片为提取RNA和测定皂苷含量的试材。
1.2 试 剂
刺五加总皂苷含量测定中所用齐墩果酸对照品购自中国药品生物制品检定所(批号:110709-200505);石油醚、浓硫酸、甲醇、香兰素、乙醇均为国产分析纯;市售娃哈哈纯净水;植物总RNA提取试剂盒、RevertAidTM First strand cDNA synthesis Kit、SYBR Premix Ex TaqTM II购 自 宝生物工程(大连)有限公司;X-gal、IPTG、Taq DNA聚合酶、Puf DNA聚合酶、dNTPs、质粒小提试剂盒购自北京拜尔迪生物技术有限公司。PGM-T克隆试剂盒、琼脂糖凝胶DNA回收试剂盒和TOP-10感受态细胞购自天根生化科技(北京)有限公司。引物由生工生物工程(上海)股份有限公司合成,PAGE纯化。
1.3 刺五加cDNA的获得与引物验证
根据植物总RNA提取试剂盒和RevertAidTM First strand cDNA synthesis Kit的说明,分别提取3种性别类型刺五加5株样本的总RNA并逆转录为cDNA。
根据已克隆的刺五加HMGR(HQ456918)[8]、MDD(HQ456918)[9]、FPS(HQ456918)[10]和GAPDH(HQ184063)[11]基因的cDNA 序列,利用Primer premier 5.0软件设计real time PCR扩增的特异性引物。HMGR的上游引物为5'-GGATTGAAGGGCGAGGAAA-3',下游引物为5'-GCAACAGCAGAACCAGCAAG-3',预计扩增长度为136 bp;MDD的上游引物为5'-GATTGTGGGTATTGGGTTGGA-3',下游引物为5'-AATGTTGGTTGGCGTTTGAG-3',预计扩增长度为82 bp;FPS的上游引物为5'-TCTCTCCCTCTTTCCCTCCTCT-3',下游引物 为5'-ATCGCTCATTCTGGCTGGTT-3', 预计扩增长度为132 bp;GAPDH的上游引物为5'-GATTTGGCATTGTTGAGGG-3',下游引物为5'-TGCTATCGCCTATGAAGTCC-3',预计扩增长度为134 bp。以逆转录获得的cDNA为模板,利用Puf DNA聚合酶和上述引物进行PCR扩增,扩增产物克隆入PGM-T质粒载体,转化大肠杆菌TOP10后,送Invitrogen公司测序,测序结果与预期相符则为特异性强。
1.4 Real time PCR反应与数据的收集与分析
以逆转录获得的刺五加cDNA为模板,利用1.3中的引物进行PCR扩增,扩增产物经1.2%琼脂糖凝胶电泳后切胶回收,获得含高浓度目的基因的DNA溶液,以此溶液为标准品,10倍梯度稀释,共5个梯度,用于制作各基因的标准曲线。按照SYBR®Premix Ex TaqTM II说明的要求,应用ABI 7900 HT Real-time PCR system,利用384孔板进行real-time PCR分析。Real time PCR反应总体系10 μL,其中,不同性别类型刺五加的cDNA或回收获得的包含各目的基因的高浓度DNA模板1 μL,上、下游引物各0.3 μL,SYBR®Premix Ex TaqTM II 5 μL, ROX reverse(50×) 0.2 μL,ddH2O 3.2 μL。反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。之后进行溶解曲线分析,鉴定产物的特异性。溶解曲线分析温度为60~95 ℃,每1 ℃读1次,持续5 s,重复3次。
运用ABI 7900 HT Real-time PCR system自带的SDS 2.4软件进行数据收集,参照文献[12]和[13]中的方法,分别计算不同性别类型刺五加样本中HMGR、MDD和FPS基因的表达量。
1.5 刺五加总皂苷含量的测定与相关性分析
参照文献[12]中的方法分别测定不同性别类型刺五加样本在543 nm处吸光度,利用回归方程Y=118.35X+4.037 6,r=0.999 7(n= 5),计算其总皂苷的含量。根据总皂苷的含量,应用SPSS 17.0软件分析不同性别类型刺五加的总皂苷含量和HMGR、MDD和FPS基因表达量间的相关性。
2 结果与分析
2.1 引物特异性的验证
刺五加HMGR、MDD和FPS和GAPDH基因real-time PCR扩增的产物为单一条带,无引物二聚体,片段大小与预期相符(见图1)。各基因的溶解曲线仅具有单一的特异峰,也表明无引物二聚及非特异性扩增产物(见图2),扩增产物的测序结果表明,各基因的扩增结果与目的基因的对应片段完全相符,说明依据各基因cDNA序列设计的引物具有良好的特异性,建立了其较好的real-time PCR反应条件。

图1 刺五加HMGR、MDD、FPS和GAPDH基因realtime PCR产物电泳结果Fig.1 Real-time PCR products of HMGR, MDD, FPS and GAPDH in E. senticosus

图2 刺五加HMGR、MDD、FPS和GAPDH基因溶解曲线Fig.2 Dissociation curve of HMGR, MDD,FPS and GAPDH in E. senticosus
2.2 不同性别刺五加HMGR、MDD和FPS基因的表达分析
HMGR、MDD和FPS基因在长、中和短3种花丝类型刺五加中的表达量变化如图3所示。各基因在3种花丝类型刺五加中均有表达,且表达规律相似,HMGR、MDD和FPS基因的最高表达量均出现在短花丝类型刺五加中,中花丝类型的表达量次之,最低表达量均出现在长花丝类型刺五加中。所不同的是FPS基因在中花丝和短花丝类型刺五加中的表达量差异未达显著水平。HMGR、MDD和FPS的最高表达量分别为最低表达量的1.87、2.02和1.58倍。
2.3 不同性别刺五加的总皂苷含量
长、中和短3种花丝类型刺五加中均检测到了总皂苷的存在,但三者的含量差异显著(P<0.05),如图4所示。短花丝类型刺五加的总皂苷含量最大,为最小值(长花丝类型刺五加)的5.52倍,中花丝类型刺五加的总皂苷含量介于两者之间,为长花丝类型刺五加含量的2.75倍。

图3 不同性别刺五加HMGR、MDD和FPS基因的表达分析Fig.3 Expression analysis of HMGR, MDD and FPS in different gender types of E. senticosus
2.4 HMGR、MDD、FPS基因的表达和刺五加总皂苷含量的相关性
HMGR、MDD、FPS基因的表达与刺五加中总皂苷含量的相关性分析结果见表1。结果表明,HMGR、MDD和FPS基因的表达量与皂苷含量同升同降,具有显著的正相关关系(P<0.05)。HMGR、MDD和FPS基因的表达量间也存在显著的正相关关系(P<0.05)。
3 结论与讨论
三萜皂苷类化合物为刺五加的次生代谢产物,次生代谢产物是植物长期进化中适应环境的产物,抵抗环境胁迫是其重要的生态学功能之一[14]。对于雌雄异株植物而言,其不同性别类型个体对环境胁迫的适应也是不同的,雌性个体通常对环境胁迫的耐受能力低于雄性个体[15],从而形成积累较多的次生代谢产物以提高其抵抗外界坏境胁迫水平的现象。如穿龙薯蓣雌株中的薯蓣皂苷含量显著高于雄株中的含量。已有的研究[4]和本试验中的结果均表明,刺五加雌株的皂苷含量显著高于雄株中的含量,这与上述观点是完全相符的。
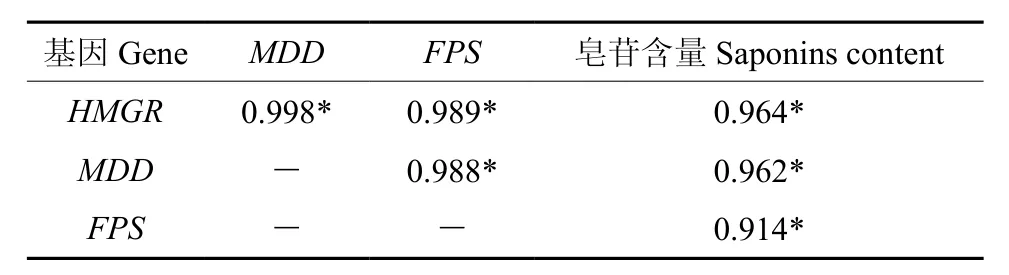
表1 HMGR、MDD、FPS基因的表达和刺五加总皂苷含量的相关性Table 1 Correlation of HMGR, MDD and FPS genes expression and saponins content in E. senticosus
药用植物次生代谢产物的含量由催化其生物合成的酶基因的表达量决定[16]。HMGR、MDD和FPS基因是催化皂苷类化合物生物合成限速酶基因,HMGR基因的超表达可使黄花蒿中的萜类化合物含量提高22.5%[17],MDD基因的表达高峰[9]与刺五加皂苷合成的高峰[6]基本吻合,人参FPS基因的高表达可提高人参皂苷的含量。本研究中,刺五加的HMGR、MDD和FPS基因的最高表达量和皂苷含量的最大值均出现在短花丝类型刺五加中,中花丝类型的次之,长花丝类型的最低。不同性别类型刺五加中HMGR、MDD和FPS基因的表达与皂苷含量间同升同降,HMGR、MDD和FPS的表达量和皂苷含量间存在显著正相关关系,说明HMGR、MDD和FPS基因是形成不同性别刺五加中皂苷含量差别的关键酶基因。
参考文献:
[1]涂正伟,周渭渭,单 淇,等. 刺五加的研究进展[J]. 药物评价研究,2011,34(3):213-216.
[2]邢朝斌,龙月红,劳凤云,等. 刺五加鲨烯合酶基因的表达及其对皂苷含量的影响[J]. 经济林研究,2013,31(1):25-29.
[3]李 宏,吴东亮,吴乾隆,等.基于植物区系分析的雾灵山自然保护区种子植物解说对象研究[J].中南林业科技大学学报,2011,31(8):119-124,129.
[4]刘林德, 田国伟. 刺五加花的形态学及雄蕊异长现象的观察[J]. 植物分类学报,1997,35(1):1-6.
[5]王秀华, 姬兰柱, 高瑞馨, 等. 刺五加的形态解剖与遗传分化的初步研究[J]. 东北林业大学学报,2001,29(2):72-74.
[6]孟祥才, 颜丙鹏, 孙 晖, 等. 不同性别类型刺五加叶有效成分含量季节积累规律研究[J]. 时珍国医国药,2011,22(1):88-90.
[7]许若娴,曹福祥,彭继庆,等.云南萝芙木异胡豆苷合成酶基因的克隆与分析[J].中南林业科技大学学报,2012,32(6):128-131.
[8]邢朝斌, 吴 鹏, 龙月红, 等. 刺五加HMGR基因的克隆与表达分析[J]. 江苏农业学报,2012,28(6):1258-1262.
[9]邢朝斌, 龙月红, 何 闪, 等. 刺五加甲羟戊酸焦磷酸脱羧酶基因的克隆与表达分析[J]. 西北植物学报,2012,32(10):1950-1956.
[10]邢朝斌, 龙月红, 何 闪, 等. 刺五加法尼基焦磷酸合酶基因的克隆、生物信息学及表达分析[J]. 中国中药杂志,2012,37(12): 1725-1730.
[11]邢朝斌, 吴 鹏, 陈 龙, 等. 刺五加GAPDH基因的克隆及序列分析[J]. 中草药,2012,43(1):155-158.
[12]邢朝斌, 龙月红, 劳凤云, 等. 内生真菌对刺五加皂苷合成关键酶基因表达及皂苷含量的影响[J]. 中国中药杂志,2012,37(14):2041-2045.
[13]戴 超,刘雪梅,周 菲. 白桦基因表达半定量RT-PCR中内参基因的选择[J]. 经济林研究,2011,29(1):34-39.
[14]黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成[J]. 中国中药杂志,2007,32(4):277-280.
[15]胥 晓, 杨 帆, 尹春英, 等. 雌雄异株植物对环境胁迫响应的性别差异研究进展[J]. 应用生态学报,2007,18(11):2626-2631.
[16]杨生超, 赵昶灵, 文国松, 等. 植物药材道地性的分子机制研究与应用[J]. 中草药,2007,38(11):1738-1741.
[17]Aquil S, Husaini A M, Abdin M Z,et al.Overexpression of the HMG-CoA reductase gene leads to enhanced artemisinin biosynthesis in transgenicArtemisia annuaplants[J]. Planta Med,2009, 75(13):1453-1458.

