山核桃EST-SSR引物的筛选及通用性分析
黄少勇,张智俊,罗淑萍,李 疆
(1.新疆农业大学,新疆 乌鲁木齐 830052;2.浙江农林大学 亚热带森林培育国家重点实验室培养基地,浙江 临安 311300)
山核桃Carya cathayensisSarg. 为胡桃科Juglandaceae,山核桃属CaryaNutt.,是中国特有的一种木本油料和干果树种,其种下无品种[1],山核桃属植物适应能力强、用途多,含油率高,果品营养丰富、有很好的医疗保健作用,是重要的木本油料树种和干果树种,也是珍贵的用材树种,在中国广为种植[2]。同时,山核桃树体高大,枝叶繁茂,根系发达,固土力强,是经国家林业局认定的经济和生态兼用型树种[3]。山核桃属植物在我国主要有5个种,浙江山核桃C. cathayensisSarg是浙江省的主要经济林树种之一[4]。近年来,人们生活水平不断提高,对山核桃的需求量不断上升。我国是山核桃原产地,栽培历史悠久,但其相关研究报道尤其在分子水平上的研究报道甚少。为了更好地开发利用山核桃资源,获得更高的经济效益,非常有必要对其进行相关的遗传学研究。目前,针对山核桃的研究较多采用以下几种分子标记技术:扩增片段长度多态性(ampli fied fragment length polymorphism,AFLP)[5-6],随机扩增多态DNA(random ampli fied polymorphic DNA,RAPD)[7-8],微卫星间隔片段多态性(inter-simple sequence repeat,ISSR)[9],序列相关扩增多态性(sequence-related ampli fied polymorphism,SRAP)[4]。但是对山核桃进行相关的EST-SSR研究的报道较为鲜见,仅有宋双等[10]基于山核桃脂肪代谢相关cDNA文库设计了34对引物,并对天然群体山核桃40个样品进行了初步的应用性试验,但是该研究需要构建cDNA文库。本试验中从NCBI上搜寻核桃的EST序列,根据这些序列进行引物设计,既避免了构建cDNA文库的麻烦,又获得较好的扩增效果。简单重复序列(simple sequence repeat, SSR)又称为微卫星序列,是指以少数几个核苷酸为单位多次串联重复的DNA序列[11]。SSR又可分为基因组SSR和ESTSSR,表达序列标签微卫星(EST-SSR)是一种基于EST的简单重复序列设计的一种新型分子标记,尽管不同植物开发的EST序列中SSR分布的频率差异较大,但其中2%~5%序列中均含有SSR,随着生物学技术的发展和试验成本的降低,公共数据库EST数量的急速增加,为植物EST-SSR的开发提供了丰富的极有价值的可利用资源[12]。由于EST来源于编码cDNA,通常其序列保守性程度较高,已有很多研究表明EST标记在家族和种属间的通用性较高[13]。故本研究中拟通过核桃属的EST序列设计引物,对山核桃进行多态性研究,检验及筛选引物,以期为山核桃种质资源评价开发更好更有效的引物,为后期的杂交育种亲本的选配、遗传图谱构建等工作提供资料。
1 材料与方法
1.1 材 料
本研究中采用的24份山核桃样品采自浙江省临安市,27份核桃样品采自新疆鄯善县。
1.2 方 法
1.2.1 引物设计
目前,在NCBI(http://www.ncbi.nlm.nih.gov/genomes/PLANTS/PlantList)网站上可搜寻到5 213条核桃的EST序列,将这些序列进行初步的筛选后(去掉冗长序列),利用Websat在线软件(http://wsmartins.net/websat/)进行引物设计,再将设计好的引物序列交由上海生物工程科技有限公司合成,设计的20对引物序列的信息详见表1。

表1 20对EST-SSR引物序列†Table 1 20 pairs of EST-SSR primer sequences
1.2.2 基因组DNA提取
每份材料采4~5片幼叶,用硅胶干燥保存。基因组DNA的提取采用改良的CTAB法,参照Doyle[14]的方法稍作修改。具体操作如下。
(1)取少量研磨好的样品倒入离心管中,样量为覆盖管底即可,加入预热(65 ℃)的溶液Ⅰ600 µL(具体配方见表2),充分混匀,再加B-巯基乙醇12 µL,4 ℃,12 000 r/min离心5 min,弃上清。
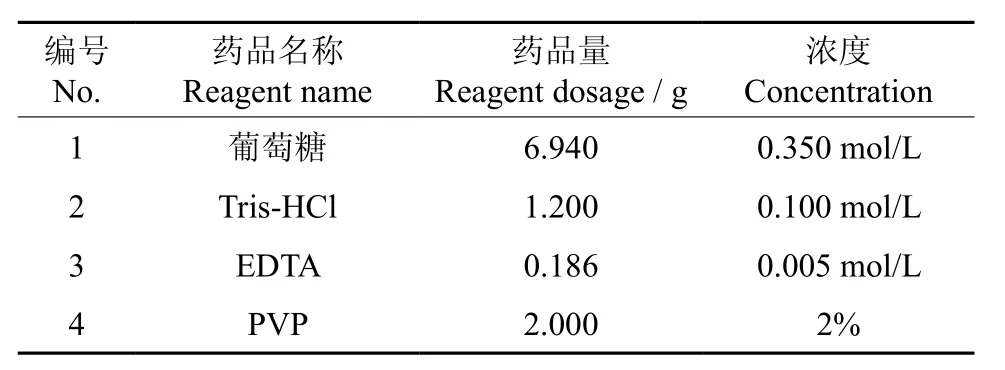
表2 溶液I的配方†Table 2 Formula of the solution I
(2)加入预热(65℃)CTAB提取液600~800 µL,加入B-巯基乙醇12 µL,上下颠倒混匀,65 ℃水浴35 min,每隔10 min左右温和混匀1次。
(3)4 ℃,12 000 r/min离心10 min,取上清约600 µL装入新离心管中,再加入预冷的氯仿异戊醇600 µL,缓慢摇匀至乳浊状。
(4)4 ℃,12 000 r/min离心10 min,取上清转入新的离心管中,加入等体积的氯仿异戊醇,并加入5 mol/L的醋酸钠200 µL,摇匀至乳浊状。
(5)4 ℃,12 000 r/min离心10 min,取上清。可根据离层情况重复上一步骤,若不重复上一步则加入2倍体积的预冷的冷无水乙醇,然后加入3 mol/L的醋酸钠200 µL。
(6)4 ℃,12 000 r/min离心10 min,弃上清,防止将沉淀倒出,将液体倒净,然后加入75%的乙醇约500 µL,使沉淀悬浮,常温下放置2~3 min。
(7)短暂离心后弃上清,晾干2~3 min,加入50 µL ddH2O,在-20 ℃下保存备用。
提取出的样品DNA经过UV-2401PC微量紫外/可见分光光度计测定吸光度后,根据OD260/OD280值判断其纯度,然后将每份样品DNA稀释为50 ng/µL,再取每份样品各10 µL用1%琼脂糖凝胶进行电泳检测,之后于-20 ℃保存备用。
1.2.3 PCR产物扩增
20对EST-SSR引物中进行混合DNA样品的筛选之后,将多态性较好的引物组合进行PCR扩增。PCR扩增仪为Gene Amp PCR System 9700,电泳仪为BIO-RAD POWER PAC3000,电泳槽为北京市六一仪器厂DYCZ-30C。EST-SSR反应体系为 20 µL,包括 2×EasyTaq PCR SuperMix(北京全式金生物技术有限公司)10 µL,上下游引物各 1 µL,模板 DNA 1 µL。扩增条件为:94 ℃预变性 5 min;94 ℃变性 45 s,54 ℃退火 45 s,72 ℃延伸45 s,运行35个循环;之后72 ℃充分延伸7 min。最后4 ℃保存。
1.2.4 电泳和银染
PCR产物用6%聚丙烯酰胺凝胶在160 V电压下电泳1 h。然后进行银染,银染液的配制及操作方法根据Panaud等[15]的方法进行改良。10%酒精与0.5%冰乙酸混合液固定12 min,水洗;1%硝酸银进行染色15 min,水洗;1%硫代硫酸钠浸泡凝胶30 s以上,水洗;1.5%氢氧化钠(2.5 mL/L甲醛)显影至条带清晰。银染后拍照并用保鲜膜保存好凝胶,将电泳图上清晰的条带记为“1”,同一位置有带记为“0”,带型不清或数据缺失记为“-”,获得“0/1”数据矩阵。计算每对引物扩增位点的多态性信息量(PIC,polymorphism information content)[16]。
1.2.5 数据统计分析
使用NTSYS-pc[17]生物学统计软件导入矩阵,获得遗传相似系数矩阵,按UPGMA方法进行聚类作图。并利用Popgen32[18]软件进行多态性数据分析。
2 结果与分析
2.1 扩增结果分析
以24份山核桃和27份核桃的DNA为模板,用设计合成的20对引物进行筛选,共获得了6对多态性较好的扩增引物,见表3。
采用6对引物组合进行PCR的扩增,条带清晰,扩增片断的长度范围为100~2 000 bp(见图1、图2);共检测出46个位点,其中多态性位点数为41个,每对引物的多态位点百分率在75%~100%之间,平均多态性位点百分率为89.45%。引物扩增位点的多态性信息量(PIC,polymorphism information content)在76.01%~90.01%之间,平均为83.64%,证明基于核桃ESTs数据开发的SSR引物有很好的通用性,可用于山核桃的遗传分析。
利用Popgen32软件对0/1矩阵进行运算,获得的多态性数据显示,观测等位基因数平均为1.869 6个,有效等位基因数为1.623 4,Nei基因多样性为0.344 7,香农指数I为0.502 3。

表3 6对EST-SSR引物序列的扩增结果Table 3 Result of 6 pairs of EST-SSR primer sequences amplification

图1 24份山核桃PCR结果Fig.1 PCR results of 24 samples in C. cathayensis

图2 27份核桃PCR结果Fig.2 PCR results of 27 walnut samples
2.2 聚类分析
使用NTSYSpc生物统计学软件计算山核桃与核桃个体间的遗传相似系数,按UPGMA法进行聚类分析,得到聚类树形图(见图3)。结果表明,在相似系数0.73时,山核桃与对照普通核桃可以很好地区分开,表明引物的有效性较好,亦能较好地反映出种属间的差异。

图3 51份材料的EST-SSR数据UPGMA聚类图Fig.3 UPGMA dendrogram of EST-SSR data from 51 samples
3 结论与讨论
本研究从NCBI数据库中获得了6对在核桃属间具有较好通用性的引物组合。在试验中发现,6对引物组合能将核桃与山核桃很好地区分开来,也能较好地进行山核桃内部分类。
(1)EST-SSR标记的通用性以及多态性 作为基因的一部分,EST-SSR侧翼序列在物种间高度保守,因此EST-SSR引物可在物种之间通用[19]。虽然EST的保守性在一定程度上限制了EST标记的多态性,但是仍然有少量引物的多态性较高,而且其属间的通用性较好,EST-SSR分子标记又是一种较为快速有效且成本低廉的技术。近年来,随着EST数据库的不断丰富,EST-SSR技术得到更多的应用。尤其在植物中,郑丽珊等[20]对棉花SSR分子标记在香蕉中的通用性进行了研究,157对多态性引物共扩增到1 188个条带,平均7.6个;引物的多态信息含量范围在0.58~0.91之间。廖娇等[21]研究发现,基于猕猴桃EST序列而筛选的SSR引物在柑橘类植物中具有一定的通用性。姚利华[22]利用苹果属开发的EST-SSR引物对梨属的4个种或品种中扩增出目的产物的有72对,其中多态性引物40对,又随机选取8对在24个梨属植物的种或品种上进行了扩增,所选引物在这些材料上均扩增出了与在苹果属上大小相似的预期产物,一共产生了59个等位基因,平均每对引物7.375个,揭示了它们之间较近的亲缘关系。本研究中平均扩增条带数为7.67,与上述研究的扩增结果相似。引物多态性信息含量为83.64%,与郑丽珊等人的研究结果吻合。
(2)山核桃资源的遗传多样性 本研究结果初步表明,EST-SSR适用于山核桃的遗传多样性分析,同时表明山核桃与普通核桃的相似性较低,相似度仅为0.50,证明它们之间的遗传距离较远。但是山核桃属内相似性较高,相似度为0.73~0.96。将山核桃属内各样品进行聚类分析,结果表明,样品L1与其它样品的差异最大,此外其它样品可以很明显地分为I和II 2个类群(见图3)。假设试验结果没有较大误差,样品L1遗传差异大的原因可能是样品本身序列非常特殊,应该对其进行测序,然后与其它山核桃的序列进行对比。
从目前的研究现状来看,运用EST-SSR标记对山核桃进行遗传多样性和系统分类的相关报道较少,本研究中利用生物信息学数据挖掘工具,从NCBI数据库中胡桃属EST序列中开发设计引物,经试验验证通用性良好,操作简单,成本低廉。下一步将利用本研究所筛选出的EST-SSR标记引物对不同种源的山核桃群体进行分析,进一步为山核桃进行品种鉴定以及资源保护提供可靠的依据。
(3)试验方法对结果的影响 在试验方法中,不同的方法对试验结果影响也各不相同。如基因组的提取,本研究中采用了DNA混合池的方法,与邵俊培等[23]的方法相似,即将所有样品的DNA各取少量混合进行引物组合的筛选。这样做不仅可以节约时间,而且不必消耗大量的试验材料,还可以获得较好的试验结果。在DNA提取方法上,本研究采用改良的CTAB法,获得较好的DNA样品。梁玉琴等[24]研究发现,常规CTAB法提取DNA质量低,分别采用改良CTAB法和植物基因组DNA提取试剂盒2种方法,改良CTAB法能够获得高浓度的DNA。在引物设计方法上,较多学者采用SSRHunter软件,如齐建勋等[25]以及吴硕等[26],而本研究中采用Websat在线软件进行引物设计,虽然方法不同,但是获得的引物组合效果也较好,而且该软件简单易用,设计耗费的时间较短。
参考文献:
[1]李元春.基于分子标记的山核桃生殖特性研究[D].临安:浙江农林大学,2011.
[2]王 静,吕芳德.我国山核桃属植物研究进展[J].经济林研究,2012,30(1):138-142.
[3]姚维娜,汪祥顺,汪孝成,等.山核桃嫁接技术[J].经济林研究,2010,28(1):56-61.
[4]李元春,沈 林,曾燕如.山核桃SRAP体系的建立及与RAPD和ISSR标记的比较[J].浙江农林大学学报,2011,28(3): 505-512.
[5]郭金剑,池 伟,赵鑫珠,等.山核桃AFLP实验技术体系的建立[J].浙江林学院学报,2008,25(4):532-537.
[6]郭金剑.山核桃群体结构及多样性的研究[D].临安:浙江林学院,2008.
[7]王正加,黄坚钦,郭传友,等.山核桃RAPD反应体系的优化[J].浙江林学院学报,2003,20(4):429-433.
[8]郭传友,黄坚钦,王正加,等.山核桃天然群体遗传结构的RAPD分析[J].南京农业大学学报,2006,29(3):12-17.
[9]吕岩桢,王 雷,张兴旺,等.山核桃 ISSR 反应体系的优化[J].安徽农学通报,2011,17(7):30-35.
[10]宋 双,黄银芝,董雷鸣,等.山核桃SSR标记的初步开发[J].浙江农林大学学报,2012,29(4):626-633.
[11]TAUTZ D. Hypervariabflity of simple sequences as a general source for polymorphic DNA markers[J]. Nucleic Acids Research, 1989, 17(16): 6463-6471.
[12]李卫国,常天俊,龚红梅.EST-SSR及其在植物基因组学研究中的应用[J].生物技术,2008,18(4):90-93.
[13]VARSHNEY R K, GRANER A, SORRELLS M E. Genic microsatellite markers in plants: features and applications[J].Trends in Biotechnology, 2005, 23(1): 48-55.
[14]DOYLE J J, JOHANNAH L D. Isolation of plant DNA from fresh tissue[J]. Focus, 1990, 12(1): 13-15.
[15]PANAUD O, CHEN X, MCCOUCH S R. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (Oryza sativaL)[J].Molecular and General Genetics, 1996, 252(5): 597-607.
[16]ANDERSON J A, CHURCHILL G A, AUTRIQUE J E,et al. Optimizing parental selection for genetic linkage maps[J].Genome, 1993, 36(1): 181-186.
[17]ROHLF F J. NTSYS-pc: Numerical Taxonomy and Multivariate Analysis System[M]. 2nd ed. New York: Biostatistics, 1997.
[18]FRANCIS C Y, BOYLE T B. Population genetic analysis of codominant and dominant markers and quantitative traits[J].Belgian Journal of Botany, 1997, 129(1): 157-157.
[19]TIMOTHY A H, CHRISTOPHER J T, MCCLURE L,et al.Identification and mapping of polymorphic SSR markers from expressed gene sequences of barley and wheat[J]. Molecular Breeding, 2002, 9(2): 63-71.
[20]郑丽珊,石玉真,王静毅,等.棉花EST-SSRs在香蕉中的通用性[J].中国农学通报,2008,24(1):33-37.
[21]廖 娇,黄春辉,辜青青,等.猕猴桃 EST-SSR 引物筛选及通用性分析[J].果树学报,2011,28(6):1111-1116.
[22]姚利华.苹果属EST-SSR标记开发及其在梨属上的转移性[D].杭州:浙江大学,2008.
[23]邵俊培,李志辉,杨模华,等.马尾松 EST-SSR PCR 体系的优化[J].中南林业科技大学学报,2012,32(4):159-163.
[24]梁玉琴,李芳东,傅建敏,等.柿属植物基因组DNA提取方法比较[J].中南林业科技大学学报,2012,32(4):170-173.
[25]齐建勋,王克建,吴春林,等.核桃EST-SSR标记的开发[J].农业生物技术学报,2009,17(5):872-876.
[26]吴 硕,傅建敏,乌云塔娜,等.柿属EST-SSR引物设计及遗传多样性研究[J].中南林业科技大学学报,2012,32(3):152-157.

