P-选择素对血管紧张素Ⅱ诱导的高血压致血管重构的影响1)
孙 旭,边云飞,刘改珍,孙亚丽,肖传实
血管重构(vascular remodeling,VR)是一个动态过程,包括细胞的增殖、迁移、凋亡以及胞外基质的合成、降解、重排;是血管对刺激复杂的动态反应过程,包括信号的感受、传导和调节因子的合成释放,最终使血管产生结构的变化[1]。P-选择素(P-selectin)是由血小板和内皮细胞表达的选择素家族成员之一,主要介导白细胞在血管内皮上的滚动和黏附[2],发挥致炎作用。炎症在高血压血管重构中起重要作用,包括血管壁通透性的改变,白细胞的渗出等[3]。因此,本研究以P-selectin基因敲除鼠为基础,探讨P-selectin在血管紧张素Ⅱ(AngⅡ)灌注致血管重构中的作用及机制。
1 材料与方法
1.1 主要材料和试剂 C57BL/6品系P-选择素基因敲除小鼠(P-selectin-/-)由首都医科大学附属北京安贞医院心肺血管疾病研究所惠赠,微量泵采用Alzet model 1007D,AngⅡ购自美国Sigma公司,小鼠血压测定使用Visitech BP2000 Blood Pressure Analysis System(美国)。兔抗转化生长因子-β1(TGF-β1)、Smad2/3多克隆抗体购自武汉博士德生物技术有限公司,二步法免疫组化试剂盒购自北京中杉金桥生物技术有限公司,TGF-β1、Smad3引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 实验动物分组 分别选取体重适合的18 g~20 g野生C57BL/6小鼠(Wild Type,WT)和C57BL/6遗传背景相同的P-选择素基因敲除小鼠,随机分为WT+PBS(阴性对照组)、P-selectin-/-+PBS(空 白 对 照 组)、WT+AngⅡ[1 5 0 0 ng/(min·kg),7 d,阳 性 对照 组]、P-selectin-/-+AngⅡ[1 500 ng/(min·kg),7 d,实验组],每组各6只。
1.2.2 动物模型制备 采用血管紧张素Ⅱ微量泵灌注(7 d)构建小鼠高血压模型,术后第4天~7天测血压,以确定血管紧张素Ⅱ灌注成功[4]。术后第7天,1%戊巴比妥麻醉小鼠,用肝素生理盐水灌注动物,取胸主动脉,4%多聚甲醛固定。
1.2.3 免疫组织化学染色 观察蛋白在血管中的表达,并做定量分析用TGF-β1、Smad2/3一抗和HRP标记的相应二抗,结合DAB显色观察蛋白在组织中的表达。6张切片每张采图3张,BI-2000医学图像分析系统测定其灰度值,并取平均值,定量分析各组间差异。
1.2.4 RT-PCR检测 TGF-β1、Smad3 m RNA的表达 水 平用RNAiso Plus提取胸主动脉总RNA,微量分光光度计测定RNA量,调整RNA浓度使吸光度值(A260/280)在1.8~2.0。目的基因引物序列β-actin:上游5′-GTCAGGTCATCACTATCGGCAAT-3′,下 游5′-AGAGGTCTTT ACGG ATGTCA ACGT-3′,184bp。TGF-β1:上 游 5′-CGCAACAACGCCATCTAT-3′,下 游 5′-CCAAGGTAACG CCAGGAAT-3′,203bp。Smad3:上游5′-ACTA CAGCCATTCC ATTCC-3′,下游 5′-TCTCCAT CTTCACTCAGGTA-3′,106bp。将 RNA反转录成cDNA,行PCR扩增,条件:94℃预变性1 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,共30个循环。凝胶成像仪保存图像,用Quantity one分析测定灰度值,目的基因PCR产物相对表达含量为目的基因条带灰度值/β-actin条带灰度值。
1.3 统计学处理 采用SPSS17.0统计软件进行数据处理,计量资料以均数±标准差(±s)表示,采用单因素方差分析One-Way ANOVA,方差齐使用LSD法,方差不齐使用Tamhane’s T2法,P<0.05为有统计学意义。
2 结 果
2.1 各组小鼠尾动脉收缩压(SBP)变化 微量泵灌注后7 d测量各组小鼠尾动脉SBP,每只小鼠测量10次~20次取平均值。详见图1。

图1 AngⅡ灌注7 d后各组小鼠收缩压的变化
2.2 免疫组织化学染色 各组小鼠胸主动脉中膜TGF-β1、Smad2/3的表达 TGF-β1、Smad2/3均定位于中膜层平滑肌细胞胞浆,在血管的内皮细胞层亦有表达,阳性信号为棕黄色,结果以平均灰度值(MOD)表示,MOD值越低,蛋白含量越高。详见表1。
表1 各组小鼠胸主动脉中膜TGF-β1、Smad2/3的表达±s)
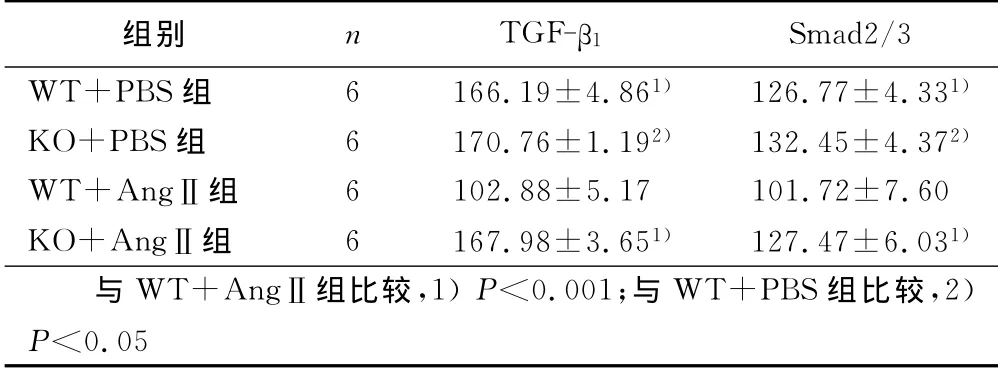
表1 各组小鼠胸主动脉中膜TGF-β1、Smad2/3的表达±s)
组别 n TGF-β1 Smad2/3 WT+PBS组 6 166.19±4.861) 126.77±4.331)KO+PBS组 6 170.76±1.192) 132.45±4.372)WT+AngⅡ组 6 102.88±5.17 101.72±7.60 KO+AngⅡ组 6 167.98±3.651) 127.47±6.031)与WT+AngⅡ组比较,1)P<0.001;与 WT+PBS组比较,2)P<0.05
2.3 RT-PCR检测(见图2~图4)
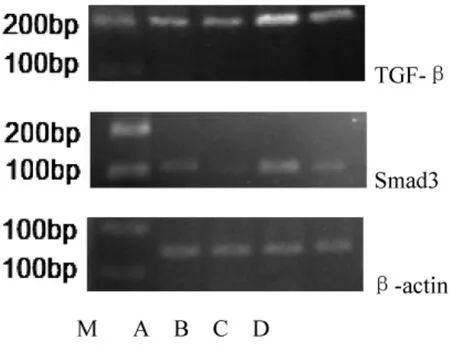
图2 RT-PCR检测血管TGF-β1、Smad3 mRNA表达电泳图
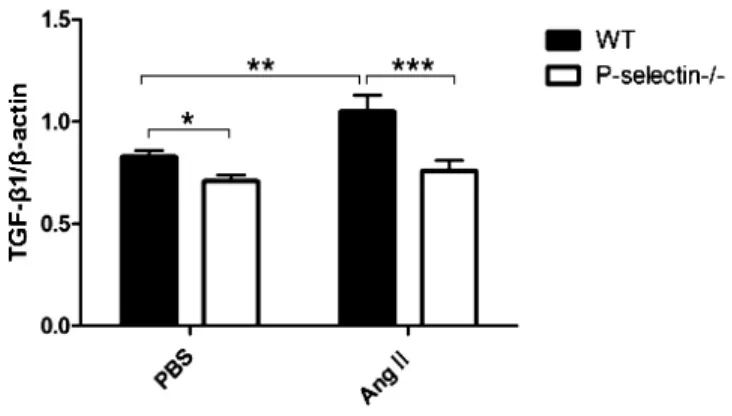
图3 RT-PCR检测血管TGF-β1 mRNA表达
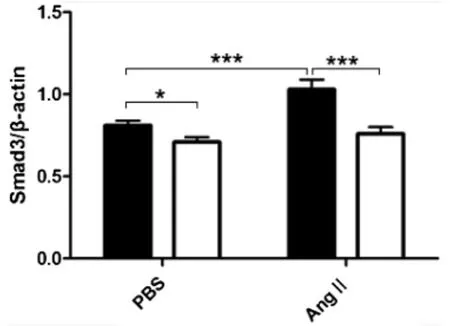
图4 RT-PCR检测血管Smad3 mRNA表达
3 讨 论
炎症是血管重构和纤维化的早期事件。在血小板表面表达有P-选择素糖蛋白配体-1(PSGL-1),P-选择素可通过与PSGL-1的结合,介导炎症细胞与血小板、内皮细胞之间的相互作用[5],主要是白细胞在血管内皮上的滚动和黏附过程[6]。
在高血压进程中,血管紧张素Ⅱ的激活所介导的炎症反应,对血管重构有非常重要的作用。AngⅡ通过其ATⅠ受体来激活细胞外信号调节激酶1/2和p38丝裂原活化蛋白激酶,进一步促进平滑肌细胞增殖和Ⅰ型胶原的合成[1],亦可直接参与诱导巨噬细胞、中性粒细胞等多种炎症细胞的浸润,诱导多种细胞因子(TGF-β)的释放,刺激成纤维细胞分化,合成大量胶原等导致胞外基质的沉积[7]。
研究表明,TGF-β1/Smads信号转导通路与心血管疾病密切相关,在高血压病、动脉粥样硬化(AS)等疾病的发病过程中起重要作用[8]。TGF-β1是已知的最重要的致纤维化细胞因子之一[9],而Smads是TGF-β1下游的一组重要的信号转导蛋白。TGF-β1与其受体结合激活Smad2、3进入核内,发挥正反馈作用[10]。TGF-β的作用有多重性,有学者研究发现 TGF-β是细胞间质蛋白合成的强刺激因子,TGF-β1/Smads信号通路活化能促进高血压主动脉的重构,且与ERK1/2、PARP、ET-1的上调等多种信号通路有关[11],并能促进血管新生[12]。但也有研究称TGF-β1/Smad3通道活化能抑制内皮细胞炎症蛋白表达[13],抑制TGF-β表达可提高表面黏附分子的表达,增强白细胞的黏附作用[14],对心血管系统起保护作用。
本实验结果显示,胸主动脉中膜TGF-β1、Smad2/3的表达,WT(PBS)较P-selectin-/-(PBS)组升高明显,WT(AngⅡ)较Pselectin(Ang Ⅱ)组 升 高 更 加 明 显,而 P-selectin-/-(PBS)与P-selectin-/-(AngⅡ)组比较差异无统计学意义,RT-PCR示TGF-β1、Smad3 mRNA与蛋白的表达趋势基本一致。综上推断:P-选择素和能够上调 TGF-β1、Smad3蛋白和mRNA的表达,主要通过加强TGF-β1/Smads信号通路的正反馈路径促进血管的重构,血管紧张素Ⅱ与P-选择素在TGF-β1/Smads通路的正反馈路径上有协同作用。
[1] Chen H,Hong HS.Vascular remodeling and carotid artery remodeling under hypertension[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2007,11(14):2724-2728.
[2] Dole VS,Bergmeier W,Mitchell HA,et al.Activated platelets induce Weibel-Palade-body secretion and leukocyte rolling in vivo:Role of P-selectin[J].Blood,2005,106(7):2334-2339.
[3] Yang Y,Chen C,Huang SA.Progress of study on relations between renin angiotensin system and vascular remodeling of hypertension[J].Medical Recapitulate,2008,14(13):1941-1943.
[4] Ma F,Li Y,Jia L,et al.Macrophage-stimulate cardiac fibroblast production of IL-6 is essential for TGFβ/Smad activation and cardiac fibrosis induced by angiotensinⅡ[J].PLoS One,2012,7(5):e35144.
[5] Spertini C,Baisse B,Spertini O.Ezrin-radixin-moesin-binding sequence of PSGL-1 glycoprotein regulates leukocyte rolling on selectins and activation of extracellular signal-regulated kinases[J].Biol Chem,2012,287(13):10693-10702.
[6] Abdulla A,Awla D,Hartman H,et al.Platelets regulate P-selectin expression and leukocyte[J].Arterioscler,2012,20(3):203-206.
[7] Chiara M,Pierre P,Ernesto L.Schiffrin Role of the renin-angiotensin system in vascular inflammation[J].Trends Pharmacol Sci,2008,29(7):367-374.
[8] Gao LR,Teerlink J,Karliner J.Dysregulation of the transforming growth factor beta smads signaling pathway in rats with chronic heart failure[J].Chin J Cardiol,2001,29(3):177-180.
[9] Gresner AM,Weiskircben R.Role of TGF-beta in hepatic-fibrosis[J].Front Bio Sci,2002,7:793-807.
[10] Inman GJ.Linking Smads and transcriptional activation[J].Biochem J,2005,386(Pt 1):1-3.
[11] Olave N,Nicola T,Zhang W,et al.Transforming growth factor-β regulates endothelin-1 signaling in the newborn mouse lung during hypoxia exposure[J].Am J Physiol Lung Cell Mol Physiol,2012,302(9):857-865.
[12] Evrard SM,d’Audigier C,Mauge L,et al.The profibrotic cytokine transforming growth factor-β1increases endothelial progenitor cell angiogenic properties[J].J Thromb Haemost,2012,10(4):670-679.
[13] Wang WD,Chen BD,Qi RM,et al.TGF-β1/Smad3 regulation of inflammatory protein expression induced by oxidized low density lipoprotein in human umbilical vein endothelial cells[J].Chin J Arterioscler,2012,20(3):203-206.
[14] Walshe TE,Dole VS,Maharaj AS,et al.Inhibition of VEGF or TGF-βsignaling activates endothelium and increases leukocyte rolling[J].Arterioscler Thromb Vasc Biol,2009,29(8):1185-1192.

