高温胁迫对鸡爪槭品种生理特性的影响
陈庆生,王伟伟,窦全琴
(江苏省林业科学研究院,江苏 南京 211153)
鸡爪槭(Acer palmatum Thunb.)为槭树科槭树属落叶小乔木,原产山东、河南、江苏、浙江、安徽、江西、湖北、湖南、贵州等省,生长于海拔200~1 200 m的林边或疏林中,在朝鲜和日本也有分布[1]。鸡爪槭叶形美观,秋日叶红,灿烂似朝霞,风姿极佳,为著名观赏树种[2]。鸡爪槭在我国早有栽培,且变种和变型很多,但鸡爪槭栽培品种遇夏季高温时易被日灼,特别在南方梅雨季节后,突遇烈日暴晒[3],温度陡升,叶片更易产生灰白色干枯斑,叶缘卷缩,严重时整叶变黄焦枯,降低了观赏价值。本文通过研究自然高温处理后不同鸡爪槭品种叶片生理特性的变化,探讨鸡爪槭耐热性与生理特性变化的关系,对进一步揭示鸡爪槭耐热机理及筛选耐热种质有重要的理论和现实意义。
1 材料与方法
1.1 试验材料
选用江苏省林业科学研究院11个2年生不同观赏类型的鸡爪槭品种,于2012年3月定植于控根容器中,容器直径30 cm,高30 cm,采用泥炭、芦苇炭、蛭石和有机肥混合基质栽培(体积比为40∶40∶15∶5)。
1.2 试验设计
试验在江苏省林业科学研究院内进行。11个鸡爪槭品种试验苗分成2组,一组在空旷地进行自然高温处理;另一组作为对照,采取遮荫等降温措施,保持最高气温低于35℃。2组均采用随机区组设计,重复3次,株行距为1 m×1 m。
1.3 测定方法
2012年7月20日到7月31日经连续12 d自然高温(日最高气温≥36℃)处理后,8月1日10:00采样,进行生理指标的测定。
电导率(REC)采用电导仪法测定,丙二醛(MDA)含量测定采用硫代巴比妥酸比色法,超氧化物歧化酶(SOD)活性测定采用抑制NBT光化还原方法,过氧化物酶(POD)活性测定采用愈创木酚法[4],可溶性蛋白采用考马斯亮蓝G-250显色法,脯氨酸参照茚三酮显色法[5]。
2 结果与分析
2.1 高温处理对不同鸡爪槭品种质膜透性的影响
2.1.1 对相对电导率的影响 高温处理后不同参试品种叶片相对电导率均有不同程度增大,如图1所示。D1118、R1110、R1111和C1125等4个品种在高温处理后相对电导率与对照相比有极显著性差异(P<0.01);F1120和X1119在高温处理后相对电导率与对照相比有显著性差异(P<0.05); C1116、Y1101、F1113、F1115和G1114等5个品种在高温处理后相对电导率与对照相比没有显著性差异(P<0.05)。在高温处理后参试品种平均相对电导率为39.50%,D1118和X1119相对电导率较低,分别为23.55%和28.44%;R1111、F1113和C1125相对电导率较高,分别为 49.11%,48.79%,48.23%。对照组平均相对电导率为28.75%,D1118相对电导率最低,为13.62%;F1113相对电导率最高,为41.01%。

图1 高温处理对11个鸡爪槭品种叶片相对电导率的影响
2.1.2 对丙二醛(MDA)含量的影响 高温处理对不同参试品种叶片的MDA含量影响差异较大,如图2所示。Y1101、F1120和F1115等3个品种的MDA含量比对照提高了82.63%~111.52%,达到了极显著性差异(P<0.01);C1116和R1111的MDA含量比对照分别提高了35.80%和23.77%,达到了显著性差异(P<0.05);D1118、R1110、C1125、F1113、X1119和G1114等6个品种MDA含量与对照相比没有显著性差异;在高温处理后参试品种的平均MDA含量为63.03 μmol/g FW,比对照组平均升高39.91%;其中X1119、C1125和D1118的 MDA 含 量 较 低,分 别 为 40.36,45.73,53.70 μmol/g FW;Y1101、G1114、F1120和 R1111的MDA含量较高,分别为74.96,72.41,71.29,70. 16 μmol/gFW。对照组平均 MDA 含量 为45.053 μmol/g FW,X1119的 MDA含量最低为27.58 μmol/g FW;F1113的 MDA含量最高,达到64.75 μmol/g FW。
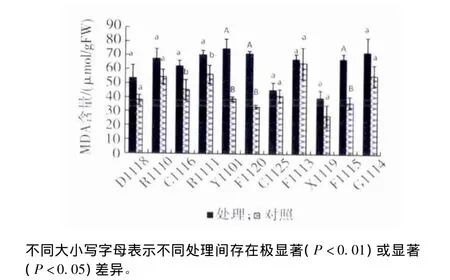
图2 高温处理对11个鸡爪槭品种叶片中MDA含量的影响
2.2 高温处理对不同鸡爪槭品种保护酶系统的影响
2.2.1 对超氧化物歧化酶(SOD)活性的影响 高温处理后参试品种叶片的SOD活性均显著(P<0.05)增强,平均值为对照的304.06%,如图3所示。Y1101、F1120和F1115等3个品种的SOD活性与对照相比达到了显著性差异(P<0.05),比对照提高93.29%~126.85%;其余品种达到了极显著性差异(P<0.01),比对照提高127.62% ~766.57%。高温处理后参试品种SOD活性平均为1 149.67 U/g FW,Y1101活性最低,为 639.03 U/g FW;X1119活性最高,为1 455.09 U/g FW。对照组参试品种SOD活性平均为378.10 U/g FW,C1125活性最低,为105.49 U/g FW;F1113活性最高,为564.60 U/g FW。

图3 高温处理对11个鸡爪槭品种叶片SOD活性的影响
2.2.2 对过氧化物酶(POD)活性的影响 高温处理对参试品种叶片的POD活性影响差异较大,平均值为对照的258.88%,如图4所示。D1118、R1111、Y1101、F1120、X1119和F1115等6个品种在高温处理有POD活性与对照达到了极显著性差异(P<0.01);C1116和F1113在高温处理后POD活性与对照相比达到了显著性差异(P<0.05);其余品种与对照间没有显著性的差异。高温处理后参试品种POD活性平均为19.29 U/(g FW·min),其中品种F1120、Y1101、F1115和X1119的POD活性较大,分别为79.860,47.21,45.95,25.86 U/(g FW·min);其余品种的POD活性均较小,G1114的活性最小,仅有0.498 U/(g FW·min)。对照组POD活性平均为7.45 U/(g FW·min),F1120、Y1101和X1119的 POD 活性较大,分别为 43.82,17.13,15.20 U/(g FW·min);其余品种POD活性较小,其中R1111最小,仅有0.01 U/(g FW·min)。
2.3 高温处理对不同鸡爪槭品种渗透调节物质含量的影响
2.3.1 对脯氨酸含量的影响 高温处理对参试品种叶片的脯氨酸含量影响显著(P<0.05),平均值为对照的268.85%,如图5所示。C1125高温处理后脯氨酸含量与对照相比达到了显著性差异(P<0.05);其余品种达到了极显著性差异(P<0.01)。经高温处理后,脯氨酸含量与对照相比,提高幅度为61.70%~965.31%,Y1101增加幅度最大,是对照的10.65倍。高温处理后参试品种脯氨酸含量平均值为63.24 μg/g FW,Y1101的含量最高,为188.72 μg/g FW;D1118的含量最低,仅为19.86 μg/g FW。对照组脯氨酸含量平均值为17.15 μg/g FW,R1110的含量最高,为24.18 μg/(g FW); D1118含量最低,仅为11.27 μg/g FW。

图4 高温处理对11个鸡爪槭品种叶片POD活性的影响

5 高温处理对11个鸡爪槭品种叶片脯氨酸含量的影响
2.3.2 对可溶性蛋白含量的影响 高温处理对参试品种叶片的可溶性蛋白含量影响显著,平均值为对照的215.98%,如图6所示。比对照提高了68.62%~224.49%。R1110高温处理后可溶性蛋白的含量与对照相比没有显著性差异;其余品种达到了极显著性差异(P<0.01)。F1115经高温处理后可溶性蛋白含量提高幅度最大,为对照的224.49%。高温处理后参试品种可溶性蛋白含量平均值为342.62 μg/g DW,D1118含量最高,为515. 76 μg/g DW;X1119含量最低,仅为242.65 μg/g DW。对照组可溶性蛋白含量平均值为 158.64 μg/g DW,R1110含量最高,为224.70 μg/g DW; C1125含量最低,仅为95.45 μg/g DW。

图6 高温处理对11个鸡爪槭品种叶片可溶性蛋白含量的影响
3 讨论
3.1 高温处理对质膜透性的影响
Martineau等认为植物在高温胁迫下的膜伤害与质膜透性的增加是高温伤害的本质之一[6]。植物组织受到逆境伤害时,由于膜的结构破坏,使其透性增大,细胞内各种水溶性物质包括电解质将有不同程度地外渗,伤害愈大,外渗愈大,电导率的增加也愈大[7]。MDA是植物细胞膜脂过氧化物之一,MDA含量的动态变化与细胞质膜外渗率的变化趋势一致,耐热种类的MDA积累量与外渗率均较小[8]。本文研究的不同参试品种叶片的相对电导率的变化和MDA的含量可以看出,品种D1118和X1119经过自然高温处理后,相对电导率和MDA的含量均低于平均水平,说明质膜在高温下受伤害程度较小,表现出较强的耐热性。这与景天植物在高温胁迫下MDA含量持续上升,耐热性强的景天植物表现出MDA含量积累少[9]结果一致。高温胁迫对大花三色堇幼苗中抗性较强的品种电解质外渗和MDA含量也有相似的结果[10]。品种 Y1101、F1113、F1115和G1114经高温处理后,相对电导率与对照之间没有显著性差异(P<0.05);同时这些品种的MDA含量也高于平均水平,这表明质膜的稳定性已经受到一定程度地破坏,可能对照组在遮荫条件下也已经受到热害,说明这几个品种对热敏感。
3.2 高温处理对保护酶系统的影响
高温胁迫使植物体内活性氧的产生与清除平衡被打破,导致活性氧的积累,为了阻止活性氧对细胞的伤害,植物形成了抗氧化保护酶和抗氧化剂在内的抗氧化保护系统,植物细胞中SOD、POD酶是主要保护酶之一。SOD是植物体内重要的活性氧清除酶之一,也是保护酶系统的首道防线,负责将超氧阴离子自由基歧化为O2和H2O2。POD催化H2O2和电子供体形成H2O,进而阻止H2O2在体内的积累或通过Fenton反应(H2O2+Fe2+→·OH+OH-+Fe3+)形成羟基自由基(·OH)。从而减少·OH在形成部位直接攻击细胞内核酸、蛋白质生物大分子与质膜不饱和脂肪酸的可能性,确保膜结构完整性[11-13]。本文参试品种经过自然高温处理,SOD与POD活性都出现不同程度的增强,与红掌盆栽品种抗热性研究SOD和POD活性的变化情况相似[14]。在对高温胁迫4种珍珠菜属植物的研究中发现,随着高温胁迫的增强,SOD与POD活性先上升后下降,但与对照相比还是表现为增强[15],本文的研究结果与其一致。品种Y1101和F1120在高温处理后SOD与其他品种相比活性较弱,而POD活性明显增强,此消彼长;而F1115和X1119的SOD和POD都表现出较高的活性,这可能与植物的不同防御阶段和机制有关。植物正常生长条件下,保护酶彼此协调,使生物体内活性氧自由基维持在一个较低的平衡状态,当处于高温胁迫时,植物体内活性氧产生和清除的平衡被破坏,活性氧的积累加速,此时抗氧化酶就会积极参与以维持细胞内活性氧自由基的平衡。本研究发现,SOD的活性在高温处理后均表现出显著(P<0.05)或极显著(P<0.01)增强;POD活性在高温处理均有所增强,Y1101、F1120、X1119和F1115等4的品种的活性显著高于其他品种,且与对照有极显著性(P<0.01)增大;其余品种经高温处理后POD活性也有显著(P<0.05)或极显著(P<0.01)地提高,但是整体活性很低,在维持细胞内活性氧自由基平衡方面意义不大。大部分鸡爪槭品种SOD与POD活性呈现此消彼长的模式,协调作用,减轻逆境伤害。由此可见,鸡爪槭在高温胁迫下,最先激发的保护酶为SOD。
3.3 高温处理对渗透调节物质的影响
渗透调节是植物抵御高温胁迫的重要生理反应,是植物对膜脂过氧化作用酶促防御体系之一,可调节渗透与细胞水分含量,参与物质代谢[16],在抗热性研究中倍受关注。脯氨酸的生理功能丰富,它不仅可以调节细胞质渗透压、降低植物细胞的酸度、稳定细胞的大分子结构,还在调节细胞氧化还原势上起作用。脯氨酸含量的变化,不仅可以影响到细胞的膜脂过氧化作用,还在一定程度上影响细胞的水分含量和氧自由基的清除。本研究参试品种在高温处理后脯氨酸含量与对照相比有显著性增强(P<0.05)。在高温胁迫下脯氨酸不同程度的主动积累,能提高植物细胞的渗透调节能力[14,17]。Y1101经高温处理后脯氨酸含量最高,是对照的10.65倍,是平均值的2.98倍,极显著(P<0.01)高于其他品种,说明该品种对热敏感。蛋白质是生物体内最重要的大分子物质之一,在逆境条件下,植物体通常会启动一些与逆境相适应的基因,导致新蛋白的产生,这些蛋白通常被称为胁迫蛋白。其中,调渗蛋白的作用尤其重要。可溶性蛋白与植物细胞的保水力密切相关,在高温胁迫下可溶性蛋白含量可显著增加,由于其具有较强的亲水性,对胞内水分的保持具有重要作用。耐热种类或品种在高温下能保持较高的蛋白质合成速率与较低的蛋白质降解速率。然而,关于植物叶片中可溶性蛋白的变化与高温胁迫的关系目前存在争议。有结果表明,在高温胁迫下,可溶性蛋白含量增加[18-19];但也有结果证实,植物体内的可溶性蛋白含量下降[20-21],这可能与供试植物本身特性和胁迫温度的高低有关。本研究中参试品种高温处理后可溶性蛋白含量均有所提高,其中有10个品种与对照相比有极显著性增加(P<0.01)。Y1101、F1115和G1114的脯氨酸含量与可溶性蛋白含量都较高,说明这2种物质共同调节高温胁迫造成的伤害。D1118经高温处理后可溶性蛋白含量最高且与对照相比有极显著性(P<0.01)提高,脯氨酸含量与对照相比也有极显著性提高,增大渗透调节能力,以抵抗外界不良环境的影响。
3.4 鸡爪槭品种的耐热性
不同参试品种的耐热性存在明显的差异,不同品种应对高温胁迫的保护酶与渗透调节物质的变化不同。D1118主要是通过提高SOD活性和可溶性蛋白的含量来提高抗逆性;X1119和F1115则通过SOD和POD协同作用,且2种渗透调节物质都有极显著性增加,以此来减少高温对其造成的伤害。参试品种保护酶系统出现此消彼长的现象,一般以一种保护酶的活性提高为主。Y1101和F1120保护酶活性和渗透调节物质含量均较高,但质膜透性破坏严重,可能是植物已经处于受伤害的后期。由此可以看出,各品种通过不同的保护机制来抵抗热害,这可能与植物本身的特性或胁迫所处的不同阶段有关。
D1118和X1119经过高温处理后,质膜透性伤害程度小,相对电导率和MDA含量与其他品种之间有显著性(P<0.05)差异;保护酶活性较高,具有较强的渗透调节能力;这2个品种叶片形态和叶色在高温处理后没有明显变化[22],说明这2个品种具有较强的耐热性。其余品种在高温处理后,相对电导率高,细胞膜质过氧化产物积累较多,且叶片颜色变化明显,叶片卷曲甚至有脱落[22],说明其对高温的适应性较弱,可能更加适应于夏季高温持续时间短且温度稍低的高纬度地区种植。
[1]中国科学院中国植物志编委会.中国植物志[M].北京:科学出版社,1981:129-130.
[2]乔勇进,许景伟,谢韶颖,等.槭树资源及其在山东园林建设中的应用[J].防护林科技,2004(5):50-51.
[3]黄 荧.久雨骤晴防日灼[J].中国花卉盆景,2003(10):34.
[4]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002.
[5]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[6]Martineau J R,Speeht J E,Williams J H,et al.Temperature tolerance in soybeans[J].Crop Science,1979,19(1):75-81.
[7]李衍素,高俊杰,陈民生,等.高温胁迫对豇豆幼苗叶片膜伤害与保护性物质的影响[J].山东农业大学学报:自然科学版,2007,38(3):378-382.
[8]梁建萍,刘咏梅,牛 远,等.高温和CO2浓度倍增对华北落叶松幼苗抗氧化酶及脂质过氧化的影响[J].中国生态农业学报,2007,15(3):100-103.
[9]郭金丽,张文娟,候雅琼,等.高温胁迫对景天植物膜脂过氧化及保护酶活性的影响[J].中国农学通报,2012,28(34): 230-233.
[10]彭华婷,高 悦,杜红梅,等.高温胁迫对大花三色堇幼苗相关生理指标的影响[J].上海交通大学学报:农业科学版,2012,30(6):66-71.
[11]陈 雄,王宗灵,任红旭,等.海拔高度对大车前叶和根中抗氧化系统的影响[J].植物学报,1999,41(8):846-850.
[12]Hodges D M,Andrews C J,Johnson D A,et a1.Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize line[J].Journal of Experimental Botany,1997,48(5):1105-1113.
[13]徐小万,曹必好,陈国菊,等.高温高湿对辣椒抗氧化系统的影响及不同品种抗氧化性差异研究[J].中国生态农业学报,2008,23(1):81-86.
[14]林晓红,施木田,林小苹,等.3个红掌盆栽品种的抗热性比较研究[J].热带作物学报,2012,33(10):1835-1840.
[15]许桂芳,张朝阳.高温胁迫对4种珍珠菜属植物抗性生理生化指标的影响[J].中国生态农业学报,2009,17(3):565-569.
[16]Kuznetsov V V,Shevyakova N L.Stress responses of tobacco cells to high temperature and salinity,proline accumulation and phosphorylation of polypeptides[J].Physiologia plantrum,1997,100 (2):320-326.
[17]刘仁杰,张万萍.温度胁迫对几种豆类芽苗菜生长及生理指标的影响[J].江苏农业科学,2012,40(3):114-116.
[18]欧祖兰,曹福亮,郑 军.高温胁迫下银杏形态及生理生化指标的变化[J].南京林业大学学报:自然科学版,2008,32(3): 31-34.
[19]郑 宇,何天友,陈凌艳,等.高温胁迫下西洋杜鹃的生理响应及耐热性[J].福建林学院学报,2012,32(4):326-335.
[20]Gulen H,Eris A.Effects of heat stress on peroxidase activity and total protein content in strawberry plants[J].Plant Science,2004,166(3):739-744.
[21]张施君,周厚高,钟云娟,等.高温胁迫对观赏百合苗期的生理影响研究[J].中国生态农业学报,2006,7(3):103-104.
[22]窦全琴,隋德宗,吕运舟.高温胁迫对鸡爪槭观赏品种形态及光和特性的影响∥第十四次全国树木引种驯化学术研讨会论文集[C].北京:中国林学会树木引种驯化专业委员会,2012:45.

