香椿叶提取物抗氧化及抑菌活性研究
赵二劳,冯冬艳,武宇芳,贾鹏燕
(忻州师范学院1.化学系;2.生物系,山西 忻州 034000)
0 引言
香椿〔Toona sinensis(A.Juss.)Roem.〕为 楝科(Meliaceae)香椿属(Toona)落叶乔木,原产于中国,全国均有分布.香椿全株都具特殊气味,其嫩茎、叶供食用,是高级木本蔬菜,被国外称为“绿色保健菜”[1].香椿中含有多酚类物质[2],近年来对香椿中黄酮类成分的研究较多[3-5],而对香椿中多酚物质的研究鲜见报道.多酚类物质作为植物中广泛存在的一类酚羟基化合物,是植物次生代谢的产物,具有抗氧化、抗衰老、抗菌、抗病毒、降血压、降血脂等药理活性,在医药、食品等领域得到广泛应用[6-8].作者研究了香椿叶乙醇提取物中多酚含量及其抗氧化和抑菌活性,旨在为香椿资源的综合利用和高附加值产品的开发提供理论依据.
1 材料与方法
1.1 材料与试剂
香椿叶于2012 年7 月采自忻州师范学院校园,干燥后粉碎机粉碎,过40 目筛,装瓶备用.
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis):青岛高科园海博生物科技有限公司;1,1-二苯基-2-苦肼基(DPPH·):日本东京化成工业株式会社;酚试剂:生化试剂,天津市光复精细化工研究所.其他试剂均为国产分析纯或生化级,实验用水为二次蒸馏水.
1.2 仪器与设备
723 型可见分光光度计:上海光谱仪器有限公司;YXQ-LS-50G 立式压力蒸汽灭菌器:上海博迅实验有限公司医疗设备厂;KQ-400KDE 型高功率数控超声波清洗器:巩义市予华仪器有限责任公司;RE-2000B 旋转蒸发器:上海亚荣生化仪器厂;THZ-98A 恒温振荡器:上海一恒科学仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司.
1.3 试验方法
1.3.1 香椿叶提取物的制备
基于超声波在天然产物活性成分提取中能产生空化作用,加速细胞壁破碎,具有能耗低、提取效率高、提取时间短、不破坏有效成分等特点[9-10],参考文献[11]的方法,略作改进,采用超声辅助提取香椿叶.称取香椿叶10.0 g,以体积分数50%的乙醇为溶剂,在料液比1∶25(M/V),超声波功率360 W 的条件下,超声辅助提取30 min.提取液过滤,滤渣再提取一次,合并两次滤液,在45 ℃下减压蒸发浓缩,得到深红色浆状物,即为香椿叶提取物.称取1.0 g 香椿提取物,用蒸馏水溶解并定容到250 mL 容量瓶中,备用.
1.3.2 香椿叶提取物多酚含量的测定
香椿叶提取物中多酚的测定,以没食子酸为对照品,参照文献[11]采用Folin-Ciocalteu 法,略作改进.准确吸取浓度为1.0 μg/mL 没食子酸对照品溶液1.0、2.0、3.0、4.0、5.0、6.0 和7.0 mL,分别置于10 mL 比色管中,再加入0.5 mL 酚试剂,充分摇匀,静置3~4 min 后,都加入20%的碳酸钠溶液2.0 mL,蒸馏水定容至刻度,摇匀,室温下避光反应1 h 后,在波长760 nm 处测其吸光度,由吸光度对浓度作图,求得标准曲线回归方程为:A=1.016 2C-0.014 7,R2=0.999 5,其线性范围为0.1~0.7 g/mL.
试验时吸取适当稀释后香椿叶提取液1.0 mL,置于10 mL 比色管中,按标准曲线方法测定吸光度.由标准曲线回归方程计算香椿叶提取液中多酚浓度,按下式计算香椿叶提取物中多酚含量:
多酚含量=多酚提取量(mg)/香椿叶提取物质量(mg).
1.3.3 香椿叶提取物抗氧化活性测定
采用清除DPPH·法[11]和·OH 法[12]评价香椿叶提取物抗氧化性,并以常用抗氧化剂2,6-二叔丁基对甲酚(BHT)作阳性对照.同时,试验利用半清除率(IC50)定量比较香椿叶提取物与BHT 对DPPH·和·OH 的清除能力.IC50表示对自由基的清除率达到50%时,所需香椿叶提取物或BHT 的质量浓度,IC50值越小,则其抗氧化活性越强.
1.3.3.1 对DPPH·的清除率
DPPH·是一种稳定的以氮为中心的自由基,溶于乙醇其溶液呈深紫色.该溶液在波长517 nm 处有强吸收.当溶液中加入自由基清除剂时,可与其单电子配对使溶液褪色吸收降低,褪色程度与其所接受的电子数呈线性关系,因此可以用光度法检测对自由基的清除率,从而评价自由基清除剂即样品的抗氧化活性.
试验时,准确吸取一定量的香椿叶提取液于10 mL 比色管中,然后加入2.0 mL 浓度为0.28 mmol/L 的DPPH·溶液,蒸馏水定容至刻度,在室温下避光反应30 min 后,在波长517 nm 处测定吸光度.按下式计算清除率:
清除率=[1-(Ai-Aj)/A0]×100%,
式中:A0为未加香椿叶提取液时溶液的吸光度;Ai为加香椿叶提取液后溶液的吸光度;Aj为香椿叶提取液的吸光度.
1.3.3.2 对·OH 的清除率
以Fenton 反应建立试验体系模型[12].H2O2与Fe2+反应产生·OH,·OH 具有很高的反应活性,在反应体系中加入水杨酸,就能与·OH 反应并生成紫红色产物,该产物在510 nm 波长处有最大吸收.若在此反应体系中加入具有清除·OH 功能的被测物,就会与水杨酸竞争·OH,使有色产物生成量减少,导致反应体系在510 nm 波长处吸收减弱.采用固定反应时间法,分别测定加入与未加入香椿叶提取液反应体系的吸光度,就可测定香椿叶提取液对·OH 的清除率.·OH 的清除率按下式计算:
清除率=(A0-Ai)/A0,
式中:Ai为加入香椿叶提取液后·OH 体系的吸光度;A0为未加香椿叶提取液时·OH 体系的吸光度.
试验时,在10 mL 比色管中,依次加入1.0 mL浓度为7.55 mmol/L 的硫酸亚铁溶液、1.0 mL 浓度为7.5 mmol/L 的水杨酸溶液和0.5 mL 0.3%的H2O2溶液,水定容至刻度,置于40 ℃恒温水浴中反应1 h 后,在波长510 nm 处测定其吸光度为A0,在上述体系中分别加入不同量的香椿叶提取液测定吸光度为Ai.
1.3.4 香椿叶中多酚的抑菌活性
试验参考文献[13]的方法,采用滤纸片法测定香椿叶提取物的抑菌活性.分别取大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌在无菌条件下进行活化培养,然后分别接种于LB 液体培养基上,在37 ℃下培养1 d.用无菌吸管分别吸取200 μL 相应的待试菌悬液于LB 固体培养基表面,用无菌涂布器将菌液涂布均匀,制成含菌平板.取经干热灭菌的直径6 mm 的滤纸,分别浸入香椿叶提取液及无菌生理盐水中,浸泡30 min.用灭菌镊子分别夹取浸过提取液和无菌生理盐水的滤纸各两片贴于含菌平板上,每皿4 片,呈十字对称放置,37 ℃恒温培养1 d.每组3 次平行试验,以十字交叉法测量抑菌圈直径,取其平均值,比较抑菌效果.
2 结果与分析
2.1 香椿叶提取物中的多酚含量
试验测得10.0 g 香椿叶可制得3.66 g 香椿叶提取物.取适当稀释后的香椿叶提取物待测液1.0 mL,按试验方法测定其吸光度,根据标准曲线方程计算得香椿提取物待测液中多酚的质量浓度为24.5 g/mL,香椿叶提取物中多酚含量为6.125 mg/g.
2.2 香椿叶提取物抗氧化活性
2.2.1 对DPPH·的清除率
按试验方法测定香椿叶提取物中多酚与常用抗氧化剂BHT 对DPPH·的清除率,结果见图1.
由图1 可见,香椿叶提取物中多酚对DPPH·具有较强的清除能力,且清除率随多酚量的增加而增大,呈现量效关系,表明香椿叶多酚具有较强的抗氧化活性.由Excel 作图求得香椿叶提取物中多酚与BHT 对DPPH·的清除率曲线方程分别为:
香椿叶提取物多酚:Y=1.470 1X-1.268 2,R2=0.977.
BHT:Y=1.570 5X+9.082 5,R2=0.959.

图1 香椿叶提取物多酚与BHT 对DPPH·的清除率
由曲线方程求得香椿叶提取物多酚与BHT 清除DPPH·的IC50分别为34.87 μg/mL 和26.05 μg/mL.可见,香椿叶提取物多酚清除DPPH·的能力弱于合成抗氧化剂BHT.
2.2.2 对·OH 的清除率
按试验方法测定香椿叶提取物中多酚与常用抗氧化剂BHT 对·OH 的清除率,结果见图2.
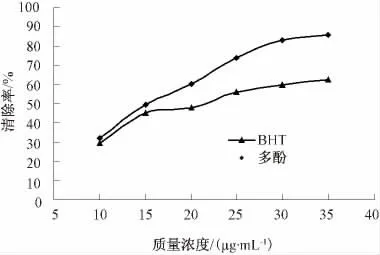
图2 香椿叶提取物多酚与BHT 对·OH 的清除率
由图2 可见,香椿叶提取物多酚对·OH 的清除率随其多酚用量的增加而增大,且呈现量效关系.由Excel 作图求得香椿叶提取物多酚与BHT对·OH 的清除率曲线方程分别为:
香椿叶提取物多酚:Y=2.205 1X+14.564,R2=0.963.
BHT:Y=1.253 7X+22.024,R2=0.920.
由曲线方程求得香椿叶提取物多酚与BHT 清除·OH 的IC50分别为16.07 μg/mL 和22.25 μg/mL.可见香椿叶提取物多酚清除·OH 的能力强于抗氧化剂BHT,表明香椿叶提取物多酚具有较强的抗氧化活性.
2.3 香椿叶提取物的抑菌活性
按试验方法进行3 次平行试验,测得香椿叶提取物溶液对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌圈平均直径分别为9.7 mm、7.1 mm和8.5 mm,表明香椿叶提取物对所试3 种菌种都有一定的抑制效果,且对大肠杆菌的抑制效果最强,说明香椿叶提取物具有一定的抑菌活性.
3 结论
试验表明,超声辅助提取的香椿叶提取物中多酚含量较高,达6.125 mg/g.抗氧化试验表明,香椿叶提取物具有较强的抗氧化活性,其和BHT 对DPPH·的半清除率IC50分别为34.87 μg/mL 和26.05 μg/mL.对·OH 的 半 清 除 率IC50分 别 为16.07 μg/mL 和22.25 μg/mL,且抗氧化活性与其多酚含量呈量效关系.抑菌试验表明,香椿叶提取物对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌均具有一定的抑制效果,且对大肠杆菌的抑制效果最强,说明香椿叶提取物具有一定的抑菌活性.可见,从香椿叶中提取多酚作为天然抗氧化剂和食品防腐剂具有广阔应用前景,值得深入研究开发.
[1]夏廉法,柴冬梅,陈丛梅,等.植物生长调节剂在香椿日光温室生产中的应用研究[J].河南农业大学学报,2001,35(S1):33-35.
[2]陈丛瑾,刘雄民,黎跃.香椿叶化学成分研究进展[J].广西林业科学,2010,39(4):231-234.
[3]李秀信,王建华,刘莉丽,等.微波辅助提取香椿叶黄酮工艺的研究[J].中国食品学报,2012,12(1):46-50.
[4]陈丛瑾,黄克瀛,杨过恩,等.香椿叶总黄酮的微波提取及其清除DPPH 自由基能力的研究[J].中国食品学报,2008,8(4):33-38.
[5]王昌禄,江慎华,陈志强,等.香椿老叶总黄酮提取工艺及其抗氧化活性的研究[J].北京林业大学学报,2008,30(4):28-33.
[6]师超,卞科.黄心甘薯多酚类物质的提取工艺研究[J].河南工业大学学报:自然科学版,2011,32(4):19-22.
[7]陶令霞,王浩,常慧萍,等.苹果皮渣中苹果多酚的超声辅助提取工艺优化及其抗脂质氧化活性研究[J].河南工业大学学报:自然科学版,2008,29(1):32-36.
[8]Chandra Mohan K V P,Gunasekaran P,Varalakshmi E,et al.In vitroevaluation of the anticancer effect of lacto-ferrin and tea polyphenol combination on oral carcinomacells[J].Cell Biology International,2007,31(6):599-608.
[9]王若兰,牛会敏,邓立阳,等.花生壳水溶性膳食纤维超声提取工艺响应面优化[J].河南工业大学学报:自然科学版,2013,34(1):6-11.
[10]梁丽琴,魏学智,段江燕,等.超声波辅助提取扁木叶蛋白的工艺优化[J].中国粮油学报,2012,27(12):96-100.
[11]赵二劳,史淑美,王迎进,等.黄芩多酚超声提取工艺优化及其抗氧化性研究[J].河南工业大学学报:自然科学版,2012,33(5):30-34.
[12]武宇芳,乔丽钧,赵二劳.大蒜提取物中总酚含量及其抗氧化活性研究[J].江西师范大学学报:自然科学版,2011,35(6):570-573.
[13]王储炎,艾启俊,范涛,等.鹿蹄草提取物抑菌活性的研究[J].现代食品科技,2011,27(1):26-28,5.

