乙酰二茂铁缩烟酰肼的合成及其晶体结构*
张首才,庄 茜,李惠茹,刘春玲
(吉林师范大学化学学院,吉林四平 136000)
Schiff碱与过渡金属离子络合形成的配合物具有抗癌、抗菌、抗肿瘤、抗结核等活性被广泛研究[1~4]。该类配合物还具有较高的催化活性、载氧性能和类似于 SOD 酶的生物活性[5~7]。在Schiff中引入二茂铁基,可使形成的二茂铁Schiff碱衍生物呈现出许多特别的性质。含二茂铁(FcH)基Schiff碱是二茂铁衍生物的一个热点领域,其中的C=N含有孤对电子容易与金属离子配位,形成结构新颖的配合物,体系中既有活性基团(二茂铁基),又有金属配体中心,定会赋予它更多的性质和更广泛的用途。
本文通过烟酸乙酯与肼反应得烟酰肼(2);2与乙酰二茂铁反应合成了一种新型的含二茂铁基Schiff碱——乙酰二茂铁缩烟酰肼(1,Scheme 1),其结构经1H NMR,IR,元素分析和 XRD表征。
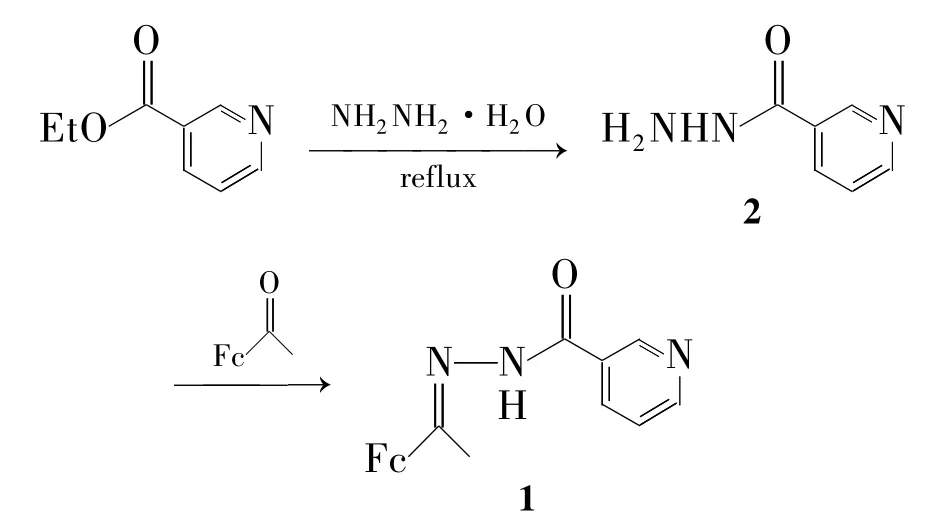
Scheme 1
1 实验部分
1.1 仪器与试剂
X-6型显微熔点仪(温度未校正);Varian Mercury 300型核磁共振仪(CDCl3为溶剂,TMS为内标);Spectrum Che型红外光谱仪(KBr压片);PE2400型元素分析仪;Bruker Apex CCD型X-射线衍射仪(XRD)。
乙酰二茂铁,分析纯,阿拉丁化学试剂有限公司;烟酸乙酯,分析纯,国药集团化学试剂有限公司;水合肼(85%),分析纯,天津市光复精细化工研究所;其余所用试剂均为分析纯,用前未经纯化处理。
1.2 合成
(1)2的合成
在反应瓶中加入烟酸乙酯6.05 g(40 mmol)和水合肼6 mL(60 mmol),搅拌下回流反应1.5 h。放置过夜,过滤,滤饼用冷乙醇(3×10 mL)洗涤,干燥得白色固体2 3.4 g,产率63%,m.p.141℃ ~142 ℃;1H NMR δ:7.81 ~8.43(d,J=7.6 Hz,4H,PyH),8.0(t,1H,NH),2.0(s,2H,NH2);Anal.calcd for C6H7N3O:C 52.56,H 5.13,N 30.59;found C 52.29,H 5.07,N 30.65。
(2)1的合成
在反应瓶中依次加入无水乙醇20 mL,2 0.137 g(1 mmol)及乙酰二茂铁 0.228 g(1 mmol),搅拌下回流反应2 h。冷却析晶,过滤,滤饼干燥得橙色粉末1 0.18 g,产率51%,m.p.192.7℃ ~194.8 ℃;用混合溶剂[V(乙醇)∶V(二氯甲烷)=1∶1]重结晶,避光放置一周得橙红色晶体 1;1H NMR δ:4.25(s,5H,Cp-H),4.56(s,2H,Cp-H),4.81(s,2H,Cp-H),7.0(s,1H,NH),0.90(s,3H,CH3),7.63(m,2H,PyH),9.17(m,2H,PyH);IR ν:3 412(N-H),1 726(C=O),1 667(C=N),1 474(C -C)cm-1;Anal.calcd for C18H17N3OFe:C 62.28,H 4.98,N 12.10;found:C 62.34,H 5.15,N 12.03。
1.3 晶体结构测定
将单晶 1(0.337 mm × 0.322 mm × 0.261 mm)置衍射仪上作晶体结构分析。用经过石墨单色化的 MoKα(λ =0.710 73 Å)作为射辐,于 293(2)K 在2.65°≤θ≤26.04°共收集 3 277 个独立衍射强度数据,其中2 995个为可观测点[I>2σ(I)],用多重扫描技术进行吸收校正。晶体结构用直接法解出(SHELXL-97)。用全矩阵最小二乘法进行精修,所有非氢原子进行各项异性修正。氢原子根据不同傅立叶电子密度图进行加氢。1的晶体学数据见表1。

表1 1的晶体学参数Table 1 Crystallographic data of 1
2 结果与讨论
2.1 表征
1的1H NMR分析表明,0.90处的单峰归属甲基氢,4.25~4.81处的多重峰是茂环氢的共振吸收,7.0处吸收峰是N-H中氢的共振吸收,7.63~9.17处的多重峰归属吡啶环上氢。1的IR分析指出,3 412 cm-1处吸收峰为N-H键的特征峰,3 166 cm-1处吸收峰归属为二茂铁环上H 的特征峰,与文献[8]值一致;1 726 cm-1处吸收峰是羰基的特征峰,1 667 cm-1处吸收峰是C=N键的特征峰,1 474 cm-1处吸收峰是二茂铁环特征吸收峰,说明产物为含二茂铁基的Schiff碱。
2.2 晶体结构
1的晶体结构见图1,主要键长和键角分别见表2和表3。从图1可见,在1分子结构中,每个二茂铁分子中的环戊烯环(茂环)构成一个平面,这两个平面几乎平行,其二面角为0.96°,最近的原子之间的距离为3.261 Å[C(10)-C(2)],表明上下两个茂环之间存在分子内面对面π-π堆积作用[9]。上下两个环戊烯面的距离为3.288 Å,其中Fe到取代茂环的距离为1.640 Å,到非取代环戊烯环的距离为1.648 Å,比取代环戊烯环到Fe的距离稍长些,这是由于有吸电子取代基团存在的缘故。Fe到取代茂环中碳原子的距离在2.012 Å~2.066 Å,到非取代茂环中碳原子的距离在2.011 Å~2.036 Å,比Fe到取代茂环中碳原子的距离稍短,说明二茂铁的分子结构受到了取代基的影响。取代茂 环 内 C - C 键 长在 1.393 Å ~ 1.442 Å,C -C -C键角在105.73°~110.35°;在非取代环戊烯环 内 C - C 键长 在 1.353 Å ~1.432 Å 内,C-C-C键角在 103.6°~ 111.7°,其平均值为107.97°,与文献[10~12]值相近。C(10)- C(11)的键长为1.480 Å,比一般的 C -C 单键的键长(1.540 Å)短,比孤立C=C双键(1.33 Å)长,具有明显的共轭特征。C(11)=N(2)键长为 1.261 Å,与文献[8]值相似,N(3)-N(2)键长为1.406 Å,N(3)-C(13)键长为1.353 Å,O(1)=C(13)键长为1.238 Å,比一般的 O=C 键长(1.19 Å ~1.23 Å)稍长。
1存在典型的分子内氢键[C(12)-H(12A)┈N(3)]和分子间氢键[C(17)-H(17A)┈(3)](图2和表4)。从图2可见,4个1的分子通过分子间氢键彼此相连,形成了环状结构。
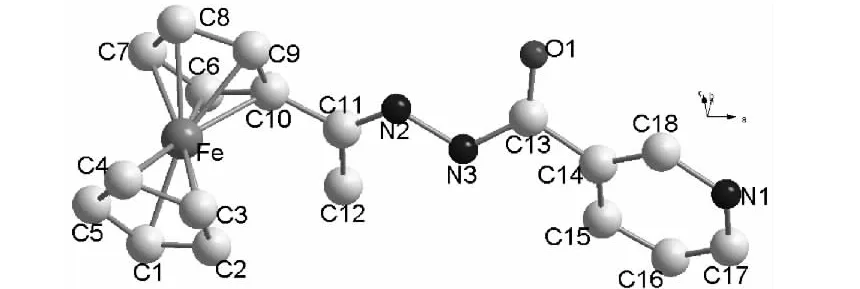
图1 1的晶体结构Figure 1 Crystal structure of 1
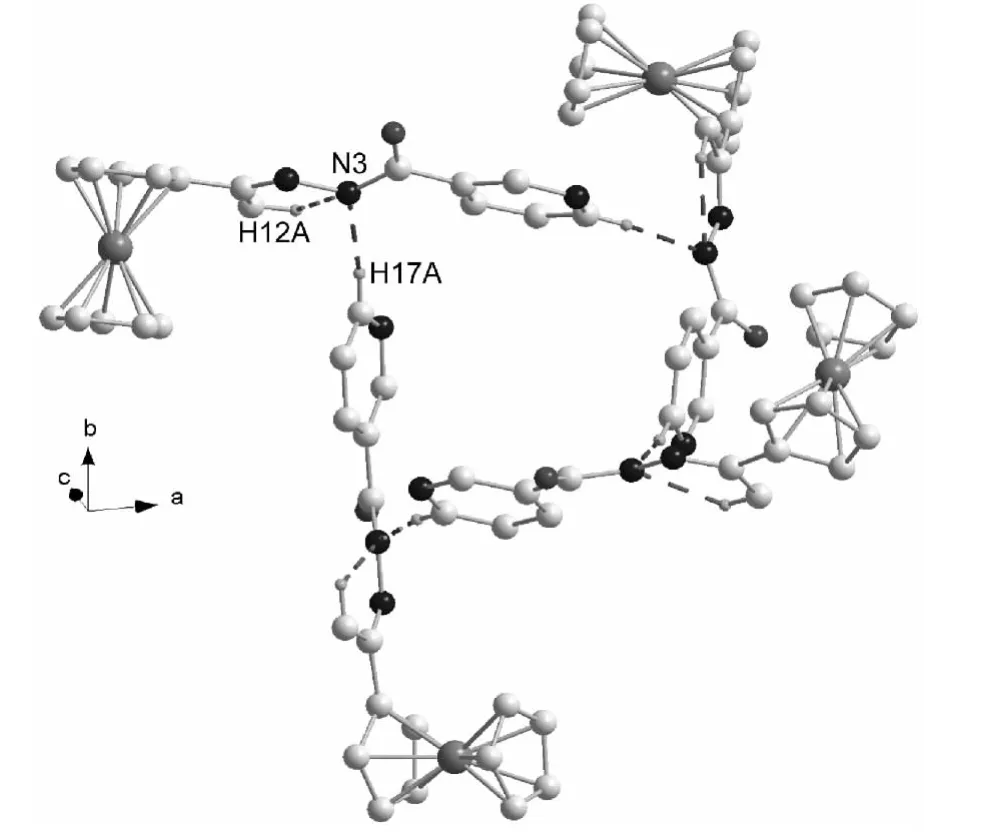
图2 1通过氢键形成环状结构Figure 2 Ring structure supported by hydrogen bonding of 1

表2 1的主要键长Table 2 Selected bond length of 1

表3 1的主要键角Table 3 Selected bond angle of 1

图3 1沿c轴方向的堆积图Figure 3 Packing diagram of 1
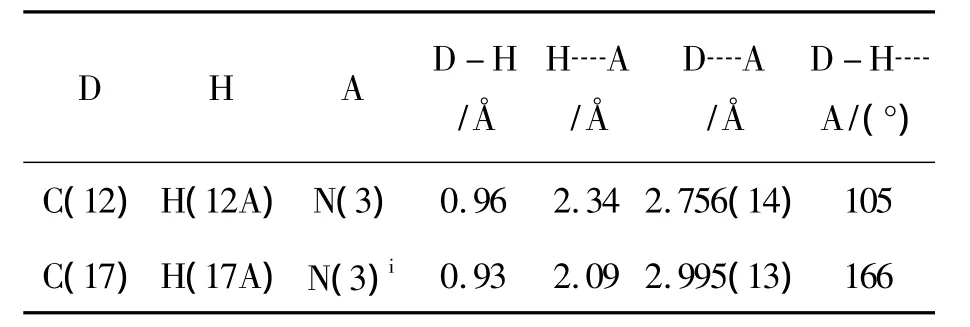
表4 1的氢键键长和键角Table 4 Hydrogen bond length and bond angle of 1
此外,二茂铁基团茂环的一条边与吡啶环之间存在弱的边到面的π…π堆积作用(图3)。分子间通过氢键以及π…π堆积作用形成了带有空洞的三维立体结构。如果类似π…π等弱的分子间作用能按照一定的规律定向排列,1将可能成为具有吸附、催化、储存、分离等重要性质的孔洞材料。
[1]Peiyi Li,Ian J Scowen.Co-ordination chemistry of bis(ferrocenylcarbaldimine)Schiff bases[J].Chem Soc Dalton Trans,1998,8:3791 -3799.
[2]F Ossola,P Tomasin,F Benetollo,et al.Synthesis,structure and properties of new ferrocene-containing compounds[J].Inorganica Chimica Acta,2003,353:292-300.
[3]Yao-Cheng Shi,Hua-Mei Yang,Hai-Bin Song,et al.Syntheses and crystal structures of the potential tridentate ligand formed from condensation of ferrocenoylacetone andS-benzyldithiocarbazate and its bivalent metal complexes[J].Polyhedron,2004,23:567 -573.
[4]Alexey M,Sheloumov.Suzuki aryl couping catalysed by palladium bis(phosphane)pincer complexes based on ferrocene:X-ray structure determination of PdCl{[2,5-(t-Bu2PCH2)2C5H2Fe(C5H5)]}Otf[J].Eur J Inorg Chem,2008:572 -576.
[5]Lai R Y,Fabrizio E F,Lu L,et al.Synthesis,cyclic voltammetric studies,and electrogenerated chemiluminescence of a new donors acceptor molecule:3,7-[Bis(4-phenyl-2-quinolyl)]-10-methylphenothiazine[J].Am Chem Soc,2001,123(37):9112 -9118.
[6]阎长泰.有机分析基础[M].北京,高等教育出版社,1999.
[7]Neuse E W,Meirim M G,Blom N F.Metallocenecontaining platinum complexes as potential antitumor agents.1.Dichloro(1,6-differrocenyl-2,5-diazahexane)platinum(Ⅱ)andcis-dichlorobis(1-ferrocenylethylamine)platinum(Ⅱ)[J].Ogranomeatllics,1988,7(12):2562-2565.
[8]Sun Y E,Zhang D D,Song H C.Synthesis and crystal structure of 4-[(1E)-(4-hydroxy-3,5-dimethoxybenzylidene)-amino]-1,5-dimethyl-2-phenyl-2,3-dihydro-1H-pyrazol-3-one[J].Chinese Sruct Chem,2007,26(5):511-514.
[9]Faiz Ullah Shah,Zareen Akhter,Humaira M,et al.Synthesis,structure and characterization of some Schiff bases bearing phenylferrocene[J].Appl Organometal Chem,2007,6(21):758 -762.
[10]李明雪,魏林恒,周静,等.双核二茂铁Schiff碱的合成、晶体结构和电化学性质[J].化学研究,2006,3(17):10 -12.
[11]Gang Li,Yinglin Song,Hongwei Hou,et al.Synthesis,crystal structures,and third-order nonlinear optical properties of a series of ferrocenyl organometallics[J].Inorg Chem,2003,42(3):913 -920.
[12]Zahid H,Chohanl,Praveen M.Synthesis,characterization and antibacterial properties of symmetric 1,1'-ferrocene derived Schiff-base ligands and their Co(Ⅱ),Cu(Ⅱ),Ni(Ⅱ)and Zn(Ⅱ)chelates[J].Appl Organometal Chem,2000,14:376 -382.

