蒽醌-2-甲酸烯烃类衍生物的合成*
孙志敏,周曼溪,陈广新,李齐方
(北京化工大学材料科学与工程学院化工资源有效利用国家重点实验室,北京 100029)
大多数蒽醌染料在可见光范围有很好地吸收,摩尔消光系数比较高,而且具有很好的光稳定性,长期以来被广泛地应用于纺织品的印染,蒽醌在太阳能电池材料中也得到广泛应用[1~3]。
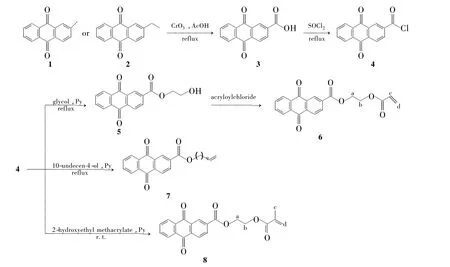
本文以2-甲基蒽醌(或乙基)蒽醌(1或2)为原料,经氧化、酰氯化、酯化等反应合成了3个烯基蒽醌衍生物——乙二醇-9,10-蒽醌-2-甲酸丙烯酸脂(6),蒽醌-2-甲酸-10-十一碳烯脂(7)和乙二醇蒽醌-2-甲酸甲基丙烯酸脂(8,Scheme 1),其结构经1H NMR表征。UV测试结果表明6~8在三氯甲烷中的λmax均为327 nm。
1 实验部分
1.1 仪器与试剂
SHIMADZU UV1800型紫外-可见分光光度计;Bruker AV-400型核磁共振仪(CDCl3为溶剂,TMS为内标)。
1(98%),2(97%),10-十一碳烯醇(97%),Alfa Aesar;三氧化铬(99.99%),天津市科技发展有限公司;其余所用试剂均为分析纯;THF使用前经钠干燥重蒸。
1.2 合成
(1)蒽醌-2-甲酸(3)的合成[4~6]
Scheme 1
在三口烧瓶中依次加入 1 3.6 g(16.2 mmol),CrO326.4 g(264 mmol)和冰醋酸 160 mL,搅拌下回流反应12 h(颜色从桔黄色变为深绿色)。冷却至室温(析出固体),抽滤,滤饼用蒸馏水洗涤至无色后,用丙酮洗涤,干燥得白色针状晶体 3 1.82 g,收率 47.4%;1H NMR δ:13.72(s,1H),8.68(s,1H),8.40 ~ 8.41(d,1H),8.31 ~ 8.32(d,1H),8.23 ~ 8.26(d,2H),7.96 ~7.98(dd,2H)。
以2-乙基蒽醌为原料,按类似反应制得3,收率 48.2%。
(2)蒽醌-2-甲酰氯(4)的合成[7]
在三口烧瓶中加入 3 3.6 g(14.3 mmol)和SOCl230 mL,搅拌下回流反应6 h(开始3不溶于SOCl2,随着反应进行,3逐渐溶解)。冷却,旋蒸脱溶后经硅胶柱层析[梯度洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=20∶1~3∶1]分离得白色片状晶体 4 3.2 g,收率 82.9%;1H NMR δ:9.12(s,1H),8.60 ~8.61(d,1H),8.54 ~8.55(d,1H),8.39 ~8.41(d,2H),7.89 ~7.90(dd,2H)。
(3)9,10-蒽醌-2-甲酸羟乙酯(5)的合成
在三口烧瓶中依次加入 4 3.2 g(11.8 mmol),乙二醇2.2 g(35.4 mmol),THF 40 mL 和吡啶2 mL,搅拌下回流反应2 h。冷却至室温,过滤(除去生成的吡啶盐酸盐),滤液旋蒸脱溶后经硅胶柱层析(梯度洗脱剂:A=5∶1~1∶1)纯化得淡黄色针状晶体5 2.8 g,收率71.0%;1H NMR δ:8.95(s,1H),8.45 ~ 8.47(d,1H),8.38 ~8.40(d,1H),8.33 ~ 8.36(m,2H),7.84 ~7.86(dd,2H),4.57(t,2H),4.06(t,2H),2.14(bs,1H)。
(4)6的合成
在三口烧瓶中依次加入5 2.0 g(6.7 mmol),THF 20 mL和吡啶1.5 mL,冰水浴冷却,搅拌下缓慢滴加丙烯酰氯0.7 g(7.7mmol)的 THF(10 mL)溶液,滴毕,撤去冰水浴,反应1 h。过滤,滤液旋蒸脱溶后经硅胶柱层析(洗脱剂:A=10∶1)纯化得淡黄色针状晶体6 1.4 g,收率58.8%;1H NMR δ:8.94(s,1H,ArH),8.43 ~8.44(d,1H,J=8.0 Hz,ArH),8.38 ~8.40(d,J=8.0 Hz,1H,ArH),8.33 ~ 8.35(m,2H,ArH),7.84 ~7.85(m,2H,ArH),6.47 ~6.50(d,J=17 Hz,1H,c-H),6.16 ~6.22(dd,J=10.4 Hz,1H,d-H),5.89 ~5.91(d,J=10.0 Hz,1H,d-H),4.66 ~4.67(t,2H,a-H),4.56 ~4.58(t,2H,b-H)。
(5)7的合成
在三口烧瓶中依次加入 4 3.2 g(11.8 mmol),10-十一碳烯醇 6.0 g(35.4 mmol),THF 40 mL和吡啶2 mL,搅拌下回流反应2 h。冷却至室温,过滤,滤液旋蒸脱溶后经硅胶柱层析(洗脱剂:A=10∶1)纯化得淡黄色针状晶体7 3.6 g,收率 75.3%;1H NMR δ:8.95(s,1H,ArH),8.44 ~8.46(d,J=8.3 Hz,1H),8.39 ~ 8.41(d,1H),8.33 ~8.37(m,2H),7.84 ~7.85(m,2H),5.79 ~ 5.85(m,1H),4.93 ~ 5.02(m,2H),4.40 ~4.43(t,2H),2.03 ~2.07(m,2H),1.45 ~1.49(m,2H),1.32 ~1.40(m,10H)。
(6)8的合成
在三口烧瓶中依次加入 4 3.2 g(11.8 mmol),吡啶 2.0 mL 和 THF 30 mL,搅拌下于室温缓慢滴加甲基丙烯酸羟乙酯1.5 g(35.4 mmol)的THF(10 mL)溶液,滴毕,反应5 h。过滤,滤液旋蒸脱溶后经硅胶柱层析(洗脱剂:A=5∶1)纯化得淡黄色针状晶体 8 2.8,收率 64.8%;1H NMR δ:8.96(s,1H,ArH),8.44 ~8.46(d,1H,ArH),8.40 ~8.42(d,1H,ArH),8.34 ~8.37(m,2H,ArH),7.85~7.87(m,2H,ArH),6.19(s,1H,d-H),5.64(s,1H,d-H),4.68 ~4.70(t,2H,a-H),4.55 ~ 4.57(t,2H,b-H),1.99(s,3H,c-H)。
2 结果与讨论
2.1 合成
合成3时选用了KMnO4/H2SO4和KMnO4/NaOH,基本无氧化产物。改用CrO3/AcOH作氧化体系,原料用1或2,反应时间12 h~24 h,3的收率均接近50%,所以选用CrO3/AcOH作氧化剂,回流反应12 h,结果见表1。1H NMR分析结果表明,3在13.72处为羧基质子,而6~8在5.8~6.5处为双键碳上的质子。
2.2 6~8的UV分析
6~8的UV谱图见图1。由图1可见,6~8均在327 nm处有较强的吸收,这可能是由于6~8的基本骨架相同,都含有蒽醌环,而双键与蒽醌环不共轭,所以表现出的主要是蒽醌环的吸收。
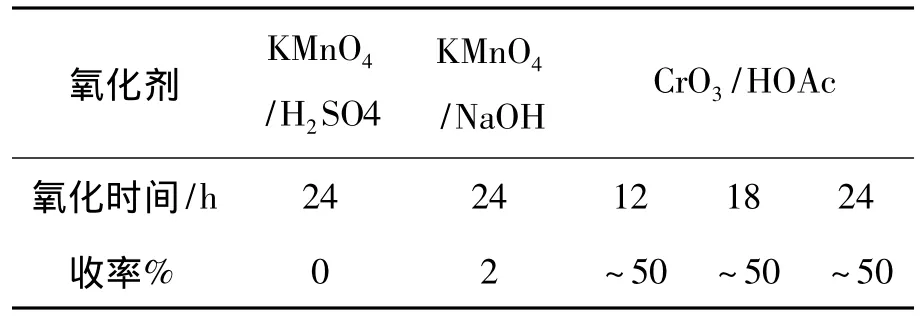
表1 氧化剂和氧化时间对3收率的影响Table 1 Effect of oxidant and time on the yield of 3
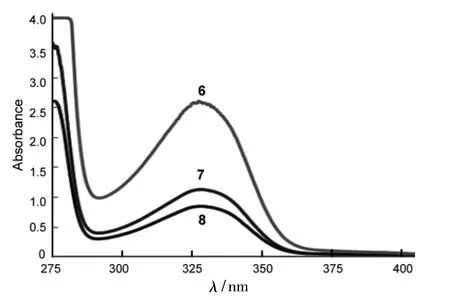
图1 6~8的UV谱图Figure 1 UV spectra of 6~8
3 结论
本文用简便的方法合成了三种带有双键的蒽醌衍生物,因其主体结构和官能团相同,所以紫外吸收峰位置非常接近。以这三种烯烃为单体的聚合工作正在进行中,并将以其作为太阳能电池材料进行相关性能的研究。
[1]Silvia Luzzati,Markus Scharber,Marinella Catellani,et al.Long-lived photoinduced charges in donor-acceptor anthraquinone-substituted thiophene copolymers[J].J Phys Chem B,2006,110:5351 -5358.
[2]Rafael Gomez,Raul Blanco,Dirk Veldman,et al.Synthesis and photophysical properties of conjugated polymers with pendant 9,10-anthraquinone units[J].J Phys Chem B,2008,112:4953 -4960.
[3]Jose L Segura,Rafael Gomez,Raul Blanco,et al.Synthesis and electronic properties of anthraquinonetetracyanoanthraquinodimethane and perylenetetracarboxylic diimide-functionalized poly(3,4-ethylenedioxythiophenes[J].Chem Mater,2006,18:2834 -2847.
[4]Arjunan Palanisamy,Berlin K Darrell.An improved synthesis of 2-anthraldehyde[J].Organic Preparations and Procedures International,1981,13(5):368 -371.
[5]Zagotto Giuseppe,Sissi Claudia,Moro Stefano,et al.Amide bond direction modulates G-quadruplex recognition and telomerase inhibition by 2,6 and 2,7 bis-substituted anthracenedione derivatives[J].Bioorganic and Medicinal Chemistry,2008,16(1):354 -361.
[6]Peng Yi Ru,Chen Kui Zhi,Wen Jia Bao,et al.Synthesis and photophysical properties of metal anthraquinone phthalocyanine[J].Chinese Chemical Letters,2007,18(5):509 -512.
[7]Gerald Zerza,Markus C Scharber,Christroph J Brabec,et al.Photoinduced charge transfer between tetracyano-anthraquino-simethane serivatives and conjugated polymers for photovoltaics[J].J Phys Chem A,2000,104(35):8315 -8322.

