口服避孕药对高FSH 不孕症患者子宫内膜容受性的影响
刘 锦 朱文杰周永红 付志红 李雪梅 唐雪莲
南方医科大学附属深圳市妇幼保健院生殖科(518000)
基础卵泡刺激素(FSH)是临床用于评估卵巢储备功能的重要指标之一,基础FSH升高提示卵巢的储备功能下降,是40岁以后女性的生理表现。但临床上常见有部分妇女在40岁之前就出现了FSH升高现象,表现为卵泡发育的速度异常,月经周期缩短,周期第10天甚至更早就发生了排卵,导致临床妊娠率下降,流产率增加[1]。目前治疗高FSH的常用方法是用口服避孕药反馈抑制垂体释放FSH,达到治疗的目的。研究表明口服避孕药预处理可以增加高FSH患者体外受精-胚胎移植的成功率[2],也有学者认为在使用口服避孕药过程中进行垂体降调节(称为“双压”方法)能抑制高FSH状态,但其效果存在争议。本研究通过观察口服避孕药治疗前后子宫内膜胞饮突、白血病抑制因子(LIF)、血管内皮生长因子(VEGF)、基质金属蛋白酶9(MMP9)、整合素β3等变化,探讨口服避孕药对高FSH患者子宫内膜容受性的影响。
1 资料与方法
1.1 研究对象
2011年12月~2012年8月,在本院就诊的不孕患者中,选择连续两个月经周期第3天血清FSH水平>10U/L的女性患者15例。病例纳入标准:年龄<40岁;月经周期正常,研究前3个月内无激素使用史及宫腔操作史,未放置宫内节育器。病例排除标准:多囊卵巢综合征、排卵异常、宫腔粘连或瘢痕、宫腔积液、内膜息肉、子宫内膜异位症或子宫肌腺症,及既往有血栓病史者。病例年龄 33.07±4.62岁,不孕年限4.55±3.34年,基础FSH水平18.53±5.96U/L,黄体生成素(LH)5.10±2.24U/L,雌二醇(E2)121.9±57.9pmol/L。体重指数(BMI)20.28±1.84kg/m2,月经周期 26.82±1.15d。本组研究经本院伦理委员会审查批准,所有患者均知情同意。
1.2 方法
1.2.1 排卵监测和分组 月经周期第8天开始,经阴道超声监测卵泡生长,当优势卵泡直径达14mm时,每天测卵泡大小及尿试纸法监测LH峰预测排卵。排卵后7d取子宫内膜标本(治疗前),下次周期月经第5天开始口服避孕药(妈富隆)1mg/d,连服21d,共3个周期。停药后第1个月经周期排卵后7天再次取子宫内膜标本(治疗后)。
1.2.2 标本采集及处理 ①采集方法:常规外阴阴道消毒,探宫腔,4~5号扩宫条扩张宫颈。将直径0.3cm的内膜取样器(GYNETICS公司,比利时)轻轻送入宫腔至6.5cm,外抽内芯约10cm长,负压吸取少量内膜组织。②标本处理:将吸取的内膜组织放入4℃生理盐水中快速洗去血污,并用干纱块吸去水分,一部分放入4%甲醛固定液中,用于病理检查及免疫组化测定子宫内膜容受性生化标记因子;另一部分放入2.5%戊二醛固定液中,用于扫描电镜观察子宫内膜胞饮突发育情况。
1.2.3 病理检查 子宫内膜标本按常规脱水、透明、浸蜡、包埋、切片并经 HE染色后,按病理学子宫内膜分期标准进行病理分期。
1.2.4 生化标记因子测定 免疫组化按照试剂盒步骤操作,一抗LIF、VEGF 及MMP9(BA1239、BA0407和BA0573,武汉博士德生物工程公司)按1∶50稀释,4℃冰箱过夜;滴加聚合 HRP-羊抗兔 IgG(SV0002,武汉博士德生物工程公司),37℃ 30min。标志物整合素β3热修复抗原后再用3%H2O2去离子水孵育10min,一抗整合素 β3(sc-6626,santa cruz biotechnology,美国)按1∶100稀释,4℃冰箱过夜,滴加试剂1(PV-9003,北京中杉金桥生物技术有限公司),室温20min,滴加试剂2(PV-9003,北京中杉金桥生物技术有限公司),室温20min。DAB(Tnvitrogen公司,美国)显色结果判定标准:阴性对照片用PBS代替一抗判读。显微镜(400×)下观察,选择5个视野,每个视野计数100个腺体细胞,分别读出其中阴性(-)、弱阳性(+)、阳性(++)和强阳性(+++)的细胞数。用组织学积分H-score方法进行半定量分析,计算公式:H-score=ΣPi(i+1),其中Pi代表每一免疫组化染色范围内同一染色强度的阳性细胞数占待测细胞总数的百分比,即Pi=阳性细胞数/待测细胞总数。i为染色强度,用1、2、3分别代表(+)、(++)、(+++),i=0时,染色阴性,组织学积分为0。
1.2.5 内膜表面胞饮突的数量及形态观察 内膜标本经梯度乙醇脱水、干燥和金属镀膜处理后,扫描电镜下每张片观察3个视野。计算内膜表面胞饮突的覆盖面积:丰富(>50%),中等(20% ~50%),少量(<20%)。胞饮突的形态分为发育期、完全发育期、退缩期。
1.3 统计学处理
2 结果
2.1 治疗前后内分泌激素及卵泡期的变化
口服避孕药治疗前后基础 FSH、LH、E2、孕酮(P)、睾酮(T)水平,黄体中期E2、P水平均无统计学差异。治疗后卵泡期天数长于治疗前(P<0.01),见表1。
2.2 治疗前后子宫内膜病理变化
治疗前15例标本显示分泌中期内膜9例,其余6例为增生期内膜(4例为增生反应内膜,2例呈增生-分泌反应内膜)黄体中期内膜变化与月经周期有9例(9/15)达到同步;治疗后15个标本均为分泌中期反应子宫内膜,内膜发育与月经周期均达到同步,治疗前后内膜与月经周期变化的同步性有差异(P<0.01)。
2.3 扫描电镜观察
治疗后胞饮突数量丰富,多为发育完全的胞饮突;治疗前胞饮突数量稍欠丰富,多处在发育中期和退缩期,治疗前后胞饮突形态有差异(P<0.05),但丰富程度无差异(P>0.05)。见表2,图1。
表115 例治疗前后内分泌激素水平及卵泡期天数比较()
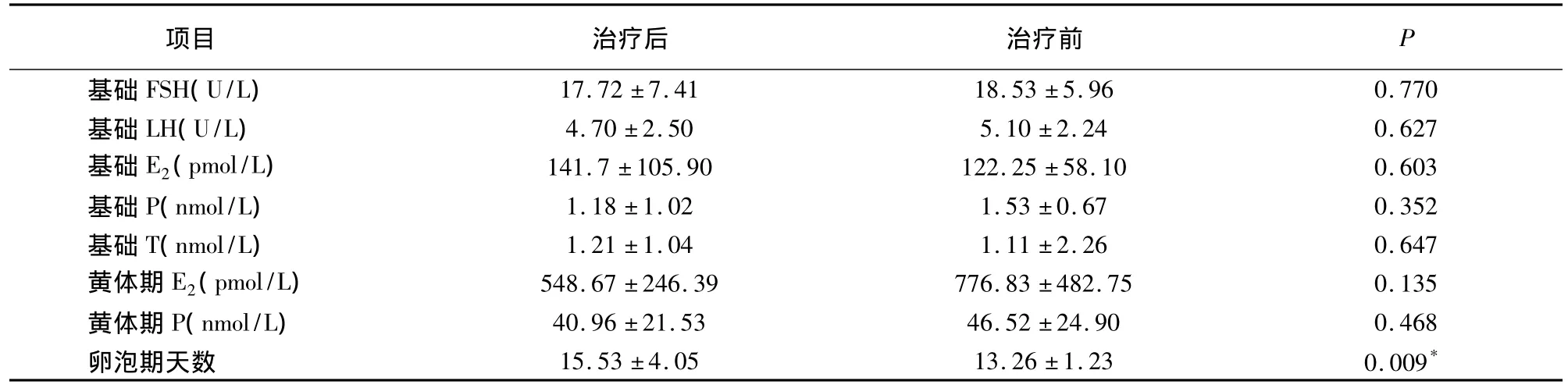
表115 例治疗前后内分泌激素水平及卵泡期天数比较()
*治疗前后比较P<0.01
项目 治疗后 治疗前P 17.72±7.41 18.53±5.96 0.770基础LH(U/L) 4.70±2.50 5.10±2.24 0.627基础E2(pmol/L) 141.7±105.90 122.25±58.10 0.603基础P(nmol/L) 1.18±1.02 1.53±0.67 0.352基础T(nmol/L) 1.21±1.04 1.11±2.26 0.647黄体期E2(pmol/L) 548.67±246.39 776.83±482.75 0.135黄体期P(nmol/L) 40.96±21.53 46.52±24.90 0.468卵泡期天数 15.53±4.05 13.26±1.23 0.009基础FSH(U/L)*

表2 治疗前后子宫内膜胞饮突数量和发育情况比较[个(%)]
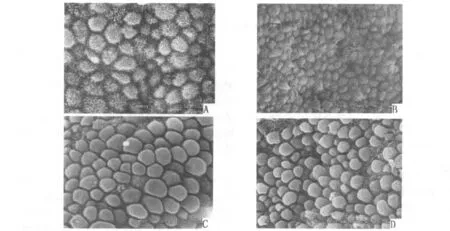
图1 不同发育阶段的胞饮突形态
2.4 内膜腺体LIF、VEGF、MMP9和整合素β3表达情况
治疗前后子宫内膜腺体LIF、整合素β3表达量差异有统计学意义(P<0.05);而内膜腺体VEGF、MMP9表达量无统计学差异(图2,表3)。
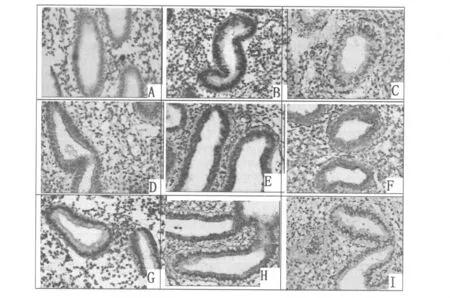
图2 子宫内膜LIF、整合素β3、MMP9和VFGF的表达
表3 治疗前后内膜腺体激素表达量比较(s)
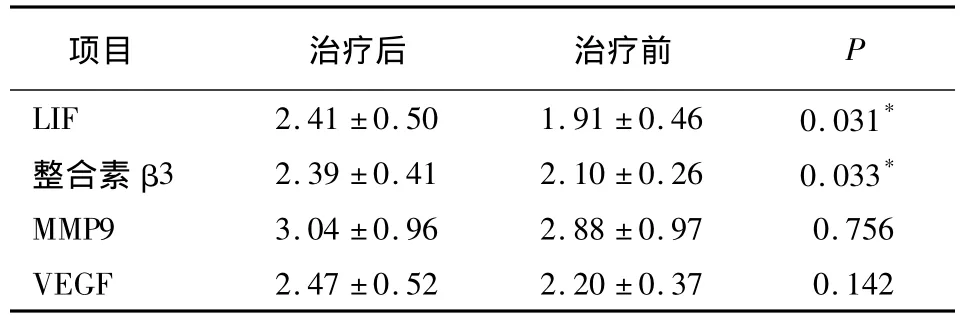
表3 治疗前后内膜腺体激素表达量比较(s)
*治疗前后比较P<0.05
项目 治疗后 治疗前P LIF 2.41±0.50 1.91±0.46 0.031*整合素β3 2.39±0.41 2.10±0.26 0.033*MMP9 3.04±0.96 2.88±0.97 0.756 VEGF 2.47±0.52 2.20±0.37 0.142
3 讨论
本组研究发现高FSH不孕患者常发生卵泡期缩短,甚至在月经周期第10天即发生排卵。黄体中期子宫内膜转化与月经周期不同步,有40%的黄体中期子宫内膜仍处于增生期,这将导致内膜容受性低下,胚胎种植困难。笔者认为,这可能是高FSH患者临床妊娠率低下,流产率升高的原因之一。
正常状态的子宫内膜仅在一个极短的关键时期内,即排卵后6~7d天(又称种植窗期)具有容受胚胎的能力。整合素、LIF、VEGF以及MMP9是众多研究公认的种植窗期子宫内膜容受性标记因子[3~10],而胞饮突则是形态学上的子宫内膜容受性标记物[11,12],本组研究选用上述意义明确的内膜容受性标记物,增加了研究结果的可信度。
口服避孕药是一种包含有雌孕激素的类固醇激素,能够通过负反馈抑制垂体FSH、LH的分泌,是临床治疗高FSH患者的常用药物。但是口服避孕药能否改善卵巢储备功能低下的不孕患者的内膜容受性尚未见文献报道。本组研究通过扫描电镜观察内膜胞饮突的发育状态,用免疫组化方法测定内膜容受性标记因子LIF、VEGF、MMP9、整合素β3的表达情况,结果表明口服避孕药治疗后子宫内膜生长转化与月经周期的同步性明显改善,短卵泡期状态得到了纠正,黄体中期(种植窗口期)完全发育胞饮突率增加,LIF、整合素β3的表达量增加,提示口服避孕药提高了高FSH患者的子宫内膜容受性。
早在1989年 Check等[13]就曾报道过1例35岁卵巢早衰,血FSH升高的女性不孕患者经过避孕药物治疗后成功受孕。甄秀梅等[14]在短方案体外受精-胚胎移植周期前用避孕药预处理,发现使用避孕药后基础FSH明显下降。本组资料表明,避孕药治疗后,基础FSH并无明显下降,这可能是由于本组研究使用避孕药的时间较长,卵巢储备功能低下随时间延长而加剧,基础FSH水平上升,掩盖了避孕药中雌孕激素成分反馈抑制FSH的作用。另外,血FSH水平还受早卵泡期小卵泡分泌的抑制素影响[15],口服避孕药不能改变卵巢的储备功能,因此不能改变小卵泡数和血FSH的上升。然而口服避孕药改善了内膜发育与月经周期的同步性,使得内膜容受性因子LIF、整合素β3表达增加,完全发育胞饮突比率增加,可能与其作用于下丘脑-垂体-卵巢轴,在一定程度上调整了月经周期,减少了卵泡过早发育有关。治疗后黄体中期血清E2和P水平下降,虽然没有统计学意义,但从另一侧面反映了口服避孕药治疗后卵泡发育或卵子质量变化的复杂性。另外,本组数据仅反应了3个月口服避孕药治疗后的第1个自然周期的状态,这种疗效能持续多久,尚有待进一步的观察和研究。
综上所述,高FSH不孕患者经口服避孕药治疗3个周期可调整月经周期,改善内膜发育与月经周期的同步性,提高子宫内膜容受性,有利于胚胎着床。
1 Levi AJ,Raynault MF,Bergh PA,et al.Reproductive outcome in patients with diminished ovarian reserve[J].Fertil Steril,2001,76(4):666-669.
2 Vilela M,Marconi M,Zappacosta MP,et al.Oral contraceptive(OCP)pretreatment achieves better pregnancy rates in in vtro fertilization(IVF)antagonists GnRH flexible protocols:a prospective randomized study[J].Fertil Steril,2011,96(suppl 3):252.
3 Kaneko Y,Lecce L,Day ML,et al. β(1)and β(3)integrins disassemble from basal focal adhesions and β(3)integrin is later localized to the apical plasma membrane of rat uterine luminal epithelial cells at the time of implantation[J].Reprod Fertil Dev,2011,23(3):481-495.
4 Li L,Xu BF,Chen QJ,et al.Effects of hydrosalpinx on pinopodes,leukaemia inhibitory factor,integrin β3 and MUC1 expression in the peri-implantation endometrium[J].Eur J Gynecol Reprod Biol,2010,151(2):171-175.
5 Serafini PC,Silva ID,Smith GD,et al.Endometrial claudin-4 and leukemia inhibitory factor are associated with assisted reproduction outcome[J].Reprod Biol Endocrinol,2009,19,7:30.
6 Xu B,Sun X,Li L,et al.Pinopodes,leukemia inhibitory factor,integrin-β3,and mucin-1 expression in the peri-implantation endometrium of women with unexplained recurrent pregnancy loss[J].Fertil Steril,2012,98(2):389-395.
7 Hammoda MA,Eid MA,EI-Srogy HA,et al.Assessment of leukemia inhibitory factor and glycoprotein 130 expression in endometrium and uterine flushing:a possible diagnostic tool for impaired fertility[J].BMC Women Health,2012,12(1):10.
8 Lockwood CJ,Oner C,Uz YH,et al.Matrix metalloproteinase 9(MMP9)expression in preeclamptic decidua and MMP9 induction by tumornecrosis factor α and interleukin β in human first trimester decidual cells[J].Biol Reprod,2008,78(6):1064-1072.
9 Li YF,Xu XB,Chen XH,et al.The nuclear factor-κB pathway is involved in matrix metalloproteinase-9 expression in RU486-induced endometrium breakdown in mice[J].Hum Reprod,2012,27(7):2096-2106.
10 Singh K,Nair RR,Khanna A.Functional SNP-1562C/T in the promoter region of MMP9 and recurrent early pregnancy loss[J].Reprod Biomed Online,2012,24(1):61-65.
11 Nikas G.Pinopodes as markers of endometrial receptivity in clinical practice[J].Hum Reprod,1999,14(Suppl 2):99-106.
12 Nejatbakhsh R,Kabir-Salmani M,Dimitriadis E,et al.Subcellular localization of L-selectin ligand in the endometrium implies a novel function for pinopodes in endometrial receptivity[J].Reprod Biol Endocrinol,2012,15(10):46.
13 Check JH,Chase JS,Spence M.Pregnancy in premature ovarian failure after therapy with oral contraceptives despite resistance to previous human menopausal gonadotropin therapy[J].AM J Obstet Gynecol,1989,160(1):114-115.
14 甄秀梅,乔杰,李蓉,等.雌二醇和口服避孕药在卵巢反应不良患者前期预处理中的作用[J].中国妇产科临床杂志,2011,12(2):112-115.
15 Gracia CR,Sammel MD,Freeman E,et al.Impact of cancer therapies on ovarian reserve[J].Fertil Steril,2012,97(1):134-140.

