宫颈病变程度与人乳头瘤病毒16型甲基化水平的关系研究
王海英
浙江省嘉兴市秀州区计划生育宣传技术指导站、妇幼保健院(314031)
宫颈癌是常见的妇科恶性肿瘤之一,而人乳头瘤病毒(HPV)持续感染是导致宫颈癌发生的主要致癌因子[1]。1995年世界卫生组织将HPV确定为宫颈癌的病因[2]。目前已经发现的100多种亚型中近40种能入侵生殖器官,其中 16、18、31、33、35 及58型等高危亚型的感染是女性宫颈癌的主要病因,尤其是16型,在所有宫颈癌中占比50%左右[3]。然而,并非所有的HPV感染都将导致宫颈癌,宫颈癌的形成一般需要经历HPV持续感染、癌前病变到癌症的过程[4]。因此,在感染HPV到宫颈癌发生之间进行及时的干预和治疗将会有效阻断病变的发生发展进程,减少癌症的形成,提高治愈率。传统的巴氏涂片、新柏氏液基细胞学技术(TCT)组织学检查、免疫组化技术等均存在诊断敏感性较差的问题[5,6]。越来越多的研究表明 HPV DNA 检测是一种经济、创伤性小并且敏感度高的筛查手段,但HPV感染的患者即使感染高危型其潜在的宫颈病变可能仍然较小[7]。因此,在HPV筛查的基础上还需有更好的分子标记来进一步评估患者在HPV感染后潜在的病变风险,以便临床医生能据此制定治疗方案。研究表明,HPV基因组表观遗传学如甲基化等的改变与宫颈病变存在一定的相关性,特别是L1基因的甲基化水平,在不同宫颈病变中存在差异[8]。本文选择感染比例最高的HPV16型,通过分析不同病变阶段的HPV16感染患者中HPV基因组L1基因开放阅读框以及上游调控区(URR)的甲基化水平,来评估HPV16型L1的区域甲基化水平与宫颈病变的相关性,以期发现除现有的HPV分型体系外更有效的评估HPV感染后潜在病变风险的指标。
1 材料与方法
1.1 标本来源
收集本院2012年2~8月进行宫颈病变筛查妇女的宫颈分泌物标本518例,所有患者均有性生活史,取材前3天内无阴道冲洗及无阴道用药史。
1.2 试剂与仪器
人乳头瘤病毒基因分型检测试剂盒、分子杂交仪(深圳亚能生物技术有限公司,中国);血清游离DNA提取试剂盒(北京金麦格生物技术有限公司,中国);PCR仪(Bio-Rad,美国);Taq酶等PCR扩增体系试剂盒(Fermentas,加拿大);DNA甲基化试剂盒 (Methylation-Gold KitTM,ZYMO公司,美国)。DNA聚合酶等PCR扩增体系试剂均购自美国Promega公司。
1.3 实验方法
1.3.1 CIN检查及HPV阳性病例筛查 对518例标本进行组织病理学检查,按Richart标准将宫颈上皮内瘤变(CIN)分为 CIN1、CIN2、CIN3三级,分别指轻、中、重度宫颈鳞状上皮非典型增生。病理医生行盲法阅片进行诊断,所有异常切片均由两位病理医生按Richart标准复核。HPV检测及分型从HPV DNA提取、PCR扩增、杂交检测到结果判读均按试剂盒说明书进行。
1.3.2 HPV16 DNA甲基化 使用血清游离DNA提取试剂盒,对筛选出的HPV16型阳性病例血清基因组DNA进行提取纯化。DNA的甲基化鉴定按照试剂盒说明书进行实验操作。在PCR管中添加130μl CT转化剂,加入20μl DNA样品,用移液器吹打混匀;PCR 条件为 98℃ 10min,64℃ 2.5h,4℃ 保存24h;反应完成后,添加600μl结合缓冲液到试剂盒的预装柱中,并将柱放入收集管中,加入反应液,盖上后将柱颠倒数次混合样品;10 000rpm/min离心30s,去除流出液;再按照试剂盒要求离心洗脱DNA。
1.3.3 HPV16型DNA PCR扩增及测序 HPV16型L1基因区域甲基化位点及其相应的PCR引物序列、退火温度、片段长度等见表1所示。PCR扩增体系为:5×Green GoTaq反应缓冲液 10μl,正向引物1μl,反向引物 1μl,DNA 5μl,dNTPs 0.4mmol/L,MgCl22mmol/L,DNA聚合酶2U,加无菌水至50μl;PCR扩增条件为:94℃ 3min;40个循环(94℃ 30s,退火30s,72℃ 30s);72℃ 3min(各片段引物退火温度见表1)。所有引物均由上海英潍捷基生物科技有限公司合成,反向引物均用生物素标记。所扩增的产物送基因工程上海有限公司进行焦磷酸测序及数据分析。
1.3.4 统计学处理 采用统计学软件SPSS 13.0录入相关数据后对不同宫颈病变程度的各位点甲基化水平分别进行两两χ2检验。
2 结果
2.1 组织病理学检查与HPV 分型检测
按Richart标准分级共获得CIN1标本46例,CIN2标本32例,CIN3标本18例以及宫颈癌标本9例,其余均无宫颈病变,检测阳性率20.3%。采用亚能HPV杂交分型试剂盒对518例样本进行基因分型,共获得阳性标本198例,阳性率38.2%,其中HPV16型单型阳性标本73例,占阳性标本数的36.9%。73例HPV16单型阳性标本中,无宫颈病变的37例,CIN1标本17例,CIN2标本9例,CIN3 标本7例以及宫颈癌标本4例。

表1 HPV16各甲基化位点所需PCR引物序列
2.2 宫颈病变各阶段HPV16阳性标本甲基化分析
不同宫颈病变阶段HPV16阳性标本各位点甲基化水平如表2所示。其中31,37,43,52,58位点在不同宫颈病变阶段的标本中呈现出一致性,即正常标本存在中度甲基化,CIN1~CIN3标本存在低度甲基化,而宫颈癌(CA)标本表现为高度甲基化;正常标本与CIN标本各位点甲基化水平两两比较差异具有统计学意义(P<0.05)。正常标本与CA标本各位点甲基化水平相比存在显著差异(P<0.05),同时,CIN标本与CA标本各位点甲基化水平相比较也存在显著差异(P<0.05),;而在CIN1,CIN2以及CIN3间甲基化水平无显著差异。3887、3927、3941以及5602位点甲基化水平随着宫颈病变程度的加深而升高,并且正常标本,CIN1、CIN2、CIN3、CA间两两比较均存在显著差异(P均 <0.05);5608、5709、5611、5617、5762、6367、6389 位点甲基化水平在正常标本和CIN1、CIN2和CIN3标本间无显著差异,但正常标本与CA标本以及CIN标本与CA标本间比较,甲基化水平差异具有统计学意义(P<0.05)。
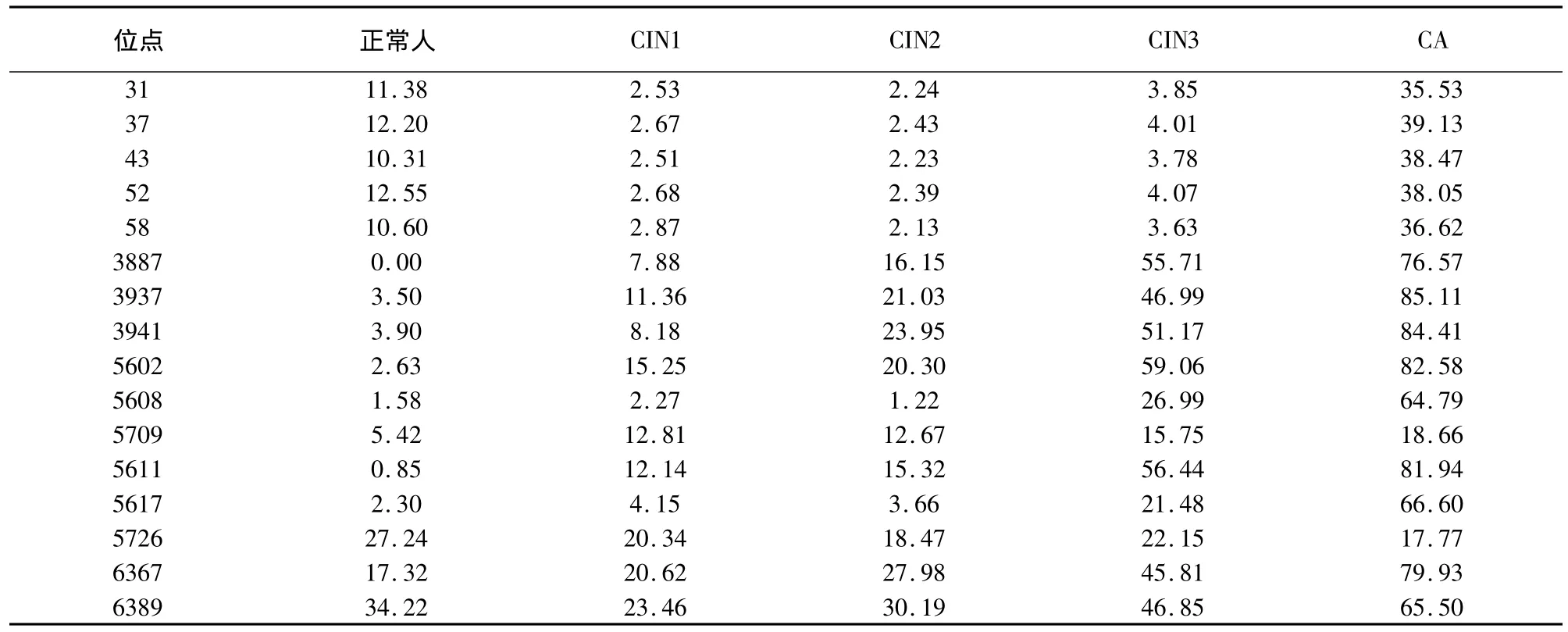
表2 不同宫颈病变阶段HPV16阳性标本各位点甲基化水平(%)
3 讨论
高危型HPV持续感染是宫颈癌发生的重要因素,但同样的HPV型感染后临床表现却大不相同。因此除了对HPV DNA进行基因差异及分型研究外,需要寻找其他导致这种差异的因素。基因甲基化表观遗传学改变是指针对DNA的修饰而非基因序列改变所导致的基因表达水平的变化[9]。近年来,众多研究证据表明,表观遗传学的改变可能是影响病毒毒性以及导致致病性差异的又一潜在因素[10~12]。为了研究HPV基因组甲基化水平与感染后宫颈病变程度的关系,本研究采用重硫酸盐-焦磷酸测序法对HPV16阳性的73例标本,包括无宫颈病变的37例、CIN1标本17例、CIN2标本9例、CIN3标本7例以及宫颈癌标本4例进行了L1基因ORF以及URR区域的CpG位点的甲基化水平定量分析。焦磷酸测序可对特定位点的甲基化水平进行定量分析,目前已广泛应用于基因甲基化的检测,经重亚硫酸盐处理后,无甲基化的C碱基被转化成T碱基,而甲基化修饰的则不变,因此通过测定C/T的单核苷酸多态性即可反映基因的甲基化水平。初步结果表明,各位点的甲基化水平与宫颈病变程度存在一定的相关性,但不同位点其表现形式存在一定的区别。据本研究的结果可将HPV16型DNA特定位点甲基化水平与宫颈病变程度的关系归纳为3种模式:模式 1 的位点包括 31、37、43、52、58,通过对这些位点的甲基化进行定量分析,可将疑似宫颈病变患者进行正常、CIN和CA的诊断,但不能对CIN各期进行具体划定;模式2的位点包括3887、3927、3941以及5602,由于这些位点在不同宫颈病变阶段其甲基化水平均存在显著差异,因此可作为宫颈病变分期的指标对标本进行正常、CIN1、CIN2、CIN3、CA之间的区分诊断;模式3的位点包括5608、5709、5611、5617、5762、6367、6389,根据这些位点的甲基化水平只能诊断是否为CA标本,而无法对癌前病变进行具体分级。
本文结果表明HPV16型L1基因区域特定位点的甲基化水平与宫颈病变程度间存在一定的相关性,HPV16型L1基因区域相关位点的甲基化定量分析可作为进行宫颈病变分级的一个潜在指标,与组织病理学诊断相比,该指标更显客观。但若在临床上推广应用则需要进行更多实验。本文主要对在HPV中占多数的16型进行了研究,而对于其他型别是否适用本文结论则需作进一步深入的研究。
1 Schiffman M,Castle PE,Jeronimo J,et al.Human papillomavirus and cervical cancer[J].Lancet,2007,370:890-907.
2 Bosch FX,Lorinezc A,Munoz N,et al.The causal relation between human papomavirus and cervieal cancer[J].J Clin Pathol,2002,55(4):244-265.
3 Li N,Franceschi S,Howell-Jones R,et al.Clifford GM.Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide:variation by geographical region,histological type and year of publication[J].Int J Cancer,2011,128:927-935.
4 Kalantari M,Villa LL,Calleja-Macias IE,et al.Human papillomavirus-16 and-18 in penile carcinomas:DNA methylation,chromosomal recombination and genomic variation[J].Int J Cancer,2008,123(8):1832-1840.
5 Spitzer M.In vitro conventional cytology historical strengths and current limitations[J].Obstet Gynecol Clin North Am,2002,29(4):673-683.
6 Trottier H,Mahmud S,Costa MC,et al.Human papillomavirus infections with multiple typesand risk of cervical neoplasia.Cancer Epidemiol.Biomark[J].Prev,2006,15(7):1274-1280.
7 Kinney W,Stoler MH,Castle PE.Special commentary:patient safety and the next generation of HPV DNA tests[J].Am J Clin Pathol,2010,134:193-199.
8 Fernandez AF,Esteller M.Viral epigenomes in human tumorigenesis[J].Oncogene,2010,29:1405-1420.
9 Burgers WA,Blanchon L,Pradhan S,et al.Viral oncoproteins target the DNA methyltransferases[J].Oncogene,2007,26:1650-1655.
10 Longworth MS,Wilson R,Laimins LA.HPV31 E7 facilitates replication by activating E2F2 transcription through its interaction with HDACs[J].EMBO J,2005,24:182l-1830.
11 Zhang B,Laribee RN,Klemsz MJ,et al.Human papillomavirus type 16 E7 protein increases acetylation of histone H3 in human foreskin keratinocytes[J].Virology,2004,329:189-198.
12 Kalantari M,Calleja-Macias IE,Tewari D,et al.Conserved methylation paRems of human papillomavirus type 16 DNA in asymptomatic infection and cervical neoplasia[J].2004,78:2762-2772.

