酵母细胞提取物依赖NO信号途径提高杭白菊抗氧化活性
陈 倩,陈尊委,徐竑珂,杨凤霞,符孟娜,李盛超,王慧中,徐茂军
(杭州师范大学生命与环境科学学院,浙江杭州310036)
0 引 言
药用植物的疗效高低是决定中药材品质优劣的基础.传统中医药学在长期临床和生产实践中发现,在药用植物生长过程中光照、温度等外界环境因子对疗效品质的影响是一种十分普遍的现象[1-2].这表明在药用植物体内存在着可被外界环境因子激活的疗效品质形成自然调控机制.显然,理解这一机制的作用原理,将为研究开发药用植物疗效品质调控新技术提供重要的理论依据.
现代药理学研究表明,药用植物中黄酮、生物碱等次生代谢产物是决定中药材疗效品质的主要物质[3-4].药用植物次生代谢产物的合成是由细胞核内相关基因控制的复杂生物化学反应过程.虽然环境因子可以影响次生产物的含量,但是作为外界刺激因子其本身并不直接参与次生产物的合成反应,因此在药用植物细胞中必然存在着相应的机制介导外界环境因子对胞内相关次生代谢反应的促进作用.根据现代生命科学领域中的细胞信号转导理论,不难推测在药用植物细胞中应该存在着特定的次生代谢信号转导途径,外界环境因子通过激活细胞内相关次生代谢信号途径,进而对细胞核内次生代谢相关基因的表达进行调控,促进次生产物的合成积累,最终影响中药材的疗效品质[5-6].
一氧化氮(NO)是植物中一种重要信号分子[7].近年来,国内外不少研究者对NO在介导光照、温度、诱导子等外界因子促进长春花、金丝桃等药用植物细胞次生活性物质合成积累中的信号调控作用进行了系统的研究,发现:1)光照(UVB)、温度(高温热激)、诱导子等外界处理不仅可以促进金丝桃等药用植物细胞药效物质的合成积累,还可以显著提高细胞内源NO水平[8-10],说明外界因子在诱发药效物质合成的同时也激活了胞内NO信号转导途径;2)NO信号抑制剂可以阻断细胞中NO信号转导作用,同时还可以抑制外界因子对细胞中药效物质合成的促进作用,而且NO抑制剂对外界因子诱发药效合成的抑制作用可以被外源NO逆转[8-10].上述研究结果不仅证实了光照、温度等环境因子通过激活胞内NO信号转导途径促进药效物质合成积累的作用机制,同时提示内源NO是药用植物药效品质形成的一个新的调控位点:即通过调控细胞内源NO水平,可以激活药用植物相关调控机制,改善中药材疗效品质,这无疑为药用植物品质调控提供了一种新的思路.
NO合成与积累是植物在逆境胁迫下的一种普遍现象[11].虽然前期研究表明,紫外光照射、高温、干旱等逆境处理均可以显著提高拟南芥等植物细胞内源NO水平[7,9-11],但是由于逆境胁迫往往对植物生长发育产生严重的影响,因此在生产实践中难以利用逆境胁迫激活药用植物内源NO信号途径,促进次生产物合成积累.最近,笔者发现酵母细胞壁多糖提取物可以诱导桃果实中NO迸发[12],因此提出了以下研究设想:以酵母提取物处理药用植物,诱发细胞内源NO迸发,进而激活细胞内的相关调控机制,提高药用植物的疗效品质.
杭白菊是浙江省著名的道地药材.据统计,2012年仅桐乡市的杭白菊产量就占全国产量的80%.现代药理学研究表明,杭白菊具有抗氧化以及解热、明目、抑菌等功效,其中抗氧化作用是杭白菊的主要功效之一[13].本文拟以杭白菊为材料,考查酵母提取物(YE)对杭白菊抗氧化活性的影响,并探讨NO在介导酵母提取物提高杭白菊药效功能中的作用,验证上述研究设想.
1 材料与方法
1.1 试验材料
供试材料为目前杭白菊主栽品种小洋菊.
酵母粗提物购自湖州礼来生物技术有限公司(产品编号:LM801H),按前文[12]方法制备实验用酵母提取物.
1.2 试验地点
试验在浙江省桐乡市屠甸镇进行,试验土壤的理化性质如下:pH6.7,有机质21.1g/kg,全氮0.881 g/kg,有效磷16.2mg/kg,速效钾104.5mg/kg.
1.3 杭白菊栽培管理
试验采用大田栽培,畦宽1.5m,每穴2株,5 000株/亩,穴距15cm.4月15日定植,5月16日第一次压条,7月15日第二次压条,6月10日和7月11日两次打顶.按照杭白菊栽培管理要求进行常规的施肥、除草和病虫害防治.
1.4 试验处理
1.4.1 YE不同施用时期对杭白菊抗氧化活性的影响
试验设为4个不同的时期:苗期(5月5日)、分枝期(7月20日)、现蕾期前(9月10日)、现蕾期(9月20日).
每个处理的小区面积为15m2.配制0.4g/L YE溶液,按照300mL/m2用量均匀喷洒于苗叶片,对照组施用相同体积的蒸馏水.当杭白菊头状花序中心小花60%开放时,采取杭白菊样品,测定总还原力、·OH清除率和DPPH清除率.每个处理重复3次.
1.4.2 YE不同用量对杭白菊抗氧化活性的影响
试验设置0.1,0.2,0.3,0.4,0.5g/L 5种不同的YE浓度,同时设置空白(对照).
以现蕾期前杭白菊为材料,每个处理的小区面积为15m2.配制0.1~0.5g/L YE溶液,按照300 mL/m2用量均匀喷洒于苗叶片.当杭白菊头状花序中心小花60%开放时,取样测定样品的总还原力、·OH清除率和DPPH清除率.每个处理重复3次.
1.4.3 YE对杭白菊内源NO水平的影响
现蕾期前以0.4g/L YE处理杭白菊,处理后1,2,3,4d分别取顶端第2~3叶片测定NO含量,以空白为对照.
1.4.4 NO淬灭剂对杭白菊内源NO含量及药效组分含量的影响
试验设为3组:1)0.5mmol/L cPTIO+0.4g/L YE;2)0.4g/L YE;3)空白.
现蕾期前以0.5mmol/L cPTIO处理杭白菊,60min后再施以0.4g/L YE,处理后1,2,3,4d分别取顶端第2~3叶片测定NO含量.同时按照上述杭白菊采收标准分别采取处理组和对照组杭白菊(花)样品,测定样品的总还原力、·OH清除率和DPPH清除率.
1.5 测定方法
1.5.1 抗氧化活性测定
样品提取液制备:杭白菊花经105℃杀青15min、60℃烘干至恒重后研磨成粉状过100目筛,装袋备用.精密称量0.25g干粉,用25mL的70%乙醇溶液超声提取30min,过滤收集滤液,所得各滤液即各样品提取液.
1.5.1.1 总还原力[14-15]
分别吸取1.0mL不同浓度的样品溶液于10mL比色管中,加入0.2mol/L pH6.6的磷酸缓冲液2.5mL,再加入1%的铁氰化钾溶液2.5mL,摇匀后于50℃水浴中保温30min,加入10%的三氯乙酸2.5mL终止反应.取此溶液2.5mL,加入2.5mL的蒸馏水和0.5mL 0.1%的FeCl3溶液,充分混匀后静置30min,700nm处测定吸光度.
1.5.1.2 ·OH清除率[16]
在25mL容量瓶中分别加入2mmol/L FeSO4溶液5mL,6mmol/L H2O2溶液5mL混匀,用6mmol/L水杨酸钠定容,36℃水浴15min,冷却后在510nm处测定吸光度A1.在上述体系中加入一定量提取液,36℃水浴15min,510nm处测其吸光度A2,按下式计算·OH清除率:清除率=(A1-A2)/A1×100%.
1.5.1.3 DPPH清除率[17]
分别吸取4.0mL不同浓度的样品溶液于10mL的比色管中,加入1.0mL 1mmol/L的DPPH溶液(无水乙醇配置),摇匀后于暗室中反应30min,517nm处测定吸光度.同时测定维生素C、合成抗氧化剂TBHQ对DPPH自由基的清除率作为对比,按下式计算DPPH清除率:DPPH清除率={1-(A1-A2)/A0}×100%.其中:A1为加提取液后DPPH溶液的吸光度;A2为提取液的吸光度;A0为未加提取液时DPPH溶液的吸光度.
1.5.2 NO含量测定
依据NO与氧合血红蛋白(HbO2)反应生成高铁血红蛋白(MetHb)的原理,利用分光光度法测定氧合血红蛋白(HbO2)因捕捉NO而发生的吸光度变化以表征样品中NO含量[18].通过测定消光系数为77mm-1cm-1(A401,HbO2,A421MetHb)时401,421nm处的吸光度值来确定氧合血红蛋白(HbO2)转化成高铁血红蛋白(MetHb)的量,从而计算NO的产生量[18].具体操作步骤如下:分别取实验组及对照样品(150mg鲜质量)于研钵中,加入液氮、经预冷处理的100mmol/L钾-磷酸盐缓冲液(pH=7.0)及0.6%的聚乙烯吡咯烷酮迅速研磨成匀浆提取物,在提取物中加入活性炭后于4℃、11 000r/min下离心10min,取上清液经0.45μmol/L聚四氟乙烯微孔膜过滤得样品待测液,并按文献[18]方法测定NO量.
1.6 统计分析方法
实验采用完全随机设计,运用SPSS软件进行数据分析.所有数值均为3次独立平行实验的平均值±SE.采用t-test检测实验中每个处理组与对照组之间的差异显著性,采用Tukey test检测多个处理之间的差异显著性.方差分析中P<0.05为差异有统计学意义.
2 结果与讨论
2.1 YE对杭白菊抗氧化活性的影响
2.1.1 YE不同使用时期对杭白菊抗氧化活性的影响
分别在杭白菊苗期、分枝期、现蕾期前期、现蕾期按300 mL/m2用量喷施YE(0.4g/L),并测定杭白菊样品的总还原力、·OH清除率和DPPH清除率,以考查YE不同使用时期对杭白菊抗氧化活性的影响.试验结果表明,在分枝期、现蕾期前期、现蕾期施用YE均可显著提高杭白菊总还原力、·OH清除率和DPPH清除率,其中以现蕾期前期和现蕾期使用效果最好(图1).由于现蕾前期使用YE对杭白菊生长及产量无不利影响(表1),因此在后继试验中选用现蕾前期作为YE处理时期.

表1 YE对杭白菊生长及产量性状的影响Tab.1 Effects of YE on growth of C.morifolium
在植物细胞培养研究中,酵母提取物是一种常用的诱导子.研究表明,将酵母诱导子添加到肉苁蓉细胞悬浮培养液中,能显著提高抗氧化活性成分苯乙醇苷的含量[19].张向东等用酵母提取物瞬时诱导黄芩悬浮细胞中的齐墩果酸和熊果酸的合成[20].此外,酵母诱导子还可以显著提高山柏、人参等悬浮细胞中次生活性物质的含量[21-22].本文首次报道了酵母提取物可以提高大田栽培杭白菊抗氧化活性,为酵母提取物在药用植物栽培生产实践中的运用提供了直接的实验依据.
2.1.2 YE不同使用量对杭白菊抗氧化活性的影响
为进一步考查YE使用浓度对杭白菊抗氧化活性的影响,笔者分别以0,0.1,0.2,0.3,0.4,0.5g/L YE处理现蕾前期杭白菊,并测定不同处理杭白菊的抗氧化活性.试验结果表明,0.2,0.3,0.4,0.5g/L YE处理均可以显著提高杭白菊总还原力、·OH清除率和DPPH清除率(图2),其中以0.4g/L YE处理效果最佳.与对照相比,现蕾前期使用0.4g/L YE可以使杭白菊总还原力、·OH清除率和DPPH清除率分别提高100.1%、151.7%、88.7%.

图1 YE不同使用时期对杭白菊总还原力(a)、 ·OH清除率(b)和DPPH清除率(c)的影响Fig.1 Effects of different applying time on total reducing power(a),·OH scavenging capacity(b)and DPPH scavenging activity(c)of C.morifolium
2.2 YE依赖NO信号途径提高杭白菊抗氧化活性
2.2.1 YE对杭白菊内源NO的激活作用
由图3可见,YE处理可以快速诱发杭白菊内源NO迸发,在处理1d后杭白菊内源NO水平升高到对照的5倍,说明YE可以激活杭白菊内源NO信号转导途径.
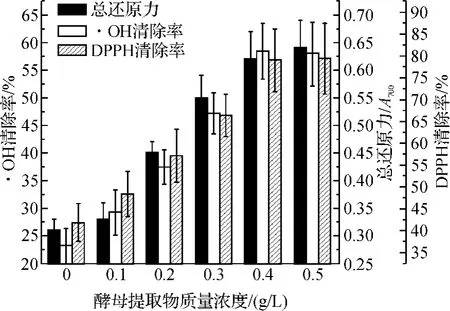
图2 YE使用浓度对杭白菊抗氧化活性的影响Fig.2 Effects of YE concentrations on the antioxidant capacities of C.morifolium

图3 YE及NO淬灭剂对杭白菊NO水平的影响Fig.3 YE-induced endogenous NO burst of C.morifolium
2.2.2 YE诱发杭白菊药效组分合成积累对NO信号途径的依赖性
为了进一步考查YE诱发杭白菊抗氧化活性对NO信号转导途径的依赖性,测定了NO淬灭剂对YE处理的杭白菊中总还原力、·OH清除率和DPPH清除率的影响.cPITO是一种NO专一性淬灭剂,被广泛用作植物中NO信号途径的高效抑制剂[23].本文试验结果表明,在YE处理前60min以0.5mmol/L cPTIO对杭白菊进行预处理可以完全抑制YE对杭白菊内源NO水平的提高作用(图3),说明cPTIO预处理可以阻断杭白菊内源NO信号转导作用.进一步研究表明,cPTIO预处理可以显著抑制YE对杭白菊总还原力、·OH清除率和DPPH清除率的促进作用,而cPTIO处理组和对照组杭白菊的总还原力、·OH清除率和DPPH清除率无显著差异(图4),说明cPTIO本身对杭白菊抗氧化活性没有影响.

图4 NO淬灭剂对YE诱导杭白菊抗氧化性的抑制作用Fig.4 Inhibition of the NO scavenger on YE-enhanced antioxidant capacities of C.morifolium.
上述试验结果表明,NO淬灭剂预处理在阻断杭白菊内源NO信号途径的同时也抑制了YE对杭白菊抗氧化活性的促进作用,说明NO是YE诱发杭白菊抗氧化活性提高所必需的信号分子.
综上所述,本文试验结果证实YE可以激活并依赖NO信号途径促进杭白菊抗氧化活性的提高.
[1]焦晓林,高微微.环境因子对药用植物三萜皂苷合成影响的研究进展[J].中草药,2011,42(2):398-403.
[2]曾燕,郭兰萍,杨光,等.环境生态因子对药用植物皂苷成分的影响[J].中国实验方剂学杂志,2012,18(17):313-318.
[3]方雪玲,王锡田,黄淑如,等.杭白菊对小牛血管平滑肌细胞凋亡及其抗氧化性研究[J].浙江大学学报:医学版,2002,31(5):347-351.
[4]茅慧玲,王佳堃,安培培,等.饲喂杭白菊茎叶对生长羔羊生长性能和血清抗氧化指标的影响[J].动物营养学报,2010(5):1402-1406.
[5]Xu Maojun.Nitric oxide:apotential key point of the signaling network leading to plant secondary metabolite biosynthesis[J].Progress in Natural Science,2007(17):1397-1404.
[6]黄璐琦,肖培根,郭兰萍,等.分子生药学:一门新兴的边缘学科[J].中国科学C辑:生命科学,2009,39(12):1101-1110.
[7]Neill S J,Desikan R,Hancock J T.Nitric oxide signalling in plants[J].New Phytologist,2003,159(1):11-35.
[8]Xu Maojun,Dong Jufang,Zhang Xinbo.Signal interaction between nitric oxide and hydrogen peroxide in heat shock-induced hypercin production ofHypericumperforatumsuspensioncells[J].Science in China Series C:Life Science,2008,51(8):676-686.
[9]Xu Maojun,Dong Jufang,Zhu Muyuan.Nitric oxide mediates the fungal elicitor-induced hypericin production ofHypericumperforatumcell suspension cultures through a jasmonic acid-dependent signal pathway[J].Plant Physiology,2005,139(2):991-998.
[10]Zhang Ming,Dong Jufang,Jin Haihong,etal.Ultraviolet-B-induced flavonoid accumulation inBetulapendulaleaves is dependent upon nitrate reductase-mediated nitric oxide signaling[J].Tree Physiology,2011,31(8):798-807.
[11]Wendehenne D,Klessig D F,Durner J.Nitric oxide:a new player in plant signalling and defense responses[J].Current Opinion in Plant Biology,2004,7(4):449-455.
[12]Yu Qin,Chen Qian,Chen Zunwei,etal.Activating defence responses and reducing postharvest blue mold decay caused byPenicillium expansumin peach fruit by yeast saccharide[J].Postharvest Biology and Technology,2012,74:100-107.
[13]戴敏,刘青云,李道中,等.菊花解热、降压作用的物质基础研究[J].中药材,2001,24(7):505-507.
[14]莫开菊,柳圣,程超.生姜黄铜的抗氧化活性研究[J].食品科学,2006,27(9):110-114.
[15]Oyaizu M.Studies on products of browning reactions:antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44:307-315.
[16]Smirnoff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[17]Hatano T,Kagawa H,Yasuhara T,etal.Two new flavonoids and other constituents in licorice root:their relative astringency and radical scavenging effects[J].Chemical and Pharmaceutical Bulletin,1988,36:2090-2097.
[18]Pasqualini S,Meier S,Gehring C,etal.Ozone and nitric oxide induce cGMP-dependent and-independent transcription of defense genes in tobacco[J].New Phytologist,2009,181(4):860-870.
[19]魏涛,成喜雨,杨秋婷,等.酵母诱导子对肉苁蓉细胞悬浮培养影响的研究[J].北京联合大学学报:自然科学版,2005,19(3):69-73.
[20]张东向,李康,姚娜,等.诱导子对黄芩悬浮细胞系的影响[J].北方园艺,2007(4):194-196.
[21]周倩耘,周建民,刘峻,等.诱导子对人参毛状根中皂苷含量的影响[J].南京军医学院学报,2003(2):76-78.
[22]张瑞芬,李培琴,周立刚.真菌诱导子对植物培养物生长和次生代谢产物合成影响之研究进展[J].中国农学通报,2008,24(9):260-264.
[23]Tian Qiuying,Sun Donghua,Zhao Mingui,etal.Inhibition of nitric oxide synthase(NOS)underlies aluminum-induced inhibition of root elongation inHibiscusmoscheutos[J].New Phytologist,2007,174(2):322-331.

