β-淀粉样多肽自聚集抑制剂的电化学筛选方法研究
张琳,林亲录*,阳明辉
(1.中南林业科技大学稻谷及副产物深加工国家工程实验室,湖南长沙410004)
(2.中南林业科技大学食品科学与工程学院,湖南长沙410004)
(3.中南大学化学化工学院,湖南长沙410083)
0 引言
β-淀粉样多肽(Amyloid-β,Aβ)是阿尔茨海默(Alzheimer’s disease,AD)病人脑中老年斑的主要成分[1~2]。Aβ由39~43个氨基酸残基组成[3]。由于Aβ是两亲性多肽,所以在一定的条件下Aβ可发生自聚集。其过程为:Aβ由无规则的α螺旋结构转化为具有β折叠结构的寡聚体(oligomer);接着,这些寡聚体和单体又相互聚集,快速形成纤维前体(protofibril);然后,Aβ单体和寡聚体在已经生成的纤维前体表面和两端继续聚集,形成光滑、成熟的纤维(fibril)[4]。这些不同阶段的聚集物都具有一定的神经细胞毒性,会引起一系列的发病级联,从而造成神经元的损伤、甚至死亡,导致AD病发[5]。因此抑制Aβ自聚集,从而抑制Aβ毒性聚集物的出现,是治疗AD病的重要途径[6~7]。
能够抑制Aβ自聚集的化合物被称为Aβ自聚集抑制剂[8~11]。目前Aβ自聚集的抑制剂分为两类:一类是基于Aβ自聚集的多肽片段(KLVFF)的多肽型抑制剂[12];另一类是从计算机分子数据库中筛选出来的,或者是由动植物中提取出来的小分子化合物[13~15]。在数以千万计的多肽和小分子化合物中,能够快速、简便的筛选出对Aβ自聚集有抑制效果的抑制剂,对于AD病的治疗有着重要的指导意义。
1 Aβ自聚集抑制剂的筛选存在的挑战
由于Aβ自聚集的速度快,因此利用常规的检测手段无法确定抑制剂的作用对象(单体、寡聚体、纤维前体或纤维)[16];另外,要确定化合物是否对Aβ自聚集有抑制效果,需要进行长时间的观测(一般为24~48 h),并且需要昂贵的检测仪器[17~18]。因此面对数以千万计的化合物,对筛选Aβ自聚集抑制剂的方法的要求是,快速、简便、灵敏、廉价。
2 筛选Aβ自聚集抑制剂的常规方法
目前,筛选Aβ自聚集抑制剂的方法主要分为两大类:一类是检测化合物是否能与Aβ结合。常用筛选方法有:利用计算机模拟技术(例如分子动力学模拟技术,molecular dynamics simulations,MD)计算化合物与Aβ的结合位点[19~20];利用表面等离子体激光共振(surface plasmon resonance,SPR)技术检测化合物与Aβ的结合常数[21]等[22]。但此类方法一般要结合其他检测手段,才能确定能够与Aβ结合的化合物是否能抑制Aβ自聚集。另外一类,是动态的实时检测化合物与Aβ混合溶液的理化性质,与相应的Aβ溶液相比较,从而确定该化合物是否对Aβ自聚集有抑制效果。常用的筛选方法有利用荧光指示剂(比如硫黄素t,ThT)检测纤维形成的荧光法[23]、利用成像技术(电镜、原子力显微镜等)检测Aβ聚集物形貌的成像法[24~25]和电化学检测法[26]等。
2.1 计算机模拟技术筛选Aβ自聚集抑制剂
通过计算机模拟技术可得到化合物与Aβ结合位点以及结合的能量信息[13,27]。通过这些信息,可预测该化合物是否可与Aβ结合,但尚需要通过其他实验手段(比如荧光指示剂ThT检测纤维的生成、AFM检测不溶性聚集物的生成等)来验证化合物是否能够抑制Aβ的自聚集过程[28]。因此,计算机模拟技术只能对化合物起到初步筛选的作用[28]。目前此种方法大部分用于Aβ自聚集抑制剂的初步筛选和Aβ抑制剂抑制Aβ自聚集的机理研究方面。
2.2 SPR技术筛选Aβ自聚集抑制剂
SPR技术可以得到化合物与Aβ的结合常数,根据结合常数,可以判断该化合物与Aβ的结合强度[29]。但化合物可以与Aβ结合并不意味着可抑制Aβ自聚集。所以,与计算机模拟技术类似,还需要利用其它检测手段来确定该化合物是否是Aβ自聚集的抑制剂。例如,用空间排阻色谱(size exclusion chromatography,SEC)来检测化合物与Aβ结合后,水溶性聚集物(水溶性寡聚体)的产生是否受到抑制;利用原子力显微镜或者扫描电子显微镜(scanning electron microscope,SEM),检测不溶性聚集物(不溶性寡聚体、纤维前体和纤维)的产生是否受到抑制[21]。但SPR的检测芯片为金膜,在金膜上组装Aβ或者Aβ自聚集的多肽片段,步骤繁琐。此外,多肽在金膜表面有非特异性吸附,为了避免非特异吸附引起的SPR信号的变化对结果造成干扰,芯片需要进行封闭。因此利用该方法不仅筛选速度慢,并且过程繁琐、需要的试剂和仪器都比较昂贵。为了提高筛选效率,基于SPR技术的高通量的微阵列技术(microarray)被引入到Aβ自聚集抑制剂的研究中来[30]。但与单通道或者双通道的SPR技术类似,微阵列技术只能检测到化合物是否能与Aβ结合,并不能确定该化合物是否能抑制Aβ自聚集的过程。
2.3 ThT荧光技术筛选Aβ自聚集抑制剂
ThT可以插入到Aβ纤维的β折叠中,从而特异性的与Aβ纤维前体和纤维结合。同时,插入β折叠中的ThT的荧光信号会大大增强[31]。基于这一原理,ThT被用来动态监测Aβ溶液中纤维的形成,并用于Aβ自聚集抑制剂的筛选[32]。该方法的缺陷是只能检测到Aβ自聚集后期,纤维前体或者纤维的生成,而在Aβ聚集前期,Aβ单体和可溶性的Aβ寡聚体无法用ThT检测到。研究发现,可溶性的Aβ寡聚体具有比纤维更高的神经细胞毒性[33]。因此利用ThT荧光法来筛选Aβ自聚集抑制剂,只能筛选到可抑制Aβ纤维生成的抑制剂,并不能得到可抑制Aβ可溶性寡聚体生成的抑制剂。
2.4 成像技术筛选Aβ自聚集抑制剂
成像技术(电镜、原子力显微镜等)可以实时检测溶液中不溶性、纳米级的聚集物的形态[34]。通过对聚集物形态的检测,可确定抑制剂是否可以抑制Aβ自聚集。与ThT荧光技术类似,该技术无法检测到Aβ自聚集前期,可溶性的Aβ寡聚体或者Aβ单体。Aβ单体不具神经细胞毒性,可溶性寡聚体具有较强的神经细胞毒性[33]。因此无法分辨Aβ单体和寡聚体,就无法分辨该抑制剂是否有抑制Aβ神经细胞毒性的作用。
2.5 电化学技术筛选Aβ自聚集抑制剂
电化学方法简单、灵敏,可实时检测化合物对Aβ自聚集的抑制过程,故电化学方法在筛选Aβ自聚集抑制剂方面具有广泛的应用[35~36]。电化学方法筛选Aβ自聚集抑制剂,是从利用电化学方法检测Aβ自聚集的过程中发展起来的[37]。Vestergaard等[38]在2005年首先利用玻碳电极,通过检测Aβ十位上酪氨酸(tyrosine,Tyr)的电化学信号,实时检测了Aβ(1-42)和Aβ(1-40)的自聚集过程(图1)。该工作发现,随着Aβ(1-42)/Aβ(1-40)自聚集的进行,Tyr的电化学信号会随之降低。导致Tyr电化学信号降低的原因有两方面:一方面,Aβ(1-42)/Aβ(1-40)自聚集生成沉淀,导致可溶性Aβ浓度的降低;另一方面,由于Aβ(1-42)/Aβ(1-40)自聚集过程中二级结构的变化,导致Tyr上电子转移到电极表面的速率降低。因此通过对Tyr电化学信号的实时检测可以得到Aβ自聚集的动态信息。由于Tyr的电化学信号较弱,并且在Aβ自聚集的过程中不稳定,因此直接利用该方法筛选Aβ自聚集抑制剂有一定的困难,且容易出现异常结果,导致结论出现偏差[39]。
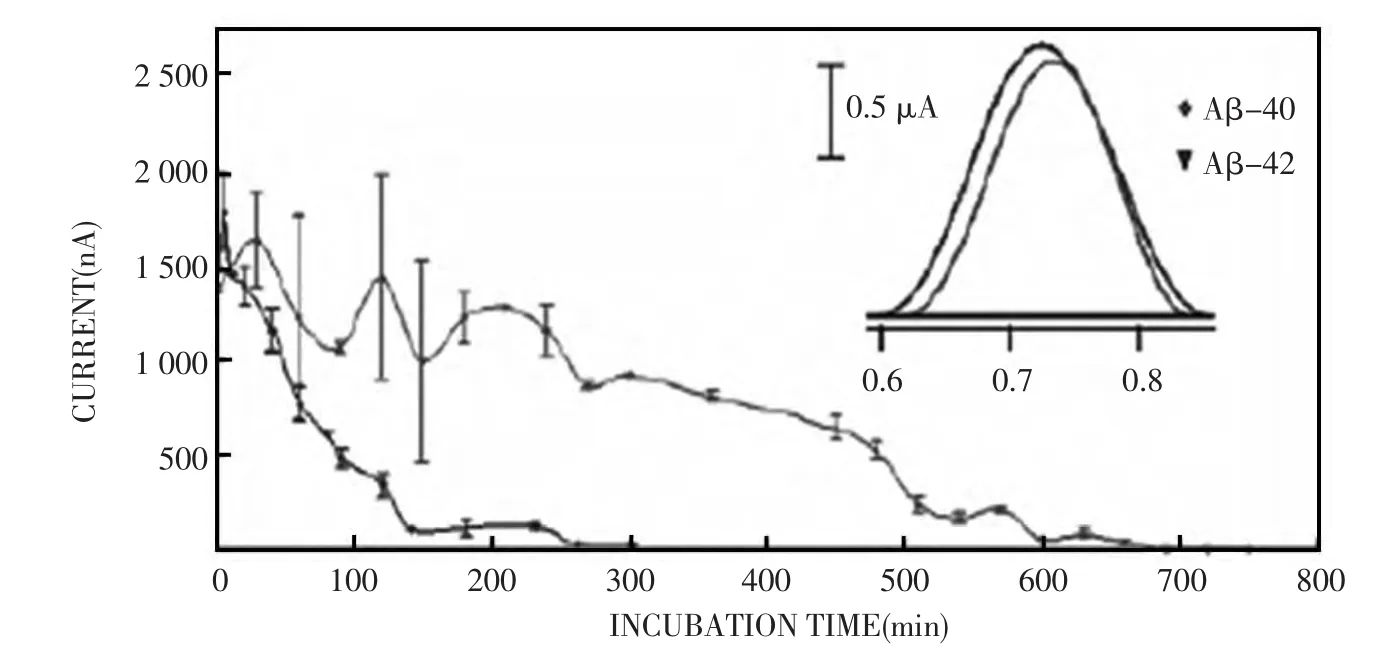
图1 方波伏安法实时检测Aβ(1-42)(红色曲线)和Aβ(1-40)(蓝色曲线)的自聚集过程Fig.1 Kinetic study of Aβ(1-42)(red line)and Aβ(1-40)(blue line)aggregation,using SWV.Inset:Voltammograms of native Aβ(1-42)(red line)and Aβ(1-40)(blue line)
针对该问题,Fuente等[40]利用碳纳米管修饰玻碳电极,使修饰后的电极具有更好的导电性,从而提高了检测Tyr电化学信号的灵敏度和稳定性,并实时检测了多肽型抑制剂(LPFFD)对Aβ自聚集的抑制过程(图2)。该研究发现,Aβ自聚集时,产生的聚集物会导致溶液中Tyr电化学信号的降低。而LPFFD可有效抑制Aβ聚集物的形成、降解已经形成的Aβ聚集物,使溶液中Tyr的电化学信号升高。基于此种原理,该方法可以用于筛选Aβ自聚集的多肽型抑制剂。

图2 LPFFD降解Aβ聚集物的电化学检测图(插图:电镜检测)Fig.2 Disaggregation of Aβ(1-42)by LPFFD.Aβ(1-42)was allowed to aggregate at 28℃until the electrochemical signal was undetectable.Afterwards,the solution was incubated in the presence(■)or absence(◇)of LPFFD at roomtemperature
全长的Aβ(1-42)/Aβ(1-40)价格昂贵,利用其进行Aβ自聚集抑制剂的筛选成本较高,不适合大规模的筛选。另外,Tyr处于Aβ(1-42)的第十位,在Aβ聚集物的外侧,并不包裹在Aβ聚集物中[41],因此直接检测Tyr的电化学信号并不能真实的反应抑制剂对Aβ自聚集过程的抑制作用。为了避免这个问题,Kraatz课题组在金电极上组装Aβ自聚集片段(Aβ(12-28)),利用电化学阻抗法进行Aβ自聚集抑制剂的筛选[42](图3)。该研究发现,当Aβ自聚集抑制剂与Aβ紧密结合时,金电极表面被抑制剂和Aβ的络合物紧密包裹,溶液中铁氰化钾离子较难扩散到达电极表面,从而引起电极阻抗值增大;与之相反,Aβ纤维的荧光指示剂(刚果红)可以插入Aβ分子之间,使Aβ分子间的空隙增大、溶液中离子容易渗透到电极表面,从而导致检测到的电极阻抗值降低。基于这种原理,通过检测电极阻抗值的大小就可以快速、简便的筛选出Aβ自聚集抑制剂。该种方法缩短了Aβ的序列,使筛选Aβ自聚集抑制剂的成本得到了降低。但是要将Aβ片段组装在金电极表面,需要对Aβ片段进行修饰,并且步骤冗杂。
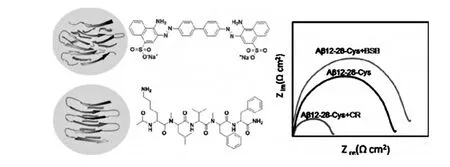
图3 金电极上修饰的Aβ(12-28)与β-折叠阻断肽(BSB)结合后的电极阻抗值(蓝色曲线),与刚果红(CR)结合后的电极阻抗值(红色曲线)Fig.3 Faradic impedance spectra of Aβ(12-28)peptide film interaction with β-sheet breaker(BSB)peptide(blue line)or Congo red(CR)(red line)
上述的筛选Aβ自聚集抑制剂的方法非常适合于筛选多肽型抑制剂,但是当抑制剂自身也具有电化学信号时,上述的方法无法将溶液中被测的具有氧化还原活性的物质(Tyr和铁氰化钾)和抑制剂区分开,从而使抑制剂的电化学信号影响检测结果。
近来,Zhang等[43]利用二茂铁(ferrocene,Fc)标记的Aβ自聚集片段(Fc-KLVFFAE)模拟全长Aβ自聚集的过程。Fc的引入,大大提高了Aβ自聚集片段的电化学信号,使电化学检测更容易进行。同时,该工作利用高效液相色谱与电化学联用技术(HPLC-EC)检测了小分子抑制剂——姜黄素对Aβ(Fc-KLVFFAE)自聚集过程的抑制作用。由于姜黄素含有酚羟基,具有电化学活性,因此利用常规的、直接的电化学方法并不能检测到其抑制Fc-KLVFFAE自聚集的过程。因此HPLC的引入,可将Fc-KLVFFAE与姜黄素有效的分离,再利用恒电位法检测溶液中可溶性的Fc-KLVFFAE的电化学信号,就可实时检测姜黄素抑制Fc-KLVFFAE自聚集的过程(图4)[43]。该方法可用于筛选具有电化学活性的Aβ自聚集抑制剂。

图4 电化学方法检测不同时间内Fc-KLVFFAE溶液(a)和Fc-KLVFFAE/姜黄素混合溶液中(b)可溶性Fc-KLVFFAE的浓度Fig.4 Variations of Fc-KLVFFAE concentrations in solutions of Fc-KLVFFAE(curve a)and a Fc-KLVFFAE/curcumin mixture(curve b)over different incubation times
3 结语
近年来,随着AD患者的增多,AD病的治疗药物逐渐受到人们的关注。作为潜在的治疗AD病的药物——Aβ自聚集抑制剂,其研究也受到AD研究领域的重视。由于小分子化合物和多肽抑制剂数量众多,快速、简便的筛选Aβ自聚集抑制剂的方法也不断涌现出来。目前应用较多的筛选方法是计算机模拟技术、SPR技术、荧光技术、成像技术及电化学技术。电化学方法简单、灵敏、快速,在对Aβ自聚集抑制剂的筛选中扮演着重要的角色。虽然筛选Aβ自聚集抑制剂的方法有了很大的发展,但是筛选出的抑制剂能否作为治疗AD病的药物,运用于临床还需要进一步的研究和探索。
[1]Hardy J A,Higgins G A.Alzheimer's disease:the amyloid cascade hypothesis[J].Science,1992,256:184~185.
[2]Selkoe D J.Alzheimer's disease is a synaptic failure[J].Science,2002,298:789~791.
[3]Selkoe D J.The molecular pathology of Alzheimer's disease[J].Neuron,1991,6:487~498.
[4]Xu Y C,Shen J J,Luo X M,et al.Conformational transition of amyloid beta-peptide[J].Proc.Natl.Acad.Sci.U.S.A.,2005,102:5 403~5 407.
[5]Irie K,Murakami K,Masuda Y,et al.Structure of betaamyloid fibrils and its relevance to their neurotoxicity:Implications for the pathogenesis of Alzheimer's disease[J].J.Biosci.Bioeng.,2005,99:437~447.
[6]Hardy J,Selkoe D J.Medicine-The amyloid hypothesis of Alzheimer's disease:Progress and problems on the road to therapeutics[J].Science,2002,297:353~356.
[7]Yang F S,Lim G P,Begum A N,et al.Curcumin inhibits formation of amyloid beta oligomers and fibrils,binds plaques,and reduces amyloid in vivo[J].J.Biol.Chem.,2005,280:5 892~5 901.
[8]Soto C,Kindy M S,Baumann M,et al.Inhibition of Alzheimer's amyloidosis by peptides that prevent betasheet conformation[J].Biochem.Biophys.Res.Commun.,1996,226:672~680.
[9]Lorenzo A,Yankner B A.Amyloid fibril toxicity in Alzheimer's disease and diabetes[J].Ann.N.Y.Acad.Sci.,1996,777:89~95.
[10]Koo E H,Lansbury P T,Kelly J W.Amyloid diseases:Abnormal protein aggregation in neurodegeneration[J].Proc.Natl.Acad.Sci.USA,1999,96:9 989~9 990.
[11]Schenk D,Barbour R,Dunn W,et al.Immunization with amyloid-beta attenuates Alzheimer disease-like pathology in the PDAPP mouse[J].Nature,1999,400:173~177.
[12]Estrada L D,Soto C.Disrupting beta-amyloid aggregation for Alzheimer disease treatment[J].Curr.Top.Med.Chem.,2007,7:115~126.
[13]Gupta S,Fallarero A,Jarvinen P,et al.Discovery of dual binding site acetylcholinesterase inhibitors identified by pharmacophore modeling and sequential virtual screening techniques[J].Bioorg.Med.Chem.Lett.,2011,21:1 105~1 112.
[14]Hawkes C A,Ng V,McLaurin J.Small molecule inhibitors of Ab aggregation and neurotoxicity[J].Drug Develop.Res.,2009,70:111~124.
[15]Diaza J C,Simakovaa O,Jacobsonb K A,et al.Small molecule blockers of the Alzheimer Aβ calcium channel potently protect neuronsfrom Aβ cytotoxicity[J].Proc.Natl.Acad.Sci.U.S.A.,2009,106:3 348~3 353.
[16]Tjernberg L O,Naslund J,Lindqvist F,et al.Arrest of beta-amyloid fibril formation by a pentapeptide ligand[J].J.Biol.Chem.,1996,271:8 545~8 548.
[17]Klunk W E,Jacob R F,Mason R P.Quantifying Aβ aggregation using the Congo red Aβ(CR-Aβ)spectrophotometric assay[J].Anal.Biochem.,1999,266:66~76.
[18]Matsumura S,Shinoda K,Yamada M,et al.Two distinct amyloid beta-protein(Aβ)assembly pathways leading to oligomers and fibrils identified by combined fluorescence correlationspectroscopy,morphology,andtoxicity analyses[J].J.Biol.Chem.,2011,286:11 555~11 562.
[19]Convertino M,Vitalis A,Caflisch A.Disordered Binding of Small Molecules to Aβ(12-28)[J].J.Biol.Chem.,2011,286:41 578~41 588.
[20]Chini M G,Scrima M,Ursi A M D,et al.Fibril aggregation inhibitory activityof the β-sheet breaker peptides:a molecular docking approach[J].J.Pept.Sci.,2008,15:229~234.
[21]Cairo C W,Strzelec A,Murphy R M,et al.Affinity-based inhibition of beta-amyloid toxicity[J].Biochemistry,2002,41:8 620~8 629.
[22]Look G C,Jerecic J,Cherbavaz D B,et al.Discovery of ADDL-Targeting Small Molecule Drugs for Alzheimer's disease[J].Curr.Alzheimer Res.,2007,4:562~567.
[23]Findeis M A,Musso G M,Arico-Muendel C C,et al.Modified-PeptideInhibitorsofAmyloid-Peptide Polymerization[J].Biochemistry,1999,38:6 791~6 800.[24]Gordon D J,Sciarretta K L,Meredith S C.Inhibition of beta-amyloid(40)fibrillogenesis and disassembly of beta-amyloid(40)fibrils by short beta-amyloid congeners containing N-methyl amino acids at alternate residues[J].Biochemistry,2001,40:8 237~8 245.
[25]Stine W B,Dahlgren K N,Krafft G A,et al.In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis[J].J.Biol.Chem.,2003,278:11 612~11 622.
[26]Zhang L,Yagnik G,Peng Y,et al.Kinetic studies of inhibitionoftheAβ(1-42)aggregationusinga ferrocene-tagged β-sheet breaker peptide[J].Anal.Biochem.,2013,434:292~299.
[27]Stempler S,Levy-Sakin M,Frydman-Marom A,et al.Quantitative structure–activity relationship analysis of β-amyloid aggregation inhibitors[J].J.Comput.Aided.Mol.Des.,2011,25:135~144.
[28]Karlsson D,Fallarero A,Brunhofer G,et al.Identification andcharacterizationofdiarylimidazolesashybrid inhibitors of butyrylcholinesterase and amyloid beta fibril formation[J].Eur.J.Pharm.Sci.,2012,45:169~183.
[29]Cheng X R,Sze Hung V W,Scarano S,et al.Label-free methods for probing the interaction of clioquinol with amyloid-β[J].Anal.Methods,2012,4:2 228~2 232.
[30]Chen J,Armstrong A H,Koehler A N,et al.Small MoleculeMicroarraysEnabletheDiscoveryof Compounds That Bind the Alzheimer's A beta Peptide and Reduce its Cytotoxicity[J].J.Am.Chem.Soc.,2010,132:17 015~17 022.
[31]Reinke A A,Gestwicki J E.Insight intoAmyloid Structure Using Chemical Probes[J].Chem.Biol.Drug Des.,2011,77:399~411.
[32]Santo R D,Costi R,Crucitti G C,et al.Design,Synthesis,andStructure-ActivityRelationshipofNArylnaphthylamine Derivatives as Amyloid Aggregation Inhibitors[J].J.Med.Chem.,2012,55:8 538~8 548.
[33]Lambert M P,Barlow A K,Chromy B A,et al.Diffusible,nonfibrillar ligands derived from Aβ(1-42)are potent central nervous system neurotoxins[J].Proc.Natl.Acad.Sci.U.S.A.,1998,95:6 448~6 453.
[34]Poduslo J F,Howell K G,Olson N C,et al.Alzheimer's Disease Amyloid β-Protein Mutations and Deletions That Define Neuronal Binding/Internalization as Early Stage Nonfibrillar/Fibrillar Aggregates and Late Stage Fibrils[J].Biochemistry,2012,51:3 993~4 003.
[35]Li H,Xie H,Cao Y,et al.A General Way to Assay Protein by Coupling Peptide with Signal Reporter via SupermoleculeFormation[J].Anal.Chem.,2013,85:1 047~1 052.
[36]Zhang B,Cheng X R,da Silva I S,et al.Electroanalysis of the interaction between(-)-epigallocatechin-3-gallate(EGCG)and amyloid-β in the presence of copper[J].Metallomics,2013,5:259~264.
[37]Loksztejna A,Dzwolak W,Krysiński P.Tyrosine side chains as an electrochemical probe of stacked β-sheet protein conformations[J].Bioelectrochemistry,2008,72:34~40.
[38]Vestergaard M,Kerman K,Saito M,et al.A rapid labelfree electrochemical detection and kinetic study of Alzheimer's amyloid beta aggregation[J].J.Am.Chem.Soc.,2005,127:11 892~11 893.
[39]Veloso A J,Kerman K.Modulation of fibril formation by a beta-sheet breaker peptide ligand:An electrochemical approach[J].Bioelectrochemistry,2012,84:49~52.
[40]Fuente E,Adura C,Kogan M J,et al.Carbon Nanotubes Electrochemistry Allows the In Situ Evaluation of the Effect of β-Sheet Breakers on the Aggregation Process of β-Amyloid[J].Electroanal.,2012,24:938~944.
[41]Kheterpal I,Williams A,Murphy C,et al.Structural features of the A beta amyloid fibril elucidated by limited proteolysis[J].Biochemistry,2001,40:11 757~11 767.
[42]Partovi-Nia R,Beheshti S,Qin Z,et al.Study of Amyloid β-Peptide(Aβ12-28-Cys)Interactions with Congo Red and β-Sheet Breaker Peptides Using Electrochemical ImpedanceSpectroscopy[J].Langmuir,2012,28:6 377~6 385.
[43]Zhang L,Kai T,Sun Z,et al.A Ferrocene-Tagged Amy loid-β Fragment for Rapid Screening of Aggregation InhibitorsfromNaturalCompoundsbyHPLCElectrochemicalDetection[J].Electroanal.,2013,25:1 659~1 664.

