绿豆多糖制备及抗氧化特性研究
钟 葵 曾志红 林伟静 王 强 周素梅
(中国农业科学院农产品加工研究所,北京 100193)
绿豆(Vigna radiatusL.)又名文豆、吉豆、青小豆,是菜豆族蝶形花亚科豇豆属植物的一个栽培种。绿豆是我国传统杂粮作物,产量和出口量均居世界首位,属高蛋白、低脂肪、中淀粉作物,营养丰富,经济利用价值高[1]。同时,绿豆具有良好食用及药用价值,有“济世之食谷”之说。传统中医认为绿豆味性干寒,内服具有清热解毒、消炎、利水润肤等功效[2]。现在医学则认为绿豆在抑菌、降脂、抗肿瘤和解毒方面功效颇佳[3-6]。
目前绿豆功效研究文献较少,大部分研究认为绿豆的生物活性成分主要是豆皮中的黄酮类和黄酮醇类物质[7-8]。也有报道表明,绿豆中还存在一类生物活性物质,就是多糖[9-11]。多糖(Polysaceharides)是一类具有广泛生物活性的生物大分子物质,是构成生命活动四大基本物质之一,与维持生物机能密切相关。近年来,大量研究表明多糖具有免疫调节、抗肿瘤、抗衰老、抗氧化、降血糖、抗凝血等作用,对机体毒副作用小,因此成为研究热门领域,应用价值良好[12-13]。
体内过多的氧自由基会诱发脂质过氧化,使细胞膜结构受到损伤,并可能增加肿瘤、心血管疾病、类风湿性关节炎等疾病的发病率[14]。由于合成的抗氧化剂存在致癌、毒副作用等安全问题,从天然植物来源中筛选出高效、安全的天然抗氧化剂也是近几年国内外的研究热点[15]。绿豆多糖对羟自由基、DPPH和超氧自由基有较好清除效果,最高清除效果可达到90%以上[11]。目前绿豆多糖研究报道仅寥寥数篇,处于起步阶段;且研究主要集中绿豆多糖抗氧化活性上,对于绿豆多糖提取工艺的优化缺乏相关报道。
通常,绿豆生物活性认为主要集中在种皮中,豆仁主要起到营养物质功效[7]。试验前期研究发现,豆仁中同样含有多糖,这部分多糖是否存在生理活性,与豆皮中多糖相比,生理活性存在哪些差异,目前尚不明确。本研究以豆仁为原料,优化多糖提取工艺,在此基础上对制备的粗多糖进行分离纯化,研究其多糖组分对自由基的清除效果,旨在为绿豆多糖的功能活性研究及开发利用打下理论基础,对深化绿豆加工,丰富绿豆产品类型,提高绿豆附加值有积极作用。
1 材料与方法
1.1 材料与试剂
绿豆仁:市售,粉碎后 40目过筛,低温干燥(55℃)至恒重后备用。
1,1-二苯基 -2-三硝基苯肼[1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH]:分析纯,Sigma化学公司;柱填料 DEAE-52纤维素、Sephadex G-100:Whatman公司;其他所用化学试剂、苯酚、硫酸、丙酮、氢氧化钠、乙醚、无水乙醇等、分析纯:北京化学试剂公司。
1.2 主要仪器
UV-2550紫外可见分光光度计:日本岛津;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;柱层析系统:上海沪西分析仪器厂;FA25实验室高剪切分散乳化机:上海弗鲁克流体机械制造有限公司。
1.3 试验方法
1.3.1 原料预处理
豆仁粉用80%乙醇浸提6 h,再用95%乙醇、无水乙醇、丙酮和乙醚分别清洗,粉末置于室温下24 h阴干,待用[11]。
1.3.2 绿豆仁多糖(AEMP)的碱法提取工艺
准确称量2.0 g预处理绿豆仁粉于三角瓶中,按照一定比例的液料比加入适宜浓度的NaOH溶液,置于设置好温度的恒温水浴摇床中进行一定时间的提取。提取结束后于5 000 r/min离心15 min,收集上层清液。滤渣清洗2遍,离心后收集滤液,合并3次上层清液,用2层滤纸抽滤后减压浓缩至原体积1/6。4倍体积的95%乙醇缓慢倒入浓缩液中,搅拌混合均匀,4℃下冷藏过夜,于5 000 r/min离心15 min,收集滤渣,醇洗5~6遍,得到AEMP。
1.3.3 绿豆仁多糖含量测定
提取得到的AEMP溶解于水,硫酸-苯酚法测定溶液中总糖含量[15]。最终,多糖得率以每克绿豆仁干重中葡萄糖当量来衡量(mg GE/g DW)。
1.3.4 响应面的试验设计
在单因素试验基础上,根据BoX-Behnken中心组合试验设计原理,进一步采用4因素3水平的响应面分析方法,以 NaOH 浓度 (moL/L)、液料比(mL/g)、提取温度(℃)和提取时间(h)为自变量,分别以X1、X2、X3和X4表示,并以 -1、0、+1分别代表自变量的低、中、高水平,按方程Xi=(Xi-X0)/X对自变量进行编码。其中Xi为自变量的编码值,Xi为自变量的真实值,X0为试验中心点处自变量的真实值,X为自变量的变化步长,因子编码及水平见表1。选取各因素适当的水平后,采用Design-Expert软件进行试验设计,按优化后的29组试验条件,以AEMP得率作为评判标准展开响应曲面分析,以确定各因素对AEMP得率的显著性和各培养条件的最佳组合,优化碱法提取AEMP的工艺条件。

表1 因素水平设计
1.3.5 AEMP分离纯化
取少量AEMP溶解于蒸馏水,浓度为10 mg/mL,0.45μm过滤膜过滤,上DEAE-52纤维素离子柱,柱规格为60×2.6 cm,上样量 5 mL,洗脱液流速1 mL/min,依次用蒸馏水和 0.3 mol/L的 NaCl溶液进行阶段洗脱,每管收集8 mL,苯酚-硫酸法每管跟踪检测洗脱液中多糖含量,直至检测无洗脱峰为止。合并主要吸收峰的洗脱液,浓缩后透析48 h除盐,定容组分溶液浓度为5 mg/mL,依次上Sephadex G-100凝胶柱,柱规格为60×2.6 cm,上样量5 mL,洗脱液流速0.4 mL/min,蒸馏水洗脱,每管收集4 mL。苯酚-硫酸法每管跟踪检测洗脱液中多糖含量,直至检测无洗脱峰为止。收集合并主要吸收峰的洗脱液,浓缩后蒸馏水透析48 h,冷冻干燥,最终收集得到纯化组分。
1.3.6 抗氧化活性
1.3.6.1 羟自由基[16]
在试管中加入0.5 mL、9.1 mmol/L的水杨酸-乙醇溶液,0.5 mL样品溶液,0.5 mL、9.1 mmol/L的Fe2+溶液,3.5 mL蒸馏水,再加入 5 mL、8.8 mmol/L的H2O2,显色振荡摇匀后,于510 nm测定吸光值,计算清除效果。清除效果计算公式如下:

式中:A0(以样品溶剂代替样品)为空白样测定值;As为样品测定值。
1.3.6.2 DPPH(二苯基三硝基苯肼自由基(DPPH·)自由基[17]
将1.5 mL多糖样品溶液添加至1.5 mL、0.1 mmol/L的DPPH 95%乙醇溶液中,漩涡混合振荡后,室温放置30 min,于517 nm下测定溶液的吸光值。公式如下:
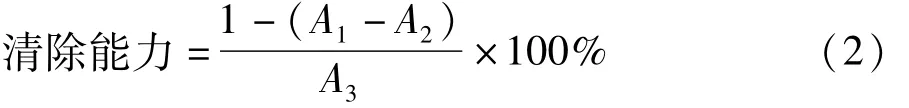
式中:A1为DPPH+样品的吸光值,A2为95%乙醇+样品的吸光值,A3为DPPH+蒸馏水的吸光值。
使用同样方法测定现配抗坏血酸溶液的羟自由基和DPPH的清除能力,作为对照。
1.4 数据分析
试验数据采用BoX-Behnken的中心组合试验设计,分析和作图软件使用 Design-Expert 6.0.5软件和Origin7.5。数据分析采用方差分析(ANOVA),所有试验均重复3次。
2 结果与讨论
2.1 绿豆多糖提取工艺优化
绿豆仁中淀粉含量高,达到50%~60%,会对多糖提取及多糖纯度造成干扰。碱法是淀粉提取常用方法之一,大量研究表明碱处理也能显著提高多糖的得率[17]。试验中采用碱法同时提取多糖和淀粉,再通过离心达到去除淀粉的目的。目前碱法提取多糖文献较多,研究结果表明NaOH浓度、料液比、提取温度和时间几个单因素对得率影响较为显著[18],因此试验前期研究了这4个单因素对AEMP得率影响,并选取其设计响应面试验,为BoX-Behnken设计提供适宜取值范围。最终选取水平设置如表1,优化后的29组试验设置和结果见表2。

表2 响应值分析结果
利用Design-EXpert软件对表2试验数据进行多元回归拟合,得到AEMP得率对NaOH浓度、料液比、提取温度和时间的二次多元回归方程为:
Y=6.31+0.26X1-0.27X2+0.57X3-1.55X4-1.46X12+1.28X22-0.14X32+0.23X42+0.03X1X2-0.92X1X3-0.98X1X4+0.37X2X3-0.63X2X4-0.30X3X4
表3是该回归模型方差分析结果。由表3可知,模型的F=16.90(P<0.000 1),表明该模型方程极显著,不同因素间差异极显著(P<0.01);模型失拟项F=1.66(P>0.05),表明失拟项不显著(P>0.05);模型校正决定系数R2Adj=0.888,表明该模型拟合程度良好,试验误差小。方差分析表明,该模型能较好的反映提取因素液料比、浸提时间和转速和绿豆多糖AEMP得率之间关系。

表3 回归模型方差分析
表4列出了回归模型系数显著性检验结果。结果表明,模型的一次项X3、X4和二次项X12、X22显著(P<0.05),各因素对多糖得率影响X4>X3>X2>X1,即处理时间对AEMP得率影响最大,其次是温度和液料比,最后是NaOH浓度。交互项X1X3、X1X4和X2X4极显著(P<0.05),表明碱液浓度和温度、处理时间之间、液料比和处理时间之间存在极显著交互作用,各影响因素对于AEMP得率非简单线性关系。

表4 回归模型系数显著性检验
通过软件分析,得到AEMP最佳提取工艺条件为碱液浓度 0.02 mol/L,液料比 19.99∶1 mL/g,提取温度50℃,提取时间3 h;在此工艺条件下,绿豆多糖得率的理论值可达9.74 mg GE/g DW;为检验响应面法所得结果可靠性,同时考虑实际操作的便利,将最佳提取参数修正为:碱液浓度0.02 mol/L,液料比20∶1 mL/g,提取温度50℃,提取时间3 h,最终多糖得率为9.70 mg GE/g DW,与理论预测值比较误差不显著(P>0.05),表明试验设计和响应面法优化得到的提取工艺参数准确可靠,具有实用价值。
2.2 绿豆多糖分离纯化
通过2.1制备的绿豆粗多糖纯度为65%,要得到纯度更高的多糖需要进一步纯化。本研究采用柱层析法进一步分离和纯化AEMP。首先用DEAE-52纤维素离子交换柱层析,依次用蒸馏水和0.3 mol/L NaCl溶液阶段洗脱,分离得到1个水洗脱多糖组分AEMP-1′和1个盐洗脱多糖组分AEMP-2′(图1a),糖含量分别为47.01%和52.99%。将收集到的2个多糖组分分别经由Sephadex G-100凝胶柱进一步层析,蒸馏水洗脱,结果如图1b。由图1可见,AEMP-1′和AEMP-2′经蒸馏水洗脱后均显示单一峰,且峰形较为对称,2个组分分别命名为AEMP-1和AEMP-2,其多糖含量分别为52.51%和47.49%。

图1 AEMP及其组分的DEAE-52纤维素和Sephadex G-100层析柱洗脱曲线图
绿豆多糖组分AEMP-1′和AEMP-2′色泽为白色,理化反应结果为均较易溶解于水,不溶于乙醇、丙酮等有机溶剂,不含淀粉和酚类物质。苯酚-硫酸法测定AEMP-1和AEMP-2中多糖含量分别为(92.89±2.89)%和(90.58±3.44)%。
2.3 绿豆多糖的抗氧化活性
自由基清除率是传统的抗氧化能力测定方法之一,广泛用于抗氧化物质自由基清除能力的测定[19]。图2和图3探讨了AEMP及其纯化组分(AEMP-1和AEMP-2)对羟自由基和DPPH自由基的动态清除反应过程。
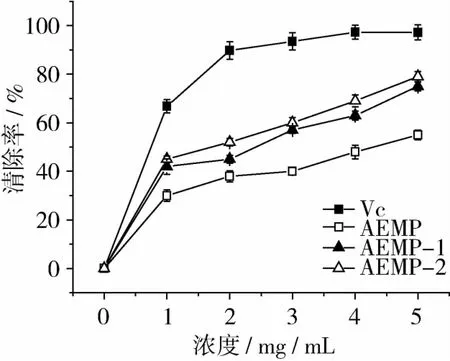
图2 AEMP及其纯化组分对羟自由基清除效果
AEMP及纯化后组分对羟自由基均具有良好清除效果,随多糖浓度增加清除效果显著增强(图2),最高羟自由基清除率达到了 55.32%(AEMP)、75.05%(AEMP-1)和79.81%(AEMP-2)(多糖浓度为5 mg/mL时)。纯化后多糖组分AEMP-1和AEMP-2羟自由基清除率显著高于未纯化多糖AEMP,但两个组分之间差异不显著。阳性对照抗坏血酸浓度为2 mg/mL时,羟自由基清除率达到90%以上,显著高于AEMP及纯化后组分。AEMP及纯化后组分对DPPH清除效果与羟自由基类似,随浓度增加清除效果显著增强(图3)。
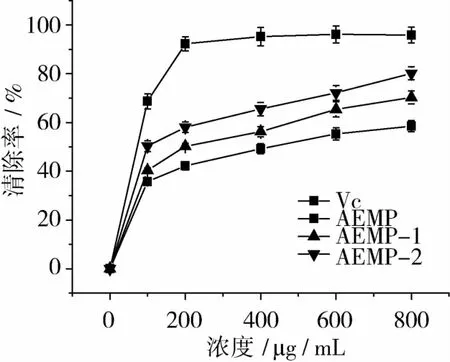
图3 AEMP及其纯化组分对DPPH自由基清除效果
多糖纯化后的多糖组分AEMP-1和AEMP-2清除效果显著优于AEMP,最高DPPH清除率达到了58.49%(AEMP)、70.28%(AEMP-1)和 80.16%(AEMP-2)(800μg/mL),且多糖组分 AEMP-2
清除率显著高于AEMP-1。相同剂量下,AEMP及其组分的对DPPH自由基的清除效果均不及相同剂量下的抗坏血酸。
自由基半数抑制浓度IC50值是自由基抑制率为50%时所对应的多糖的浓度,通常用于衡量多糖清除自由基能力的强弱[15]。IC50值越小,表明多糖的抗氧化能力越强。利用Originlab7.0软件拟合样品浓度与清除率的量效关系,通过拟合曲线计算得到绿豆多糖AEMP及其纯化组分对羟自由基和DPPH自由基的IC50值,具体数值如表5所见。纯化组分AEMP-2自由基清除效果最优,清除羟自由基和DPPH的 IC50值分别为(4.71±0.15)mg/mL和(1.03×10-1±1.21×10-3)mg/mL,显著 低于AEMP及纯化组分AEMP-1。

表5 绿豆多糖及其纯化组分清除自由基的IC50值/mg/mL
通常,绿豆生物活性认为主要集中在种皮中,豆仁主要起到营养物质功效。有报道表明绿豆皮中多糖成分进行分离和纯化后得到多糖组分MP-1(中性)和MP-2(酸性)具有良好的抗氧化效果,MP-1的抗氧化活性最高,对羟自由基和DPPH清除率分别达到 90%(5 mg/mL)和 80%(800μg/mL)左右[11]。本试验中,豆仁中多糖组分AEMP-2相同浓度下对羟自由基和DPPH清除率均80%左右,与豆皮中活性最高组分MP-1差别不大,表明绿豆仁中同样含有生物活性成分多糖成分,其抗氧化功效与豆皮中多糖组分相当。因此,豆仁是集营养与生物活性一身的作物。后期将进一步开展活性组分AEMP-1的结构相关研究,以其获得AEMP构效关系的相关信息。
3 结论
3.1 建立了一个碱法提取绿豆仁中多糖成分的最佳工艺条件,即碱液浓度0.02 mol/L,液料比 20 mL/g,提取温度50℃,提取时间3 h,最终多糖得率为9.70 mg GE/g DW,与模型预测值基本相符。因此,采用RSM法优化得到的碱提参数准确、可靠,具有较好的实用价值,对绿豆仁中多糖成分的研究与开发利用具有重要意义。
3.2 采用DEAE-52纤维离子色谱和Sephadex G-100凝胶色谱柱分离纯化AEMP,得到两个多糖组分AEMP-1和AEMP-2,其多糖含量分别为(92.89±2.89)%和(90.58±3.44)%。
3.3 AEMP-及其纯化组分AEMP-1和AEMP-2对羟自由基和DPPH自由基均有较好清除效果,表明具有良好抗氧化活性。AEMP-2抗氧化活性最强,对羟自由基和DPPH自由基半数抑制浓度IC50值分别为4.71 mg/mL和1.03×10-1mg/mL,对DPPH自由基清除效果优于羟自由基,是一种具有开发潜力的天然抗氧化剂。
[1]Mubarak A E.Nutritional composition and antinutritional factors of mung bean seeds(Phaseolus arueus)as affected by some home traditional processes[J].Food Chemistry,2005,89:489-495
[2]沈连生.本草纲目[M].北京:华夏出版社,2004:199
[3]Li G H,Wan JZ,Le G W,et al.Novel angiotensin-converting enzyme inhibitory peptides isolated from alcalase hydrolysate of mung bean protein[J].Journal of Peptide Science,2006,12:509-521
[4]Randhir R,Shetty K.Mung beans processed by solidstate bioconversion improves phenolic content and functionality relevant for diabetes and ulcer management[J].Innovative Food Science&Emerging Technologies,2007,8:197-204
[5]Soucek J,Skvor J,Pouckova P,et al.Mung bean sprouts(Phaseolus aureus)nuclease and its biological and antitumor effects[J].Neoplasma,2006,53:402-409
[6]李健,王旭,刘宁.绿豆提取物的抑菌作用研究[J].哈尔滨商业大学学报,2010,26:680-683
[7]张竞竞,易建勇,王宝刚,等.绿豆皮抗氧化物质的提取及初步分析[J].食品工业科技,2008,12:64-66
[8]吴小勇,游耿,杨公明.绿豆种皮总黄酮的提取及抗氧化能力研究[J].食品与发酵工业,2010,36:214-216
[9 Duh PD,Du P C,Yen G C.Action of methanolic extract of mung bean hull as inhibitors of lipid peroxidation and nonlipid oxidative damage[J].Food and Chemical Toxicology,1999,37:1055-1061
[10]Duh P D,Yen W J,Du P C,et al.Antioxidant activity of mung bean hulls[J].Journal of American Oil Chemists’Society,1997,74:1059-1063
[11]Lai F R,Wen Q B,Li L,et al.Antioxidant activities of water-soluble polysaccharide extracted from mung bean(Vigna radiataL.)hull with ultrasonic assisted treatment[J].Carbohydrate.Polymer,2010,81:323-329
[12]Hokputsa S,Harding S E,Inngjerdingen K.Bioactive polysaccharides from the stems of the Thamedicinal plant Acanthus ebracteatus:their chemical and physical features[J].Carbohydrate Research,2004,339:753-762
[13]Schepetkin I A,Quinn M T.Botanical polysaccharide:Macrophage immunomodulation and therapeutic potential[J].International Immunopharmacology,2006,6:317-333
[14]Gan CY,Latiff A A.Extraction of antioxidant pectin-polysaccharide from mangosteen(Garcinia mangostana)rind:optimization using response surface methodology[J].Carbohydrate Polymer,2011,83:600-607
[15]Kim D O,Jeong SW,Lee C Y.Antioxidant capacity of phenolic phytochemicals from various cultivars of plums[J].Food Chemistry,2003,81:321-326
[16]张惟杰.糖复合物生化研究技术[M].浙江大学出版社,1999:36
[17]Yang B,Zhao M M,Shi J,et al.Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit pericarp[J].Food Chemistry,2008,106:685-690
[18]Jiang G X,Prasad K N,Jiang Y M,et al.Extraction and structural identification of alkali-soluble polysaccharides of longan(Dimocarpus longan Lour.)fruit pericarp[J].Innovative Food Science& Emerging Technology,2009,10:638-642
[19]Yang B,Jiang Y M,Wang R,et al.Ultra-high pressure treatment effects on polysaccharides and lignins of longan fruit pericarp[J].Food Chemistry,2009,112:428-431.
- 中国粮油学报的其它文章
- 棕榈油甲酯制备生物润滑油三羟甲基丙烷脂肪酸三酯的工艺研究

