ATP敏感性钾通道开放剂埃他卡林逆转心室重构及其内皮细胞机制*
钟明利,汪 汇,周红敏,张雁芳,崔文玉,龙超良,段 炼,汪 海,4△
(1.广西医科大学,南宁530021;2.军事医学科学院卫生学环境医学研究所心血管药物研究中心,北京100850;3.军事医学科学院附属医院,北京100071;4.北京赛德维康医药研究院,北京100039)
心力衰竭作为各种心血管疾病发展的终末阶段,其发病率、死亡率非常高,5年存活率甚至与恶性肿瘤相仿。研究表明,心室重构是心脏对各种血流动力学超负荷和神经内分泌(如 NE、ET-1、PGI2等)的一种长期适应性过程,如果该损伤因素持续存在,最终将导致心衰的发生,因此心室重构是慢性心力衰竭发生发展的主要病理基础,阻断心室重构是预防心力衰竭的一个重要环节[1]。
近年来,内皮细胞在心血管疾病的发生发展中越来越受到重视。靶向激活内皮细胞ATP敏感性钾通道(KATP),纠正内皮功能紊乱是治疗心血管疾病的重要策略[2]。新型KATP开放剂埃他卡林是一种全新抗高血压药物,它能够通过选择性激活SUR2B/Kir6.1亚型 KATP纠正内皮功能紊乱,从而使失衡的一氧化氮(nitric oxide,NO)、内皮素-1(endothelin-1,ET-1)系统以及前列环素(prostacyclin,PGI2)恢复平衡[3]。本室前期试验表明,埃他卡林(iptakalim,Ipt)能通过保护内皮功能逆转压力超负荷所致的心室重构和自发性高血压大鼠心血管重构[4,5],减轻肺动脉高压引起的右心室重构[6],但对于通过异丙肾上腺素(isoproterenol,ISO)诱导的心室重构是否有保护作用尚未研究。因此,本实验采用ISO诱导致大鼠心室重构,探讨Ipt逆转心室重构的作用及其内皮细胞机制。
1 材料与方法
1.1 药品及仪器
1.2 动物模型制备和分组
雄性Wistar大鼠30只,体重180~220 g,由军事医学科学院实验动物中心提供。大鼠随机分为3组(n=10):空白对照组、ISO组(模型组)、Ipt(3 mg/kg)组。根据文献略加改进制备大鼠心室重构模型[7]:模型组和Ipt组均连续7 d多点皮下注射异丙肾上腺素85 mg/(kg·d),空白对照组皮下注射等量的生理盐水,并同时开始灌胃给药 Ipt3 mg/(kg·d),给药容积为2 ml/kg,连续给药6周,空白对照组和模型组给予等体积的蒸馏水。
1.3 血流动力学检测
大鼠给药6周后,用2%戊巴比妥钠腹腔注射麻醉(45mg/kg),分离右颈总动脉,将充满肝素的聚乙烯导管插入右颈总动脉,经压力换能器连接RM-6000八导生理记录仪,稳定10min,记录颈总动脉收缩和舒张压,而后顺着颈动脉向心方向将导管轻轻插入4~4.5 cm,稳定后用SMUP-PC生物信号分析系统记录不同时间点左室收缩压(left ventricular systolic pressure,LVSP)、左室舒张末期压(left ventricular end-diastolic pressure,LVEDP)、左室压力最大上升速率和左室压力最大下降速率(±dp/dtmax)、心肌纤维缩短速率的生理最大值(Vpm)、心肌纤维缩短速率的理论最大值(Vmax),计算平均值。
1.4 心脏重量指数测定
记录血流动力学参数后,迅速开胸取出心脏,用预冷的0.9%生理盐水洗净血迹,滤纸吸干,沿房室沟剪掉心耳和心室周围结缔组织,用电子天平称取全心重量(heartweight,HW),然后紧贴室间隔右侧分离剪下称量左心室(包括室间隔)重量(left ventricular weight,LVW)和右心室重量(right ventricular weight,RVW),分别计算全心指数(heart weight/body weight,HW/BW)、左心指数(LVW/BW)、右心指数(RVW/BW)。
1.5 病理学指标检测
心肌组织用10%中性福尔马林固定,梯度酒精脱水,常规石蜡包埋,进行石蜡切片(5μm),苏木精一伊红(HE)染色和Masson’s三色染色。切片在Leica DFC295型显微镜下观察并摄片,心肌细胞的横截面积用NIH Image 1.61软件(National Institutes of Health Service Branch)计算。分析部位为心脏左心室(心内膜),每只动物随机选取100个细胞(HE染色,×400)。Masson’s三色染色(×200)采用 Image-pro plus 6.0图像分析软件分析心肌间质胶原容积分数(collagen volume fraction,CVF)。
1.6 左心室心肌组织中羟脯氨酸含量的测定
羟脯氨酸(hydroxyproline,Hyp)含量测定采用碱水解法,取50 mg左心室组织,制备组织匀浆液,操作严格按照试剂盒说明书进行,并在550 nm处测量心肌组织中Hyp的含量。
1.7 放免法测定血浆中ET-1和PGI2含量
记录血流动力学参数后取血,测ET-1的血样预先加入7.5%EDTA二钠15μl和抑肽酶20μl于试管中;测 PGI2的血样预先加入消炎痛-EDTA二钠100μl于试管中,4℃离心 3 500 r/min,离心 15 min,各取上清100μl,于-70℃冰箱保存。放射免疫法测定血浆中ET-1和PGI2,试剂盒由北京普尔伟业生物科技有限公司提供,严格按照说明书操作。
1.8 统计学处理
所有数据均以均数±标准差(±s)表示,统计分析采用SPSS 13.0统计软件包进行,组间比较采用t检验。
总体而言,现实的情况是为最大限度的优化住院医师培训,陪练式现场督导教育实践模式在短期内可能仍然需要结合传统带教模式,由带教老师对其进行儿童保健相关专业知识总培训,然后再进行陪练式现场督导教育实践,增加练兵的机会。
2 结果
2.1 Ipt对ISO致大鼠心室重构血流动力学的影响
与空白对照组相比,模型组中平均动脉压(MABP)、反映心脏功能的参数包括 LVSP,±dp/dt-max,Vpm,Vmax均显著降低,相反,其 LVEDP显著升高(P<0.01,表1)。而Ipt治疗6周后,大鼠的平均动脉压、心脏的舒缩功能均显著改善(P<0.05,P<0.01,表 1)。
Tab.1 Effect of Ipt on MABP and hemodynamic parameters on isoproterenol-induced cardiac remodeling in rats(±s,n=10)

Tab.1 Effect of Ipt on MABP and hemodynamic parameters on isoproterenol-induced cardiac remodeling in rats(±s,n=10)
MABP:Mean artery blood pressure;LVSP:Left ventricular systolic pressure;+dp/dtmax:Maximal rate of left ventricular systolic pressure;Vpm:Physiological velocity of contractile element shorting;Vmax:Maximal velocity of contractile elementshorting;LVEDP:Left ventricular end-diastolic pressure;-dp/dtmax:Maximal rate of left ventricular diastolic pressure;Ipt:Iptakalim*P<0.05,**P<0.01 vs control group;##P<0.01 vs model group
Group MABP(mmHg) LVSP(kPa) +dp/dtmax(kPa/s) -dp/dtmax(kPa/s) Vpm(s) Vmax(s) LVEDP(kPa )Control 109.9±4.2 20.29±0.44 462.8±24.6 444.4±34.51 0.97±0.08 0.73±0.14 5.97±0.55 Model 94.9±9.0**19.36±0.37**375.1±30.8** 342.7±31.42** 0.72±0.08**0.24±0.11**7.46±0.53**Ipt3mg/kg 108.3±4.5## 19.82±0.64*##441.4±19.2*## 415.0±36.17*## 0.95±0.05## 0.67±0.12## 5.88±0.37##
2.2 Ipt对ISO致大鼠心室重构的影响
2.2.1 Ipt对ISO致大鼠心室重构模型的心脏重量指数的影响 ISO连续皮下注射7 d可引起大鼠HW/BW、LVW/BW和RVW/BW等指数明显升高,差异具有统计学意义(P<0.05,P<0.01,表 2),Ipt 3 mg/kg组能明显抑制心脏重量指数的增高(P<0.05,P<0.01,表 2),提示 Ipt能明显抑制 ISO致大鼠心脏重量指数的增加。
Tab.2 Effects of Ipt on heart weight index on isoproterenol-induced cardiac remodeling in rats(±s,n=10)

Tab.2 Effects of Ipt on heart weight index on isoproterenol-induced cardiac remodeling in rats(±s,n=10)
HW:Heart weight;LVW:Left ventricular weight;RVW:Right ventricular weight;BW:Body weight;Ipt:Iptakalim*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group
Group HW/BW LVW/BW RVW/BW Control 2.38±0.12 1.90±0.10 0.48±0.07 Model 2.63±0.12**2.08±0.11**0.55±0.07*Ipt3mg/kg 2.41±0.12## 1.95±0.11## 0.46±0.05#
2.2.2 Ipt对ISO致大鼠心室重构模型的心肌组织病理形态学的影响 与空白对照组相比,模型组心肌纤维增粗紊乱,炎性细胞浸润,心肌细胞横截面积明显增加。经Ipt 3 mg/kg治疗6周后,可明显改善心肌的病理变化、抑制心肌细胞肥大(图1见彩图页Ⅲ)。
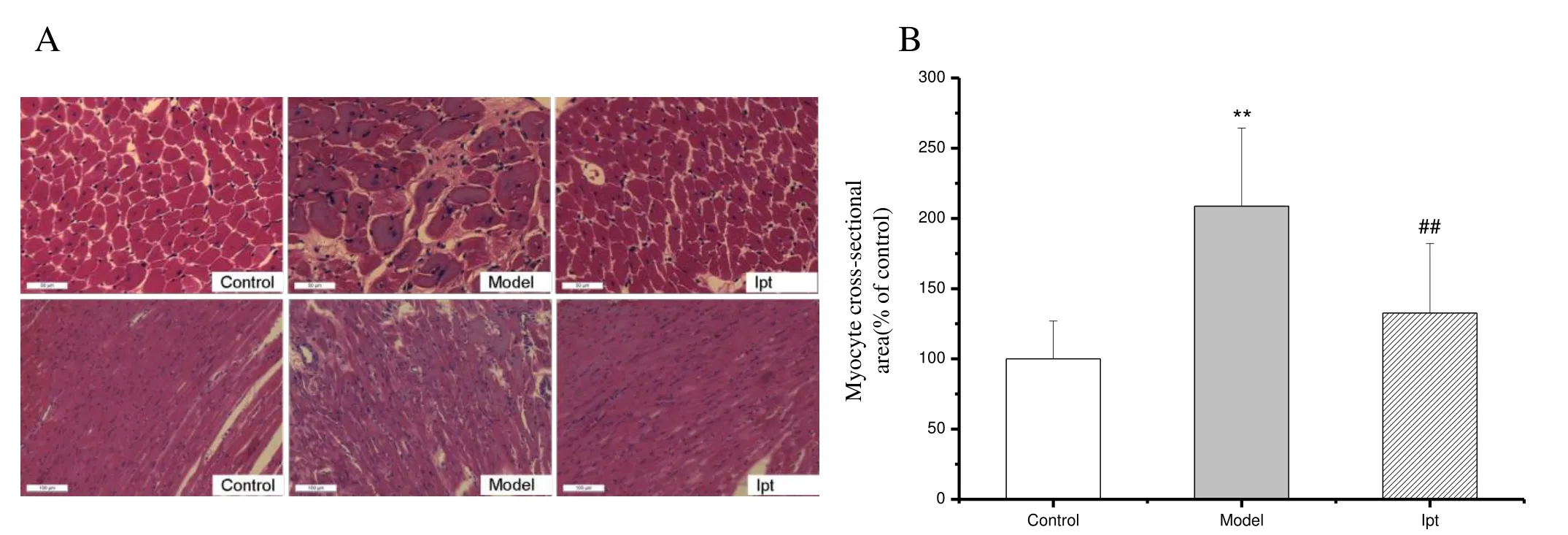
A:Figure of myocyte cross-section(HE ×400,×200);B:Statistic results of myocyte cross-sectional area;Ipt:Iptakalim*P <0.05,**P < 0.01 vs control group;##P <0.01 vs model group
2.2.3 Ipt对ISO致大鼠心室重构模型的心肌纤维化的影响 由于羟脯氨酸在胶原蛋白中所占的比例比较恒定,所以心肌组织内羟脯氨酸的浓度可代表胶原的水平,即心肌纤维化的病变程度。Masson’s染色中肌纤维、纤维素呈红色,胶原纤维呈绿色,绿色增多表明心肌纤维化程度加重。与空白对照组相比,模型组中心肌组织CVF和心肌组织中羟脯氨酸含量明显增加(71.52%,P<0.01),Ipt能明显抑制心肌组织中羟脯氨酸含量的增加 35.5% (P<0.05),减轻心肌纤维化的病变程度(图2见彩图页Ⅲ)。
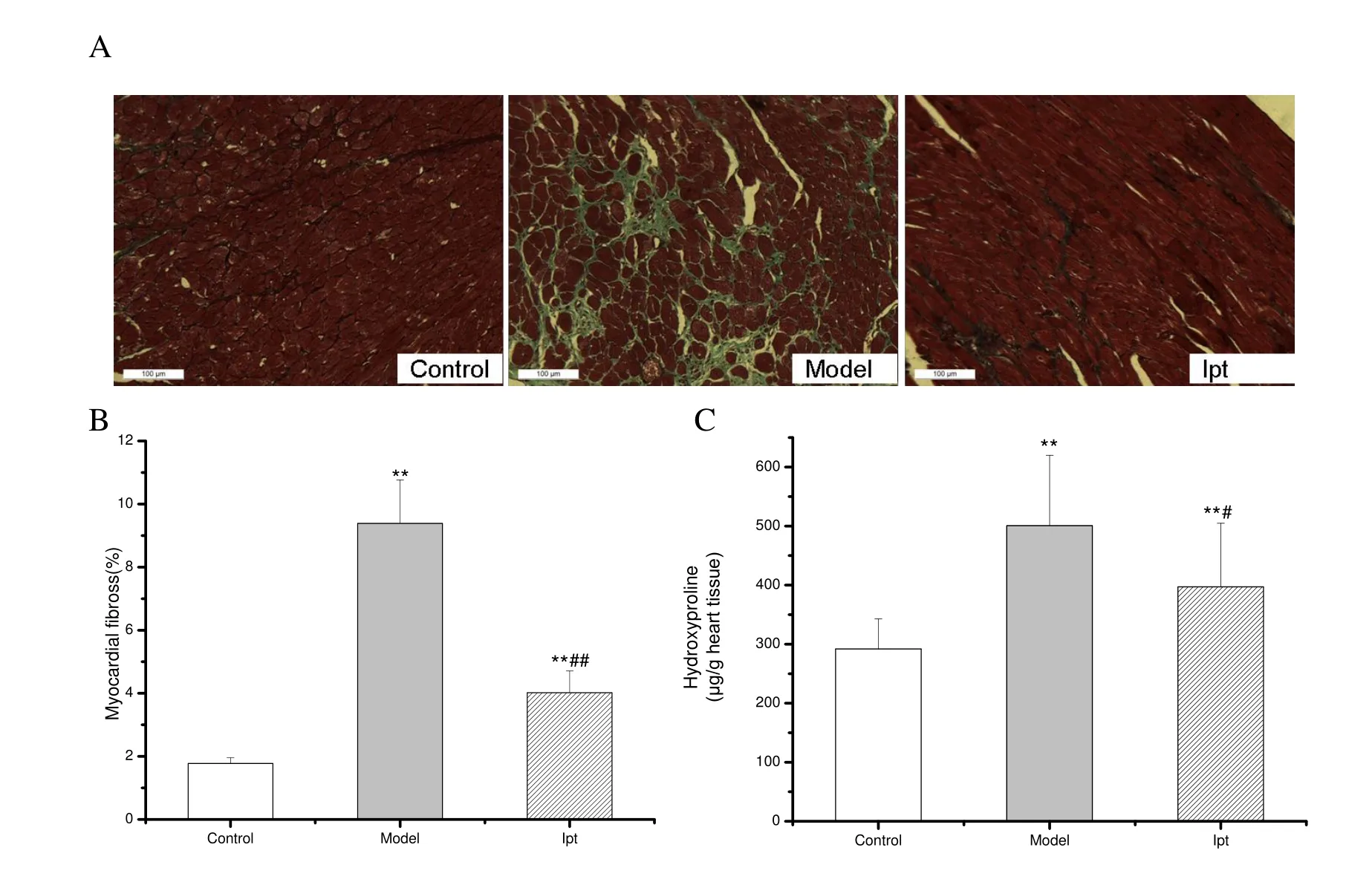
Fig. 2 Effects of Ipt on myocardial fibrosis and hydroxyproline content in cardiac tissue in ISO treated rats(x ± s, n = 10)
2.3 Ipt对血浆中ET-1和PGI2含量的影响
与空白对照组相比,模型组血浆中的ET-1含量增加,PGI2含量明显降低,经 Ipt 3 mg/kg治疗6周后,可显著降低血浆中 ET-1的含量,增加血浆中PGI2的含量(P<0.05,P<0.01,表 3)。
Tab.3 Effects of Ipton plasma contents of ET-1 and PGI2 in ISO treated rats(±s,n=10)

Tab.3 Effects of Ipton plasma contents of ET-1 and PGI2 in ISO treated rats(±s,n=10)
Ipt:Iptakalim;ET-1:Endothelin-1;PGI2:Prostacyclin*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group
Group ET-1(pg/ml) PGI2(pg/ml)Control 91.9±25.4 305.7±54.4 Model 159.2±33.7** 248.1±70.7*Ipt3mg/kg 91.9±25.7## 328.6±108.7#
3 讨论
心室重构为心脏损伤后出现的基因表达、分子、细胞和间质改变,临床上主要表现为心功能改变、心肌肥厚和心肌纤维化等。异丙肾上腺素属于β受体激动剂,连续皮下注射能够激活大鼠肾素-血管紧张素系统,通过加快心率、增加心肌收缩力和心肌耗氧量,同时产生大量的儿茶酚胺可造成心肌弥漫性坏死和纤维化。心肌肥厚过程中心肌相对供血供氧不足,加重了心肌缺血、缺氧。本实验大鼠连续皮下注射ISO后,心脏重量指数、心肌细胞肥大和心肌组织纤维化程度均明显增加,收缩和舒张功能明显减弱,与空白对照组相比差异具有显著性(P<0.01),表明该实验成功地复制了心室重构模型。
本实验结果表明Ipt给药6周后,能够明显抑制心脏指数的增加、减轻心肌细胞的肥大、减弱心肌细胞的纤维化程度、降低心肌组织中羟脯氨酸的含量、改善心脏收缩和舒张功能、恢复降低的平均动脉压,表明埃他卡林对ISO致大鼠心室重构具有明显的逆转作用。
血管内皮细胞是分布在心血管系统内壁的一层单细胞层,具有影响心血管系统功能的重要作用。在生理状态下,内皮细胞合成分泌多种血管活性物质,如 NO、ET-1、血管紧张素Ⅱ(AngⅡ)、PGI2等,调节血管紧张性并维持正常血压,以及对改善高血压和心室重构发挥重要作用。其中,ET-1是一种很强的缩血管物质,在正常心血管系统中不发挥重要作用;但在心衰等病理条件下,ET-1在调节外周血流动力学参数变化、左心室功能和心室重构等方面发挥重要作用[8]。在主动脉缩窄、肺动脉高压模型和慢性心脏功能衰竭模型以及心室重构中 ET-1的表达显著增加[4,6]。PGI2是心血管系统中一种主要的前列腺素,其生理意义在于舒张血管和防止血小板聚集;其受体 IP(prostacyclin receptor,IP)在心血管系统中均有表达,Hara等发现敲除 IP基因的小鼠[9],在缩窄主动脉后,心脏发生了明显的重构,而重构程度比缩窄主动脉的野生型小鼠明显增高;同时研究发现,PGI2在体外可以抑制AngⅡ诱导的培养心肌细胞肥大和心肌成纤维细胞分泌胶原[10]。这些研究表明,PGI2在抑制心室重构和心肌肥大的病理过程中发挥着重要作用。
本室的大量研究表明,新型KATP通道开放剂Ipt具有明确的抗心血管重构的作用,能够通过激活内皮细胞KATP通道,促进NO和 PGI2分泌,抑制 ET-1的分泌,纠正内皮细胞功能紊乱,从而逆转压力超负所致的心室重构[4]。本实验在ISO致大鼠心室重构中的结果表明,经过Ipt给药6周后,与模型组相比,血浆中ET-1含量明显降低,PGI2含量明显升高,在对抗心室重构的过程中可能发挥了重要作用。
综上所述,埃他卡林能明显逆转ISO所致的心室重构,其机制与纠正内皮功能紊乱,调节ET-1和PGI2系统的功能平衡相关。
【参考文献】
[1] Gradman A H,Alfayoumi F.From left ventricular hypertrophy to congestive heart failure:management of hypertensive heart disease[J].ProgCardiovascDis,2006,48(5):326-341.
[2] Minamino T,HoriM.Protecting endothelial function:A novel therapeutic targetof ATP-sensitive potassium channelopeners[J].CardiovascRes,2007,73(3):448-449.
[3] Pan ZY,Huang JH,GuiW Y,etal.Targeting hypertension with a new adenosine triphosphate sensitive potassium channel opener iptakalim [J].JCardiovascPharmacol,2010,56(3):215-228.
[4] Gao S,Long C L,Wang R H,etal.KATPactivation prevents progression of cardiac hypertrophy to failure induced by pressure overload via protecting endothelial function[J].CardiovascRes,2009,83(37):444-456.
[5] 龙超良,冯华松,汪 海.盐酸埃他卡林对高血压心脏重构的作用[J].中国药理学通报,2003,19(1):48-51.
[6] Wang H,Tang Y,Zhang Y L.Hypoxic pulmonary hypertension(HPH)and iptakalim,a novel ATP-sensitive potassium channel opener targeting smaller arteries in hypertension[J].CardiovascDrugRev,2005,23(4):293-316.
[7] Teerlink JR,Pfeffer JM,PfefferM A.Progressive ventricular remodeling in response to diffuse isoproterenol-induced myocardial necrosis in rats[J].CircRes,1994,75(1):105-113.
[8] Lerman A,Hildebrand FL Jr,Aarhus L L,etal.Endothelin has biologicalaction atpathophysiological concentrations[J].Circulation,1991,83(5):7258-7259.
[9] Hara A,Yuhki K,Fujino T,etal.Augmented cardiac hypertrophy in response to pressure overload inmice lacking the prostaglandin I2receptor[J].Circulation,2005,112(1):84-92.
[10] Yu H,Gallagher AM,Garfin PM,etal.Prostacyclin release by rat cardiac fibroblasts:inhibition of collagen expression[J].Hypertension,1997,30(5):1047-1053.

