禾谷类作物种子糊粉层细胞程序性死亡
吴黄铭,李 江,王光辉,陈惠萍,3
(1.海南大学热带作物种质资源保护与开发利用教育部重点实验室,海南 海口 570228; 2.复旦大学生命科学学院发育生物学研究所,上海200433; 3.海南大学园艺园林学院,海南 海口 570228)
细胞程序性死亡(Programmed Cell Death,PCD)是指生物体生长发育到特定阶段,由细胞内既定的程序引发的一种由自身基因控制的死亡过程。它是调节细胞群体相对平衡的一种重要方式,与细胞有丝分裂方式截然相反。许多证据表明,植物PCD是植物生长发育的特定时期,特定部位的细胞呈现出特征形态和生化改变的细胞死亡形式,这些改变是一系列基因被激活而引起的级联反应的结果,这种形式的细胞死亡有利于自身结构形成和组织分化[1-4]。因此,PCD是植物体中普遍存在的一种重要生命现象,在发育的各个特定阶段均有自然的细胞死亡过程发生。
禾谷类种子糊粉层是位于胚乳与胚之间的由一至多层的薄壁细胞构成的结构,这些细胞含有大量积累蛋白质的糊粉粒,因而被称为糊粉层。糊粉层主要的生理功能就是将合成的水解酶分泌到淀粉胚乳,然后降解贮藏在淀粉胚乳中的物质,为胚的生长发育提供营养,而当胚萌发后,这些糊粉层细胞便很快死亡。禾谷类种子萌发过程中糊粉层细胞的死亡属于PCD[5-6],可见PCD是禾谷类种子萌发过程必不可少的一个环节。如果禾谷类种子萌发过程中糊粉层不发生PCD,种子胚就会因得不到养分供应而停止活动,萌发过程随之终止。近年发表的有关植物PCD的综述很多[7-8],但有关禾谷类种子萌发过程中的PCD的综述却极少。
1 禾谷类种子糊粉层细胞程序性死亡的特征
禾谷类种子发育过程胚乳分化为淀粉性胚乳和糊粉层。其中,糊粉层是胚乳表层细胞分裂停止后转化来的,分布在胚乳的外围。胚乳表皮细胞之所以可以转化成糊粉层细胞,可能与它积累的大量矿物质、脂类和蛋白质等“灌浆废物”有关。当籽实成熟时,所有淀粉性胚乳细胞死亡,只有糊粉层细胞还存活。随着糊粉层细胞逐渐成熟,胞内的细胞器越来越多,其中占最大比例的细胞器是蛋白贮藏液泡(Protein Storage Vacuoles,PSVs)。在种子萌发过程中,很多小的PSVs逐渐合并成大的中央液泡,当大液泡破裂时,细胞随即出现皱缩并死亡。因此,糊粉层细胞中PSVs的数量和大小一直被当成PCD的半定量标记[1-2]。种子萌发过程中,胚释放出赤霉素(Gibberellin,GA),糊粉层细胞受到GA的诱导产生淀粉酶、蛋白酶和核酸酶等一系列水解酶,从而分解胚乳中贮藏的营养物质,供给胚用于早期生长。当糊粉层细胞释放出水解酶后,糊粉层从内向外,其细胞内的圆球体及糊粉粒开始出现解体,随后,圆球体和糊粉粒解体出来的部分营养用于胚的生长,其余的互相融合,成为无结构的液滴[9-10]。Fath等[5-6]研究证实,大麦(Hordeumvulgare)糊粉层细胞在死亡过程中,先发生液泡化现象;随后质膜完整性丧失,蛋白酶和核酸酶活力增强。在核酸酶的水解作用下,DNA降解,但不形成典型的180~200 bp的DNA条带,最后细胞消失,过程有点类似细胞自溶,具有非典型凋亡PCD的特点。Bethke等[1]也发现,在细胞死亡前,大麦糊粉层细胞高度液泡化,细胞质及相关细胞器的体积变小,从而认为可以将糊粉层细胞的液泡化作为糊粉层细胞死亡的形态学特征之一,以此来反映糊粉层PCD的进程。大麦糊粉层细胞死亡与液泡化程度有极大的相关性。在未达到高度液泡化之前,糊粉层细胞还是活细胞;当高度液泡化出现不久,糊粉层细胞质内的相关细胞器的内含物迅速被分解[1],细胞死亡。
通过我们的研究发现,在正常条件下水稻(Oryzasativa)种子糊粉层PCD的进程可以通过糊粉层细胞的液泡化程度反映出来,而且水稻种子糊粉层细胞液泡化进程不但具有时间效应,还同时具有位置效应。用吖啶橙(Acridine Orange,AO)荧光试剂染色发现,DNA的降解与胚的距离及液泡化程度有关:离胚越近,液泡化程度越大,DNA降解越快[11]。Wang等[12]在研究大麦糊粉层细胞死亡时也发现,DNA片段化存在时空变化的特征,并证实最初发生PCD的细胞是在靠近胚的糊粉层里,而且其PCD的发生迟于糊粉层细胞α-淀粉酶mRNA的产生。Bethke等[1,13]的研究也证明了萌发种子糊粉层PCD受到糊粉层细胞与胚的位置效应的调控,离胚最近的糊粉层细胞率先发生PCD,这可能是因为植物激素GA是从胚产生的缘故。
2 激素对禾谷类种子糊粉层细胞程序性死亡的影响
从种子生物学角度来看,脱落酸(Abscisic Acid,ABA)分解作用和GA合成作用在种子萌发中起着重要作用[14-17]。在禾谷类种子糊粉层中,ABA与GA存在拮抗作用,并抑制编码糊粉层水解酶基因的表达[18]。GA处理大麦糊粉层原生质体后,其PCD与PSVs的液泡化是一致的,而ABA却阻止此过程发生[1-2]。Guo和Ho[19 ]观察大麦糊粉层细胞发现,在未加入激素时,糊粉层细胞中分布着许多小的蛋白贮藏液泡;如果用1 μmol·L-1GA处理48 h,这些小液泡合并成一个大液泡;但如果再加入20 μmol·L-1ABA同样处理48 h,大液泡的形成则被显著抑制(图1)。为了进行定量分析,将包含1~3个大液泡的细胞界定为液泡化的细胞,发现GA处理48 h后,液泡化细胞超过了80%,而ABA则显著抑制了细胞液泡化程度[19]。
GA能促进细胞内Ca2+浓度升高,诱导糊粉层细胞的程序性死亡,而ABA作用正好相反,它能阻断GA的效应,延缓糊粉层细胞的死亡[7]。ABA维持大麦糊粉层细胞中高表达的过氧化氢酶(Cata-lase,CAT)、抗坏血酸过氧化物酶(Ascorbate Per-oxidase,APX)和超氧化物歧化酶(Superoxide Dismutase,SOD)以清除活性氧(Reactive Oxygen Species,ROS),阻缓PCD;而GA则引起这些抗氧化酶活性快速下降,从而促进细胞死亡,这一点从试验中可以证实,GA处理的大麦糊粉层细胞在培养24~48 h都会死亡[20]。经GA处理的大麦糊粉层及其原生质体会分泌大量的蛋白酶、核酸酶和α-淀粉酶等水解酶[21]。而GA诱导大麦种子糊粉层α-淀粉酶的转录会受到ABA的显著抑制[22]。抗坏血酸(Ascorbic Acid,ASC)通过抑制GA和淀粉酶基因的表达调节GA的含量和淀粉酶的活性,ABA则通过降低GA合成酶的底物ASC的水平来抑制GA的积累。ABA和NADPH氧化酶抑制剂二联苯胺(Diphenyleneiodonium Chloride,DPI)都可以抑制GA合成的关键基因OsGA3ox和OsGA20ox的表达,并有效地抑制淀粉酶基因表达和酶活性。ABA和DPI不仅减少种子内GA的含量,而且还会通过减少ROS的产生来导致GA合成受抑[23]。用GA处理小麦(Triticumaestivum)糊粉层会诱导正在发生PCD过程的细胞产生一种核酸酶,该核酸酶能被Ca2+和Mg2+激活,但被Zn2+抑制,在PCD发生时积聚在细胞核周围。当GA合成受抑制时,或在对GA不敏感的突变体中则没有发现此核酸酶[24]。为此,Bethke等[1]认为,GA是启动大麦糊粉层PCD的一个信号,而ABA则是该过程的一个调控子。
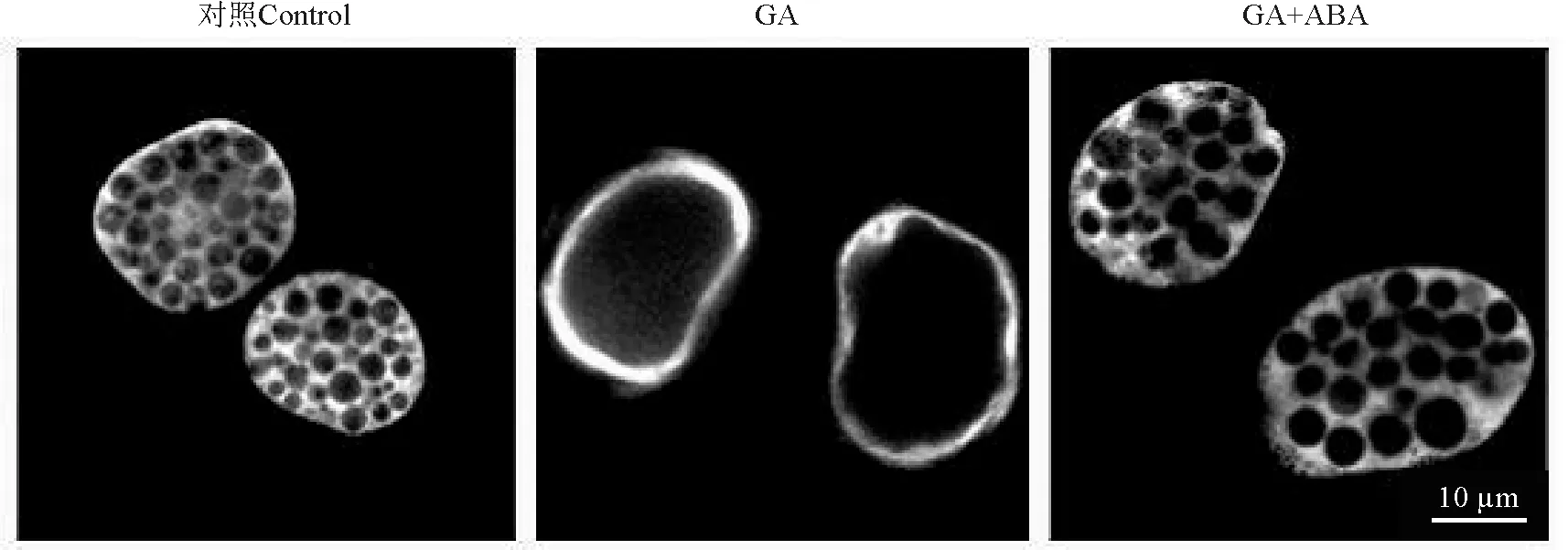
图1 GA和ABA处理后大麦糊粉层细胞液泡化程度[19] Fig.1 The cell vacuolation of barley aleurone in the treatment of GA and ABA[19]
3 活性氧协同激素作用于禾谷类种子糊粉层细胞程序性死亡
近年不少研究表明,ROS在种子萌发过程中起着关键的作用[25-27],同样,在激素调控糊粉层PCD过程中也扮演着重要的角色[28]。其中过氧化氢(Hydrogen Peroxide,H2O2)是导致糊粉层细胞程序性死亡的主要ROS[13]。Fath等[20,28]对大麦糊粉层PCD的研究表明,H2O2能够使经GA处理的大麦糊粉层细胞快速死亡。同时证实了经GA处理的糊粉层细胞,其过氧化氢酶、抗坏血酸过氧化物酶和超氧化物歧化酶的量和活性大幅度下降,使得活性氧积累,最终导致细胞发生氧化性损伤和死亡。此外,H2O2还有助于提高GA处理过的大麦糊粉层细胞原生质体死亡的速率,而抗坏血酸盐(Ascorbate,AsA)、二巯基苏糖醇(Reducatant Dithiothreitol,DTT)、丁基羟甲苯(Butylated Hydroxytoluene,BHT)和碘化钠等抗氧化物质则延缓PCD的发生,这些都证实了活性氧H2O2与糊粉层细胞死亡有关联[13,29]。经GA处理的糊粉层细胞中,编码CAT、APX和SOD的mRNA丰度下降;酶蛋白含量和活性显著下降,最终导致氧化性损伤,细胞死亡。而经ABA处理的糊粉层细胞中,编码CAT的mRNA丰度稍有上升,APX和SOD的酶蛋白含量较高,细胞仍然存活[20,28]。ABA诱导大麦糊粉层细胞总CAT活性的提高被GA所逆转,用ABA预先培养糊粉层3 d,然后再将其转移到GA中培养,结果引起了CAT活性迅速下降及细胞死亡[20]。内源H2O2可能参与GA诱导的小麦糊粉层PCD过程,CAT和APX介导的H2O2分解在该过程中起着重要作用。提高小麦糊粉层细胞清除H2O2的能力有助于延迟GA诱导的PCD的发生[29]。而且,Deng等[30]的研究表明,H2O2诱导的PCD是通过液泡介导实现的。
当大麦糊粉层细胞中含有GA时,H2O2对介导GA信号的初级转录抑制子SLN1的降解不产生影响,但提高GAMyb mRNA的水平。CAMyb是作用于SLN1下游的因子,并参与α-淀粉酶mRNA的诱导。此外,H2O2还抑制PKABA mRNA的水平,而PKABA mRNA是通过ABA:PKABA抑制GAMyb mRNA诱导来的。可见,在大麦糊粉层细胞中由GA诱导产生的H2O2是拮抗ABA信号的一个信号分子[31]。
4 NO、CO/HO-1对禾谷类种子糊粉层细胞程序性死亡发生的调节
一氧化氮(Nitric Oxide,NO)和一氧化碳(Carbon Monoxide,CO)均为生物体内重要的气体信号分子,对植物种子萌发、生长发育等生理过程起着重要的调控作用。
NO可能是大麦糊粉层PCD过程中的一个内源调节子[32]。种子萌发过程中产生的NO可能还与种子对ABA和GA的敏感性的改变有关[2]。外源NO供体硝普钠(Sodium Nitroprusside,SNP)能延缓GA和ROS诱导的糊粉层PCD的进程[28,32],减少CAT和SOD的损失,但并不影响GA诱导的α-淀粉酶的合成和分泌[32]。外源NO供体能缓解GA诱导的大麦糊粉层CAT和POD活性的下降,并延迟GA诱导的大麦糊粉层PCD的发生,而NO清除剂2-(4-羧基苯)-4,4,5,5-四甲基咪唑-1-氧-3-氧化物钾盐[2-(4-carboxyphenyl)-4,4,5,5- tetramethylimidazoline-1-oxyl-3-oxide potassium salt,cPTIO]则逆转NO供体维持细胞活力的效应。BHT与NO供体有着类似的作用,均能延缓GA诱导大麦糊粉层细胞PCD的进程[32]。
李江[11]通过研究外源CO、NO对干旱胁迫下水稻种子的萌发、DNA降解及细胞存活率的影响,发现外源CO、NO供体可以有效提高干旱胁迫下萌发水稻种子糊粉层细胞的存活率,其效应可以被各自专一性抑制剂锌原卟啉(Zinc Protoporphyrin IX,ZnPPⅨ)或清除剂cPTIO所逆转,同时CO的作用被NO专一性清除剂cPTIO所阻截,但CO合成酶抑制剂ZnPPⅨ却无法阻挡NO减缓糊粉层细胞死亡的进程。因此,推测CO可能作用于NO信号途径的上游,通过NO的介导延缓干旱诱导的糊粉层细胞DNA的降解和细胞死亡率的上升。
血红素加氧酶(Heme Oxygenase,HO)是血红素分解代谢过程中的限速酶,它能使细胞内的血红素降解成CO和胆绿素。HO可以作为一道屏障抵抗胁迫,减少植物受到的氧化损伤,发挥类似激素的作用[33]。HO-1诱发剂高铁血红素(Hematin,Ht)可以显著提高干旱胁迫下水稻种子的发芽率、发芽势、芽长、根长及淀粉酶活性,显著增加种子的可溶性蛋白含量和脯氨酸含量,并不同程度地诱导SOD、CAT和POD等抗氧化酶的活性[34]。Wu等[29]的研究表明,维持小麦糊粉层细胞中较高的HO表达水平对延缓PCD的发生是非常重要的。HO-1表达量及活性的提高可以降低H2O2含量,从而延缓GA对小麦糊粉层细胞PCD的诱导效应。抗氧化剂BHT、DTT和AsA与高铁血红素和CO饱和溶液一样具有缓解PCD和上调HO的表达的效应。由GA诱导的小麦糊粉层PCD受到CO饱和溶液和HO-1诱导剂高铁血红素不同程度地阻缓[26]。
5 研究展望
种子萌发是受到许多内部因子协同调控的一个复杂过程[35]。禾谷类作物糊粉层PCD是禾谷类作物种子萌发过程的关键性事件,它决定着种子能否正常萌发,幼苗能否正常生长。大量的研究证明,植物PCD是由一个基因群编制的程序严格控制的有序的复杂分子过程。此过程受细胞内外多种信号系统的诱导和细胞内多种基因的级联反应的调控,各种PCD的诱导因子和阻止PCD的存活因子作用于此级联反应的不同环节。虽然目前已有大量的试验证据表明GA是诱导禾谷类作物糊粉层PCD的关键因子,并且活性氧、气体信号分子NO、CO等均参与此PCD过程的调控,但对这些因子间的相互作用机制仍不了解。
糊粉层PCD最显著的特征是细胞液泡化。van Doorn等[36]认为,细胞质被吞没及物质被降解是液泡介导的细胞死亡中细胞解体的重要机制。而现今,关于“细胞液泡化的发生是被调控的?糊粉层细胞内哪些基因的激活或抑制引发了PCD?”等问题仍不清楚,所以,目前仍无法清楚地阐述禾谷类糊粉层细胞死亡的机制。随着对植物细胞程序性死亡的深入研究,相信在不久的将来,对植物PCD的生化途径将有更进一步的认识。
[1] Bethke P C,Lonsdale J E,Fath A,etal.Hormonally regulated programmed cell death in barley aleurone cells[J].Plant Cell,1999,11(6):1033-1046.
[2] Bethke P C,Libourel I G L,Aoyama N,etal.TheArabidopsisaleurone layer responds to nitric oxide,gibberellin,and abscisic acid and is sufficient and necessary for seed Dormancy[J].Plant Physiology,2007,143(3):1173-1188.
[3] Caspers M P M,Lok F,Sinjorgo K M C,etal.Synthesis,processing and export of cytoplasmic endo-β-1,4-xylanase from barley aleurone during germination[J].Plant Journal,2001,26:191-204.
[4] Gunawadena A H,L A N,Pearce D E,Jacksen M B,etal.Characterization of programmed cell death during aerenchyma formation induced by ethylene or hypoxia in roots of mazie (ZeamaysL.)[J].Planta,2001,212(2):205-214.
[5] Fath A,Bethke P C,Jones R L.Barley aleurone cell death is not apoptotic:Characterization of nuclease activities and DNA degradation[J].The Plant Journal,1999,20(3):305-315.
[6] Fath A,Bethke P,Lonsdale J,etal.Programmed cell death in cereal aleurone[J].Plant Molecure Biology,2000,44(3):255-266.
[7] Pennell R I,Lamb C.Programmed cell death in plants[J].The Plant Cell,1997,9(7):1157-1168.
[8] 田向荣,欧阳学智,宋松泉.种子发育与萌发过程中的程序性细胞死亡[J].云南植物研究,2003,25(5):579-588.
[9] Okamoto K,Murai T,Eguchi G,etal.Enzymic mechanism of starch breakdown in germinating rice seeds Ⅱ:Ultrastructural changes in scutellar epithelium[J].Plant Physiology,1982,70(3):905-911.
[10] 王忠,顾蕴洁,李卫芳,等.水稻糊粉层的形成及其在萌发过程中的变化[J].扬州大学学报(自然科学版),1998,1(1):19-24.
[11] 李江.CO、NO缓解干旱胁迫对水稻种子萌发过程的氧化伤害及延迟糊粉层PCD的发生[D].海口:海南大学,2010:27-42.
[12] Wang M,Oppedijk B J,Lu X,etal.Apoptosis in barley aleurone during germination and its inhibition by abscisic acid[J].Plant Molecure Biology,1996,32(6):1125-1134.
[13] Bethke P C,Jones R L.Cell death of barlay aleurone protoplasts is mediated by reactive oxygen species[J].The Plant Journal,2001,25(1):19-29.
[14] Ogawa M,Hanada A,Yamauchi Y,etal.Gibberellin biosythesis and response duringArabidopsisseed germination[J].The Plant Journal,2003,15(7):1591-1604.
[15] Saito S,Hirai N,Matsumoto C,etal.ArabidopsisCYP707As encode (+)-abscisic acid 8′-hydroxylase, a key enzyme in the oxidative catabolism of abscisic acid[J].Plant Physiology,2004,134(4):1439-1449.
[16] Okamoto M,Kuwahara A,Seo M,etal.CYP707A1 and CYP707A2, which encode ABA 80-hydroxylases, are indispensable for a proper control of seed dormacy and germination inArabidopsis[J].Plant Physiology,2006,141(1):97-107.
[17] Seo M,Hanada A,Kuwahara A,etal.Regulation of hormone metabolism inArabidopsisseeds:Phytochrome regulation of abscisic acid metabolism and abscisic acid regulation of gibberellin metabolism[J].The Plant Journal,2006,48(3):354-366.
[18] Ho T H D,Gomez-Cadenas A,Zentella R,etal.Crosstalk between gibberellin and abscisic acid in cereal aleurone layer[J].Journal of Plant Growth Regulation,2003,22:185-194.
[19] Guo W J,Ho T H D.An abscisic acid-induced protein, HVA22, inhibits gibberellin-mediated programmed cell death in cereal aleurone cells[J].Plant Physiology,2008,147(4):1710-1722.
[20] Fath A,Bethke P C,Jones R L.Enzymes that scavenge reactive oxygen species are down-regulated prior to gibberellic acid-induced programmed cell death in barley aleurone[J].Plant Physiology,2001,126(1):156-166.
[21] Jones R L,Jacobsen J V.Regulation of synthesis and transport of secreted protein in cereal aleurone[J].International Review of Cytology,1991,126:49-88.
[22] Zentella R,Yamauchi D,Ho T H D.Molecular dissection of the gibberellin/abscisic acid signaling pathways by transiently expressed RNA interference in barley aleurone cells[J].The Plant Cell,2002,14(9):2289-2301.
[23] Ye N H,Zhu G H,Liu Y G,etal.Aacorbic acid and reactive oxygen species are involved in the inhibition of seed germination by abscisic acid in rice seeds[J].Journal of Experimental Botany,2012,63(5):1809-1822.
[24] Dominguez F,Moreno J,Cejudo F J.A gibberellin-induced nuclease is localized in the nucleus of wheat aleurone cells undergoing programmed cell death[J].Journal of Biological Chemistry,2004,279(12):11530-11536.
[25] Oracz K,Bouteau H E M,Farrant J M,etal.ROS production and protein oxidation as a novel mechanism for seed dormancy alleviation[J].The Plant Journal,2007,50(3):452-465.
[26] Müller K,Carstens A C,Linkies A,etal.The NADPH-oxidase AtrbohB plays a role inArabidopsisseed after-ripening[J].New Phytologist,2009,184(4):885-897.
[27] Liu Y,Ye N,Liu R,etal.H2O2mediates the regulation of ABA catabolism and GA biosynthesis inArabidopsisseed dormancy and germination[J].Jouranl of Experimental Botany,2010,61(11):2979-2990.
[28] Fath A,Bethke P,Beligni V,etal.Active oxygen and cell death in cereal aleurone cells[J].Journal Experimental Botany,2002,53(372):1273-1282.
[29] Wu M Z,Huang J J,Xu S,etal.Haem oxygenase delays programmed cell death in wheat aleurone layers by modulation of hydrogen peroxide metabolism[J].Journal of Experimental Botany,2011,62(1):235-248.
[30] Deng M J,Bian H W,Xie Y K,etal.Bcl-2 suppresses hydrogen peroxide-induced programmed cell death via OsVPE2 and OsVPE3,but notviaOsVPE1 and OsVPE2,in rice[J].FEBS Journal,2011,278(24):4797-4810.
[31] Ishibashi Y,Tawaratsumida T,Kondo K,etal.Reactive oxygen species are involved in gibberellin/abscisic acid signaling in barley aleurone cells[J].Plant Physiology,2012,158(4):1705-1714.
[32] Beligni M V,Fath A,Bethke P C,etal.Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone layers[J].Plant Physiology,2002,129(4):1642-1650.
[33] Shekhawat G S,Verma K.Haem oxygenase (HO):An overlooked enzyme of plant metabolism and defence[J].Journal of Experimental Botany,2010,61(9):2255-2270.
[34] 李江,吴黄铭,陈惠萍.外源CO、NO对干旱胁迫下水稻种子萌发过程氧化损伤的缓解效应[J].西北植物学报,2011,31(4):731-738.
[35] Kucera B,Cohn M A,Leubner-Metzger G.Plant hormone interactions during seed dormancy release and germination[J].Seed Science Research,2005,15:281-307.
[36] van Doorn W G,Beers E P,Dangl J L,etal.Morphological classification of plant cell deaths[J].Cell Death and Differentiation,2011,18(8):1241-1246.

