结缕草种质抗锈病表现田间联合测试与抗性种质筛选
范少先,王小山,谷光璞,孙洁峰,王赟文
(1.中国农业大学动物科学技术学院草业科学系 北京市草业科学重点实验室,北京 100193;2.扬州大学动物科学与技术学院草业科学系,江苏 扬州 225000; 3.海源草坪有限公司,山东 胶州 266300)
结缕草(Zoysiajaponica)也称日本结缕草,是当今世界上公认的优良草坪草[1],适应性广,耐干旱、受病虫和病害影响相对较小[2],低养护管理下表现也很好。锈病是一种常见的气传性结缕草真菌病害,由结缕草柄锈菌(Pucciniazoysiae)引起,主要危害其叶片和叶鞘[3-4],发病普遍、持续时间长。在发病初期,受害部位出现褪绿斑点,随着病害加重,在病部形成黄锈色疱状孢子堆,继而散发出橙黄色夏孢子。有风时,锈病孢子随风迅速蔓延,引起大片病害,严重时会导致植物枯萎死亡。锈病的发生和发展,使结缕草草坪的观赏和坪用价值显著降低[5]。何秋等[5]报道结缕草锈病在南京全年有4个发病高峰,其中6月中旬、7月中旬和8月上旬分别有3个发病小高峰,而10月下旬达到发病大高峰。通过结缕草属的日本结缕草、中华结缕草(Z.sinica)、沟叶结缕草(Z.matrella)和细叶结缕草(Z.tenuifolia)4个种的种内和种间组配形成14个杂交组合,获得68份种质材料[6]。对这些材料的锈病发病规律和严重程度的调查表明,种内杂交后代的始病期、耐病性和发病程度均优于亲本[6]。张露明[7]对收集的162个结缕草种在北京地区进行了锈病发生情况田间和温室接种测定,结果表明,北京地区结缕草锈病病情指数整体呈单峰型,病情始发期于6月初至7月中旬,发病高峰期集中于9月中旬至10月上旬;参试种质材料田间抗锈性鉴定筛选和温室接种抗性鉴定结果基本一致,以其中的11个抗病单株和11个感病单株,对67对已确定的与抗锈病基因紧密连锁的小麦(Triticumaestivum)、大麦(Hordeumvulgare)和多年生黑麦草(Loliumperenne)SSR标记进行适用性扩增筛选,能够有效扩增的引物为35对,其中具有明显多态性条带的有28对,占参试引物的41.8%;多年生黑麦草抗冠锈病(P.coronataf.sp.lolii)QTL连锁的LpSSR01A07和LpSSR059 SSR标记和小麦抗秆锈病(P.graminisf.sp.tritici)主效基因Sr2连锁的Xgwm533 SSR标记在参试的结缕草锈病抗感材料之间具有较为一致的多态性表现。
培育抗锈病的结缕草品种是一种长期有效防治结缕草锈病危害的方法,具有经济、环保和持续时间较长等优点。抗病品种选育前提是种质资源的收集与准确评价。考虑到造成植物锈病发生的病原菌,生理小种的多样性,以及病害发生受环境条件作用而表现出的地域性特点,本研究利用张露明[7]初步评价获得的40余份结缕草种质材料,通过分株营养繁殖的方法,同时在山东省胶州市和江苏省扬州市两地,按照抗病、感病和对照3组进行联合测试,旨在:1)在更大的地域范围内确定抗锈病种质的表现型;2)研究环境与锈病抗、感表现型的互作关系;3)从原始群体中按照高抗和高感进行歧化选择的有效性。
1 材料与方法
1.1供试材料 在张露明[7]对参试的162份结缕草单株营养体种质材料进行评价的基础上,选择17份感病、19份抗病和26份随机选择的单株种质材料,形成感病、抗病和对照种质材料群体,通过同一单株材料分株营养繁殖的方法,分别在2010年7月和8月移栽到位于山东省胶州市营海工业园的胶州海源草坪有限公司院内(36°15′52″ N,120°00′48″ E,海拔50 m)和江苏省扬州市扬州大学扬子津校区动物科技学院草业科学系试验地(32°22′45″ N,119°23′33″ E,海拔35 m)。每份材料重复3次,小区面积1 m×1 m,各小区间距1 m,随机区组排列。由于移栽后个别参试植株未能成活,以及从平衡区组设计的统计分析需要考虑,两个参试地点仅对3次重复均成活的材料进行统计分析。各地点两个年份实际分析的种质材料数量见表1。山东省胶州市试验地因道路施工原因,2011年测试的材料较上一年有所减少。
试验地主要管理措施是日常除草和切断匍匐茎,防止相邻小区植株相互入侵。在江苏省扬州市试验点,为促进株丛生长和扩展,在2011年4月初剪草1次,不灌溉和施肥。山东省胶州市则为自然生长,植株移栽后灌溉3次,其后不灌溉和施肥。
1.2锈病发病程度调查 分别于2010年10月23日和2011年10月22日对山东省胶州市试验点结缕草参试种质材料的锈病田间发病情况进行了观测,其中2010年根据植株叶片的病叶率情况统计了发病严重度指标,2011年则调查了发病严重度和病叶率两项指标。2011年11月9日观测了江苏省扬州市试验点参试结缕草种质材料的锈病田间发病严重度和病叶率两项指标。
病叶率调查是根据参试种质株丛发病的叶片占所有绿色叶片的比例目测估计得到,并根据株丛病叶率及严重程度评估参试材料的发病严重度。严重度划分为8个等级,分值为0~7。具体分级标准为:0级,未发病;1级,病叶率为1%~5%,发病较轻,夏孢子零星分布;2级,病叶率为6%~10%,发病轻微,夏孢子密度小;3级,病叶率为11%~20%,发病中等,夏孢子均匀分布;4级,病叶率为21%~40%,发病略重,夏孢子密度大;5级,病叶率为41%~60%,发病较重,夏孢子多且密度更大;6级,病叶率为61%~80%,发病严重,夏孢子成堆排列;7级,病叶率为81%~100%,发病很重,夏孢子几乎铺满叶片。
根据参试结缕草发病严重度,可将其侵染型划分为4类:0分(未发病)、0.1~1.9分(高度抗病)、2.0~2.9分(中度抗病)、3.0~3.9分(中度感病)、4分以上(高度感病)。
1.3数据分析 首先单独对每个试验地点在2010年和2011年的观测结果进行方差分析。方差分析模型为作物品系性状早期比较试验常用的分组内重复设计的统计分析线性模型[8]。测验:1)抗病、感病和对照3组之间锈病病叶率和(或)发病严重度的差异显著性;2)上述3组内参试种质之间差异的显著性;3)区组的环境误差、区组与组内种质材料的互作效应。原始数据经Bartlett测验和Levene测验表明参试样本的方差同质。其次,将2010年和2011年山东省胶州市、2011年江苏省扬州市观测结果视为3个独立的环境测定结果,根据袁志发和周静芋[9]介绍的作物多地点方差分析模型,对3个点-年环境、参试种质材料、参试材料与点-年环境之间的互作、试验误差进行显著性测验,从而确定抗病与感病种质材料性状表现受环境的作用效应。以上统计分析均采用SAS 8.2软件GLM命令编程实现。
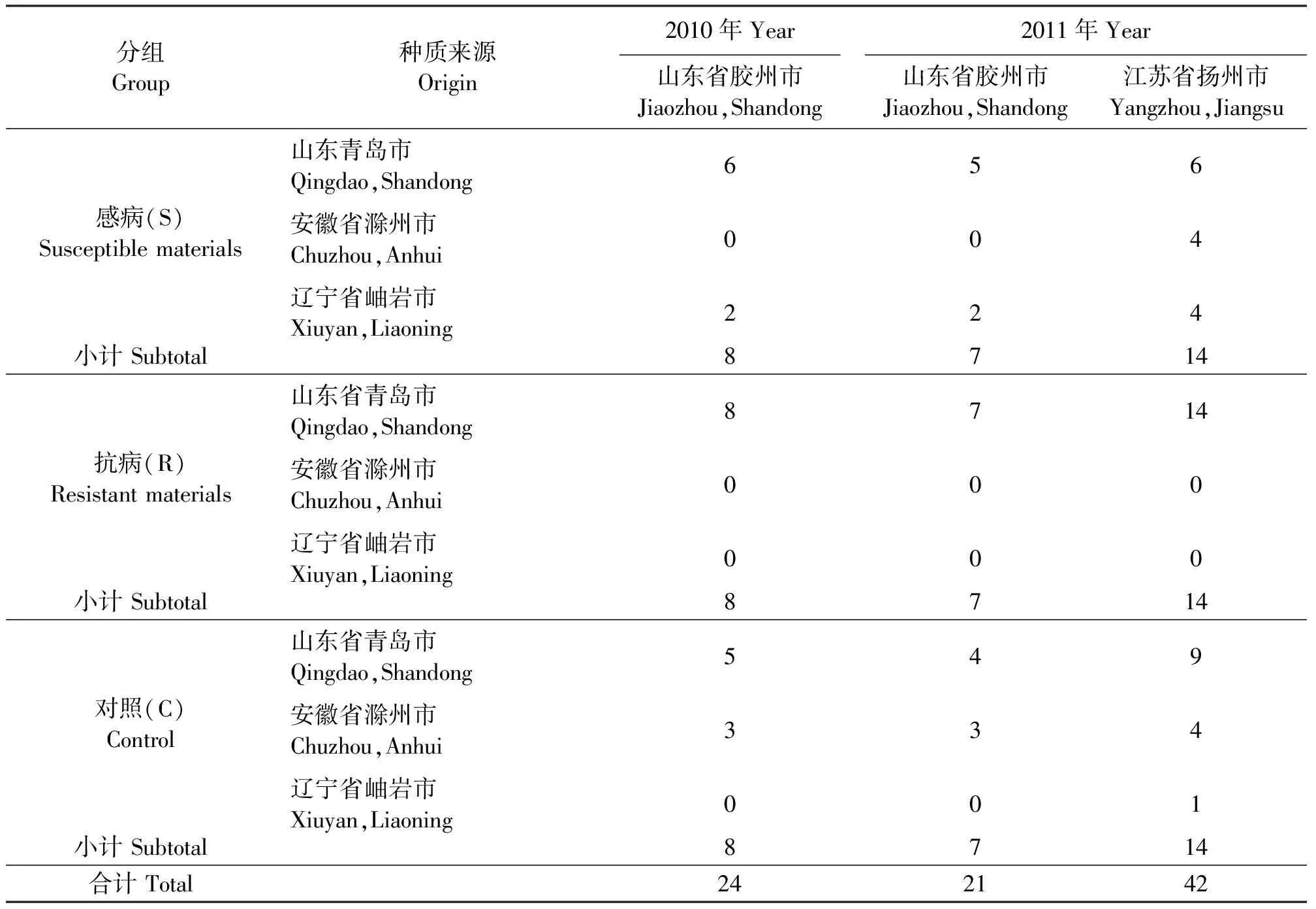
表1 山东省胶州市和江苏省扬州市参试材料来源和数量Table 1 Tested zoysiagrass materials origin and number
2 结果与分析
2.1江苏省扬州市试验点观测结果 江苏省扬州市移栽的参试材料中,从抗锈病、感锈病和对照群体中对分株种植后3次重复均存活的材料(各14份合计42份材料)的2011年结缕草锈病病叶率和发病严重度进行方差分析。结果表明,抗锈病、感锈病和对照组3个类型之间,结缕草锈病病叶率和发病严重度差异极显著(P<0.001),各类型内的参试材料观测指标的差异极显著(P<0.001),而重复间差异则不显著(P>0.05)(表2-5)。从结缕草叶片的锈病发病比较来看,抗锈病群体(31.0%)<感锈病群体(48.5%)<对照群体(55.6%),而从发病严重度比较,抗锈病群体(2.5)<对照群体(2.7)<感锈病群体(3.8)。这一结果反映出之前对抗锈病和感锈病群体进行的筛选在群体水平上取得了明显的效果。
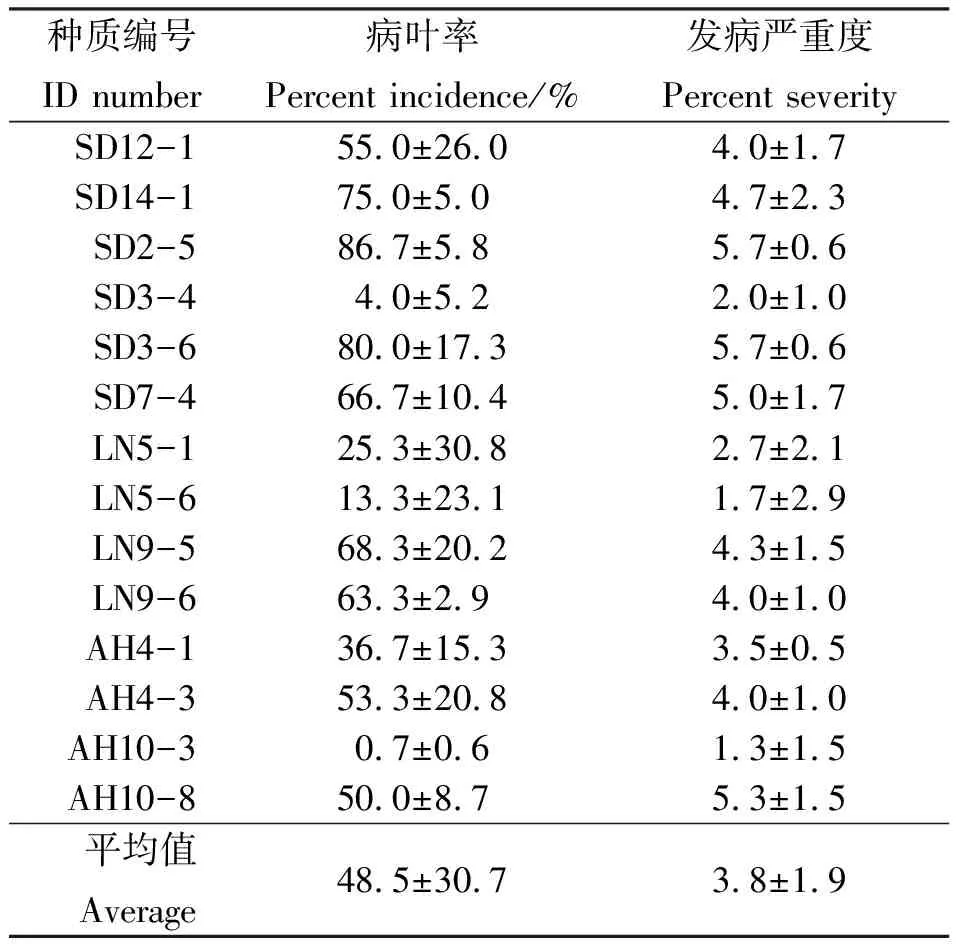
表2 2011年扬州市感锈病结缕草参试材料发病情况Table 2 Rust disease assessment of susceptible zoysiagrass lines at Yangzhou in 2011

表3 2011年扬州市对照结缕草参试材料发病情况Table 3 Rust disease assessment of control zoysiagrass lines at Yangzhou in 2011

表4 2011年扬州市抗锈病结缕草参试材料发病情况Table 4 Rust disease assessment of resistant zoysiagrass lines at Yangzhou in 2011

表5 2011年扬市州对照、抗锈病和感锈病抗锈病结缕草参试材料发病情况方差分析Table 5 Rust disease assessment of control,resistant,and susceptible zoysiagrass lines at Yangzhou in 2011
进一步分析感病、抗病和对照3组当中各锈病种质材料的组成比例,感病群体中中度感病和高度感病的材料共有10个,占感病群体总数的71.4%;抗病群体中中度抗病、高度抗病和未发病的材料共有9份,占64.3%;而对照群体抗病材料6份和感病材料8份,比例大体相当(表2-5)。参试种质材料当中,抗病表现最强的是从山东半岛收集的11-1和2-2两份材料,而最易感病的材料是从山东半岛收集的2-5和3-6。
2.2山东省胶州市2010年和2011年试验点观测结果 山东省胶州市试验点2011年结缕草锈病的总体发病程度较2010年严重。利用从2010年移栽胶州市试验点的参试材料当中,抗锈病、感锈病和对照群体中随机选取分株种植后3次重复均存活的材料各8份,共24份材料对当年锈病发病严重度进行方差分析。结果表明,抗锈病、感锈病和对照组3个类型之间,结缕草锈病发病严重度的差异极显著(P<0.001),各类型内的参试材料观测指标的差异极显著(P<0.001),而重复间差异则不显著(P>0.05)(表6)。抗锈病群体和对照群体的平均发病严重度均小于感锈病群体。感病群体以中感和高感为主,共有7份,占87.5%,抗病群体材料当年均未表现出发病症状,对照材料的发病严重程度比较低(表6)。
2011年,对抗锈病、感锈病和对照群体各7份材料,共计21份材料对当年的锈病病叶率和发病严重度进行方差分析。各分组的差异显著性与上年相同(表7),而锈病病叶率则表现出抗锈病群体(0.3%)<对照群体(78.7%)<感病群体(95.5%),发病严重度比较,抗锈病群体(0.3)<对照群体(5.5)<感锈病群体(6.9)(表6),与2011年江苏省扬州市试验点的结果(表2-4)相似。
综合2010和2011年山东省胶州市试验点的观测结果,参试的抗病群体中11-1和11-3均未发病;2-2和2-3在2010年均未发病,而在2011年表现为高抗;感病群体中的9-5和14-1两年观测均表现为感病,感病程度略有不同;而12-1在2010年表现为中抗,2011年表现高感(表6)。
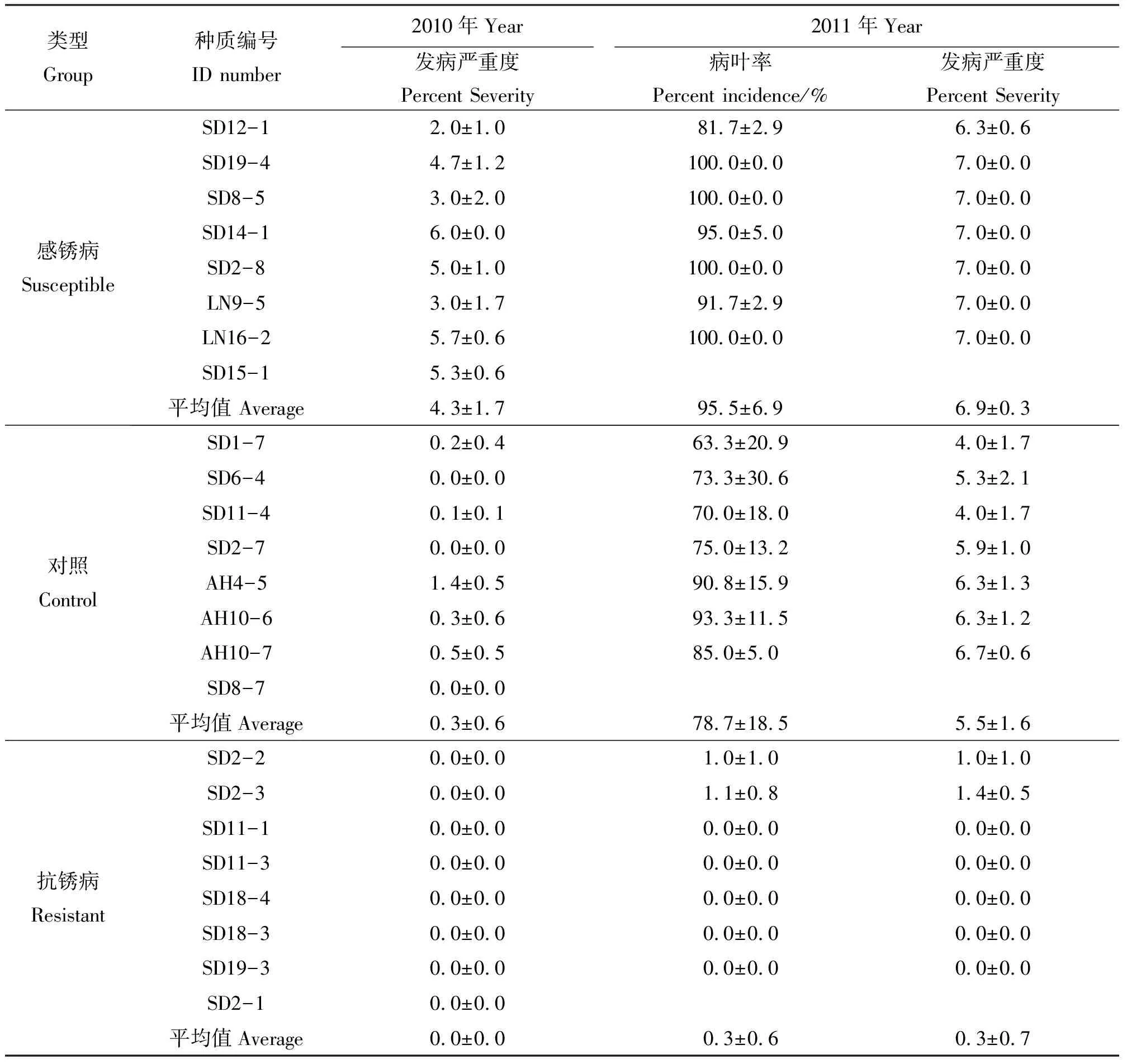
表6 参试结缕草种质材料在山东省胶州市2010年和2011年发病情况Table 6 Rust disease assessment at Jiaozhou, Shandong in 2010 and 2011

表7 山东省胶州市2010年和2011年参试种质材料锈病评价结果的方差分析Table 7 F-test for rust disease parameters of tested accessions at Jiaozhou, Shandong in 2010 and 2011
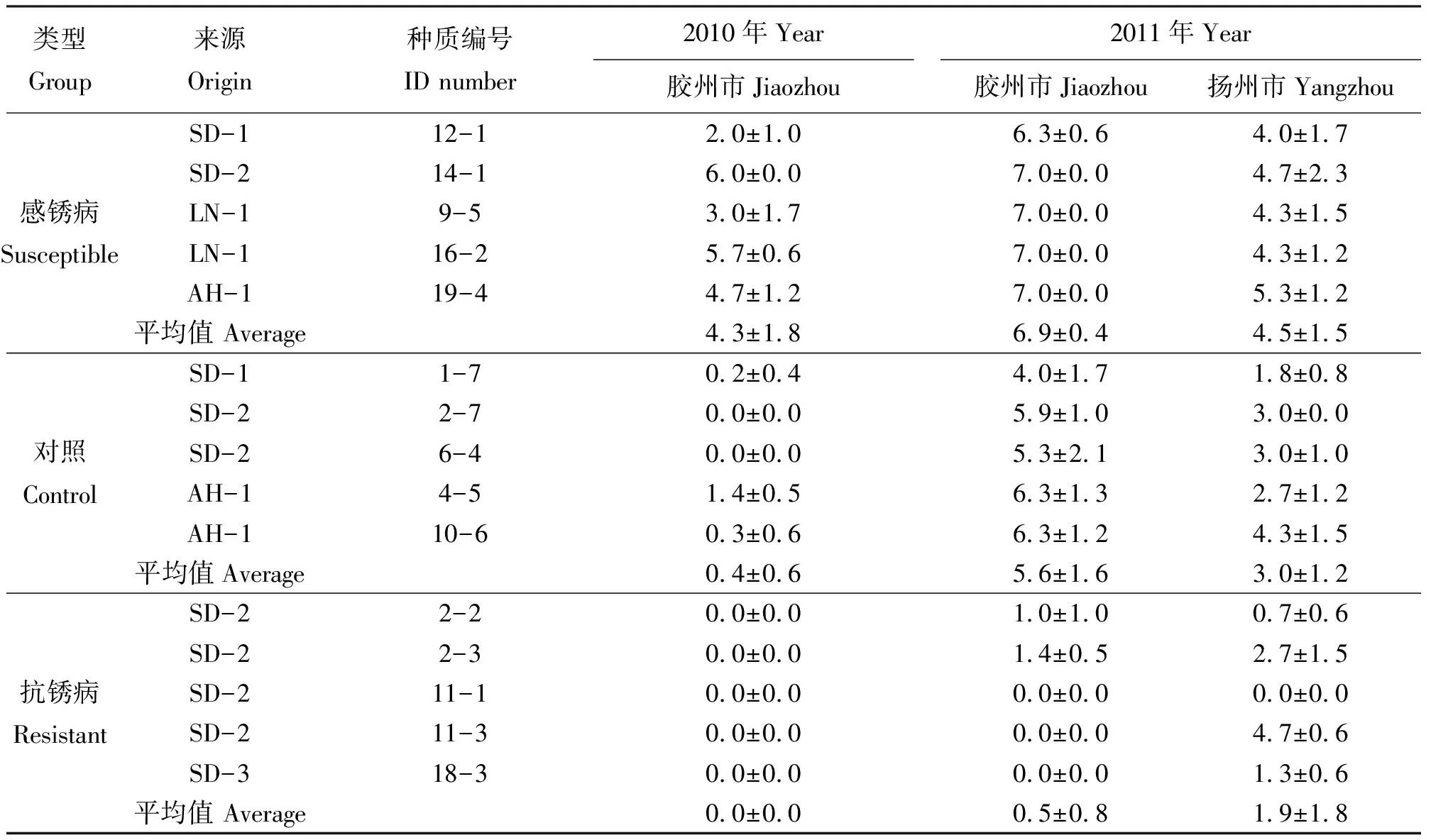
表8 胶州市和扬州市两地两年发病严重度联合测试Table 8 Combined testing of rust disease percent severity of two locations in two years

表9 胶州市和扬州市两地两年发病严重度联合测试方差分析Table 9 F-test for combined testing of rust disease percent severity of two locations in two years
2.3两个地点3次观测结果的联合测试 对上述参试材料当中,从江苏省扬州市和山东省胶州市两个地点、两年3次观测数据结果完整的抗锈病、感锈病和对照群体中各取5份材料,对结缕草发病严重度进行联合方差分析。结果表明,江苏省扬州市和山东省胶州市两个地点的发病严重度差异极显著(P<0.001),抗锈病、感锈病和对照组3个类型之间,发病严重度差异极显著(P<0.001),而各地点重复之间差异不显著(P>0.05)(表8-9)。这一结果表明,结缕草锈病的发病情况存在地域性差异,同时在所收集的种质材料当中,进行的抗病和感病选择取得了显著效应。
参试材料当中,11-1、2-2和2-3在两地3次观测均表现为抗病,且11-1均表现未发病,可作为抗锈病亲本进一步选育抗锈病结缕草品种;11-3材料在山东省胶州市2年观测结果中表现抗病,但在2011年江苏省扬州市观测中表现为感病,不排除两地发生的结缕草锈病的病原菌存在不同的生理小种;而3份感病材料9-5、12-1和14-1在3次观测中均表现为感病(表8)。
3 讨论
结缕草锈病在结缕草属3种主要的草坪草种(日本结缕草、沟叶结缕草和细叶结缕草)上均有发病报道,是一种流行广泛、对结缕草草坪危害较为严重的专性寄生的真菌病害。当夏孢子附着在叶片表面,温度和湿度合适时,夏孢子萌发侵染结缕草叶片。锈菌夏孢子的萌发和侵入最适温度为15~22 ℃,相对湿度为100%或叶片表面有水膜的条件下萌发,适宜的潜育期为8~12 d。当夏季空气湿度很大时,降水或者灌溉导致排水不良的地区容易导致结缕草锈病大流行。结缕草锈病的发病起始期及其发病程度会因不同经纬度和当地湿度变化有所不同。美国堪萨斯州结缕草锈病8-9月初发病,病情持续整个秋季;而阿拉巴马州,结缕草锈病病情指数分别在5月和7月达到两个高峰期;我国辽宁等地区结缕草锈病的发病时期为7月末-10月初。北京地区结缕草锈病病情指数呈单峰型,病情始发期集中于6月初-7月中旬,发病高峰为9月中旬-10月上旬。重庆结缕草锈病主要发生于4月上旬,5月上中旬出现第1次高峰,6月初,叶片上出现冬孢子堆。8月锈病发生停止,9月中旬,叶片有产生夏孢子和冬孢子堆,10月形成第2次高峰,11月下旬-12月初病害停止[10]。南京地区结缕草属植物锈病始病期集中在5月初-6月初,冬孢子堆在9月中旬-10月中旬出现,全年病情指数在7月中旬-8月上旬及10月下旬-11月上旬两个高峰期[5]。本研究表明,在位于长江流域的江苏省扬州市和山东半岛的胶州地区,结缕草锈病的发病程度存在年份和地点之间的差异。由此可见,受温度和湿度等环境条件影响,结缕草锈病发病时期和严重程度均不同,位于我国长江中下游的扬州、南京等地结缕草的发病期长,发病程度较北方地区严重,可以作为结缕草种质抗锈病性状评价的适宜地点。
除温度和湿度等环境因素影响外,结缕草锈病的发病与病情危害程度还受到病原菌及其转主寄主等因素的影响。锈菌生活史中可产生最多5种类型的孢子:性孢子、锈孢子、夏孢子、冬孢子和担孢子。Harada[11]报道了结缕草锈菌的锈孢子、夏孢子和冬孢子亮视野显微形态照片。Dery和Kulik[12]报道了结缕草锈菌的锈孢子、夏孢子和冬孢子对结缕草和鸡矢藤侵染和生长的情况。Asuyama[13]提出结缕草锈菌的转主寄主为藤本植物鸡矢藤(Paederiascandens),广泛分布在我国长江流域及以南各省区。然而,目前国内外均没有在自然条件下从转主寄主鸡矢藤上发现结缕草锈菌的报道。结缕草锈菌是一种典型的长生活史的锈菌,能够在没有转主寄主的条件下在结缕草属植物上完成寄生存活。在一个生长季,锈菌夏孢子可以连续产生多次,不断传播。在禾草茎叶周年存活的地方,锈菌以夏孢子或菌丝体在发病部位越冬。在寒冷地区,冬季禾草地上部分死亡的地区,锈菌的夏孢子或菌丝体不能越冬,而产生的冬孢子不易萌发,在侵染循环中作用不大,第2年春季由越冬地区随气流传来的夏孢子引起新的侵染[14]。转主寄主鸡矢藤的存在与否对两地结缕草锈病的发生和流行的影响还有待进一步研究。
本研究在广泛收集结缕草种质材料的基础上,通过田间和温室接种病原菌后锈病发病情况,筛选出抗病和感病的种质材料。通过江苏省扬州市和山东省胶州市两地的3次观测,抗病材料和感病材料总体表现出显著的差异,表明结缕草抗锈病选择的有效性。同时,这些歧化选择获得的材料也为通过杂交构建作图群体,进而筛选连锁分子标记或发掘性状关联位点提供了理想的亲本材料。植物抗病性的持久性除取决于病原菌毒性基因质量及环境条件的影响外,还取决于抗病基因的品质[15-17]。发掘、利用高品质抗锈基因对于培育抗病品种至关重要。一般来说,抗锈病种质有数量性状和质量性状的不同,研究者们将其分为垂直抗性、水平抗性和慢锈性[18-20]。垂直抗性受环境影响较大,抗锈病性状不稳定;水平抗性受环境影响相对较小,可表现出稳定抗性;慢锈性表现为推迟发病[21-23]。对于评价获得的11-1、2-2和2-3等抗病材料,其抗病遗传机制、性状的遗传率和对应的病原菌生理小种等情况也是下一步需要着重研究的内容。
[1] 董厚德,宫莉君.中国结缕草生态学及其资源开发与应用[M].北京:中国林业出版社,2001.
[2] Kreitlow K W,Juska F V,Haard R T.A rust onZoysiajaponicanew to North America[J].Plant Disease Reporter,1965,49:185-186.
[3] Cummins,G B.The Rust Fungi of Cereals,Grasses and Bamboos[M].Berlin:Springer-Verlag,1971:339.
[4] 何秋.结缕草属(ZoysiaWilld)植物种质资源的锈病危害及抗病性研究[D]南京:南京农业大学,2006:29-41.
[5] 何秋,刘建秀,侯庆树.南京地区结缕草属植物锈病病原物鉴定及其发病规律的初步研究[J].江苏农业科学,2006(6):155-157.
[6] 何秋,刘建秀.我国暖季型草坪草锈病的研究进展[J].中国野生植物资源,2005,24(2):9-11.
[7] 张露明.结缕草种质抗锈评价与SSR分子连锁标记的筛选[D].北京:中国农业大学,2009:20.
[8] 盖钧镒.试验统计方法[M].北京:中国农业出版社,2000.
[9] 袁志发,周静芋.试验设计与分析[M].北京:高等教育出版社,2000.
[10] 丁廷发.结缕草锈病及其防治[J].植物医生,2000(3):28-29.
[11] Harada Y.Inoculation experiments and some morphological observations onPucciniafestucaeandP.zoysiae[J].Transactions of the Mycological Society of Japan,1980,21:449-455.
[12] Dery P D,Kulik M M.A new triple-stain useful in the differentiation of fungal parasites from host tissue[J].Phytopathology,1980,81:1238.
[13] Asuyama H.The life-cycle of heteroecious species ofPuccinia.1.PucciniaculmicolaDiet.andP.zoysiaeDiet[J].Annals of the Phytopathological Society of Japan,1935,5:23-29.
[14] 翁启勇,王青松,何玉仙,等.福建草坪草病害初报[J].草业学报,1997,6(2):70-73.
[15] Lackermann K V,Conley S P,Gaska J M,etal.Effect of location,cultivar,and diseases on grain yield of soft red winter wheat in Wisconsin[J].Plant Disease,2011,95:1401-1406.
[16] Lackermann K V,Esker P D.Application of a rank-based method for improved cultivar selection in soft red winter wheat[J].Plant Disease,2011,95:1407-1413.
[17] Rajaram S,Torres E.An integrated approach to breeding for disease resistance:the CIMMYT wheat experience[M].In:Smith E L.Genetic Improvement in Yield of Wheat[M].Madison:Crop Science Society of America and American Society of Agronomy,1986:55-70.
[18] Studer B,Boller B,Bauer E,etal.Consistent detection of QTLs for crown rust resistance in Italian ryegrass (LoliummultiflorumLam.)across environments and phenotyping methods[J].Theoretical and Applied Genetics,2007,115:9-17.
[19] Czembor E,Feuerstein U,Zurek G.Preliminary observations on resistance to rust diseases of Kentucky bluegrass ecotypes from Poland[J].Journal of Phytopathology,2001,49(2):83-89.
[20] Johnson D A.Stability of slow-rusting resistance toPucciniaasparagiand managing rust in Asparagus[J].Plant Disease,2012,96(7):997-1000.
[21] Knott D R.The Wheat Rusts-Breeding for Resistance[M].Berlin:Springer-Verlag,1989:144.
[22] Rosewarne G M,Singh R P,Huerta-Espino J,etal.Analysis of leaf and stripe rust severities reveals pathotype changes and multiple minor QTLs associated with resistance in an Avocet×Pastor wheat population[J].Theoretical and Applied Genetics,2012,124(7):1283-1294.
[23] Welty R E,Barker R E.Latent-period responses of stem rust in tall fescue incubated at four temperatures[J].Crop Science,1992,32:589-592.

