冻干保护剂和预冻结速率对猪关节软骨压缩杨氏模量的影响
孙慧君 胥 义 吕 娅
(上海理工大学生物系统热科学研究所,上海 200093)
引言
关节软骨能为关节活动提供低摩擦、低磨损和吸收力学冲击等重要功能。由于关节软骨没有血管、淋巴管提供营养,其自身修复能力很差,所以一旦损伤后,常常引发各种关节疾病,严重影响着人们的生活质量[1]。软骨移植是修复关节软骨损伤的一种非常可靠的治疗手段,而有限的关节软骨供体来源及其保存问题,一直是制约关节软骨移植手术得以推广的主要原因。近年来,国内外许多学者都在探索关节软骨的低温保存技术[2-7],期望能成功建立关节软骨低温保存组织库,为临床应用提供丰富的材料来源,同时也便于医生有足够的时间进行术前更准确的尺寸和形状匹配,以及充分的病毒学和细菌学检测等工作[8]。但有研究发现,低温冷冻软骨移植后出现了软骨组织纤维化、软骨基质断裂以及机械力学性能显著降低等问题,这很可能是冷冻关节软骨解冻过程中造成的结果[9-11]。与此同时,采用低温保存的方法需要用到液氮,其相应的设备和运行成本较高。而冷冻干燥技术用于生物组织的保存具有如下优越性[12]:一是制品在真空的环境下升华干燥后体积、形状基本不变,呈海绵状,无干缩,复水时能够迅速还原成原来的性状;二是能够除去物料中90%以上的水分,能在常温长期保存,不需要昂贵的低温储存设备及复杂的保存条件;三是冻干后质量很轻,方便长途运输。
鉴于此,本研究采用冷冻干燥法来保存关节软骨,探索冻干保护剂的种类、浓度以及预冻结速率等对冷冻干燥关节软骨杨氏模量的影响,有助于深入认识关节软骨冷冻干燥保存过程中的生物力学性能保护情况。
1 实验设备和方法
1.1 实验设备
1.1.1 动态机械热分析仪(DMA)实验采用的动态机械热分析仪为DMA-Q800(TA,美国)。根据试验需要,采用静态压缩模式,预载荷为0.01 N,在37℃恒温的环境下,将经过预处理后的关节软骨样品以2 N/min 的速率加载至17 N 即停止测试。在得出应力应变曲线后,由DMA 自动处理数据得到杨氏模量。
1.1.2 程序降温装置
实验采用的程序降温装置为升降式程序降温仪[13],其工作原理是利用液氮容器中液氮蒸汽的纵向温度梯度,用微机控制微电机的转向和转速,再通过牵引绳来调节样品在液氮蒸汽中的位置,使样品处于程序所设置的温度(– 60℃)。本研究以1、10、20℃/min 等 3 种 预 冻 结 速 率 从 室 温 降至-60℃。
1.1.3 Virtis 冻干机
实验采用的冻干机为Advantage 2.0(Virtis,USA)。根据试验要求,将预冻温度设置在-60℃,恒温1 h 后开始升华干燥。将冻干机的搁板温度设置在-50℃,真空度10 ~13 Pa,恒温16 h 后开始解析干燥。将冻干机的搁板温度设置在-20℃,真空度10 ~13 Pa,恒温4 h。再将冻干机的搁板温度设置在0℃,真空度10 ~13 Pa,恒温4 h。最后,将冻干机的搁板温度设置在20℃,真空度10 ~13 Pa,恒温2 h。
1.2 实验方法
选取上海本地成年猪,取整根有两瓣半月板覆盖的白色软骨的猪大骨。用手术剪将半月板剪去,并用专用工具(冲头)制备直径为5 mm 的软骨测试样品。用格林氏液将样品表面的滑液冲洗掉,先取出6 个样品均分放置在两个装有PBS 溶液(pH =7.4)的容器中,再将其余取出的样品分别置于体积浓度为10 %、20%、30%、40%、50%、60%、80%(V/V)的二甲基亚砜(DMSO)(分析纯,上海国药集团化学试剂有限公司),甘油(分析纯,上海国药集团化学试剂有限公司)以及1,2-丙二醇(分析纯,上海国药集团化学试剂有限公司,以下简称“丙二醇”)中进行2.5 h 的充分渗透,使冻干保护剂和软骨内的水分充分置换。每个PBS 溶液中的样品在进行2.5 h 的充分渗透后(作为空白对照组),可直接用于DMA 仪器测量。经冻干保护剂充分渗透后,将样品用程序降温仪以1、10、20℃/min 等3 种不同的预冻结速率降温至-60℃,再将样品与放置在另外一个PBS 溶液中的样本快速转移到冻干机内进行冷冻干燥。将冷冻干燥好的样品浸泡在PBS(pH =7.4)中1.5 h,复水后再用于DMA仪器测量。在预冻结速率相同的条件下,分析冻干保护剂的种类和浓度对冻干关节软骨杨氏模量的影响。为了确保实验数据的有效性,每一实验条件做3 个平行样。文中的数据是以“平均值+标准差”的形式给出的。
2 实验结果与分析
2.1 扫描电镜观察
将对照组和以1、20℃/min 预冻结速率冷冻到-60℃的样品进行扫描电镜观察(放大倍数为500 000倍),可以观察到在图1 对照组样品的胶原纤维主要有粗细两类,粗纤维由若干条细纤维聚集而成,多呈束带状或条索状;粗细纤维相互编织,形成层次分明、立体的胶原网络。图2 是预冻结速率为1℃/min 冻干样品的胶原纤维部分的断裂现象,图3 是预冻结速率为20℃/min 冻干样品的胶原纤维的断裂现象加剧。但是这些断裂现象只是在冷冻过程中生成的冰晶刺破胶原纤维而造成的,对于生物力学研究的影响不大,即研究其杨氏模量在某种程度上来说是有意义的。图4 ~图5 均为DMSO 40%处理过的样品的扫描电镜图,可以看出在冻干保护剂的处理下,胶原纤维的破坏程度均有所降低,说明对胶原纤维的结构起到了一定程度的保护作用。

图1 对照组样品的扫描电镜图Fig.1 Control sample(SEM)

图2 预冻结速率为1℃/min 样品的扫描电镜图Fig.2 Sample treated with 1℃/min cooling rate(SEM)

图3 预冻结速率为20℃/min 样品的扫描电镜图Fig. 3 Sample treated with 20℃/min cooling rate (SEM)

图4 预冻结速率为1℃/min DMSO40%处理样品的扫描电镜图Fig. 4 Sample treated with DMSO40% (1℃/min)(SEM)
2.1 冻干保护剂的浓度对杨氏模量的影响
如图6 所示,在预冻结速率为1、10 以及20℃/min 下,经不同浓度DMSO 处理的冻干样品的杨氏模量随着浓度变化而变化。可以看出:空白对照组的杨氏模量最大,添加冻干保护剂冻干样品的杨氏模量次之,新鲜未加保护剂的冻干样品的杨氏模量最小;当DMSO 的浓度在小于40% (V/V)范围内,杨氏模量随着浓度的增大而增大。例如,在预冻结速率均为1℃/min 时,添加10%(V/V)DMSO 冻干样品的杨氏模量为1.423 MPa,40% (V/V)DMSO冻干样品的杨氏模量为2.356 MPa,在大于40%(V/V)范围内杨氏模量随着浓度的增大而减小。例如,预冻结速率为1℃/min 时,添加50% (V/V)DMSO 冻干样品的杨氏模量为2.143 MPa,80%(V/V)DMSO 的冻干样品的杨氏模量为1.93 1 MPa。

图5 预冻结速率为20℃/min DMSO40%处理样品的扫描电镜图Fig. 5 Sample treated DMSO40% (20℃/min)(SEM)
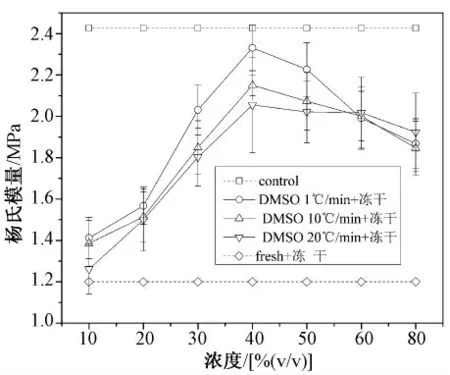
图6 冻干保护剂浓度对杨氏模量的影响(DMSO)Fig.6 Effects of concentrations of DMSO on Young’s modulus
在预冻结速率为1℃/min 的情况下,经不同浓度DMSO 处理的冻干样品的杨氏模量影响的方差分析结果见表1。根据表1 的方差分析结果,F >F0.05,即P≤0.01。由该表中的显著性水平可见,浓度对冻干样品的杨氏模量的影响是极其显著的。

表1 冻干保护剂浓度对杨氏模量影响的方差分析(DMSO)(α=0.05)Tab.1 The analysis of variance of effects of concentrations of DMSO on Young’s modulus(α=0.05)
2.2 预冻结速率对杨氏模量的影响
如图7 所示,经10、40、80%(V/V)DMSO 处理后,预冻结速率为1、10 和20℃/min 时的冻干样品的杨氏模量。可以看出:经中低浓度DMSO 处理过的样品随着预冻结速率的增大杨氏模量减小。
DMSO 的浓度为40%(V/V),经不同预冻结速率处理的冻干样品的杨氏模量影响的方差分析结果见表2。根据表2 方差分析结果,F >F0.05,即P≤0.01。由该表中的显著性水平可见,预冻结速率对冻干样品的杨氏模量的影响是极其显著的。
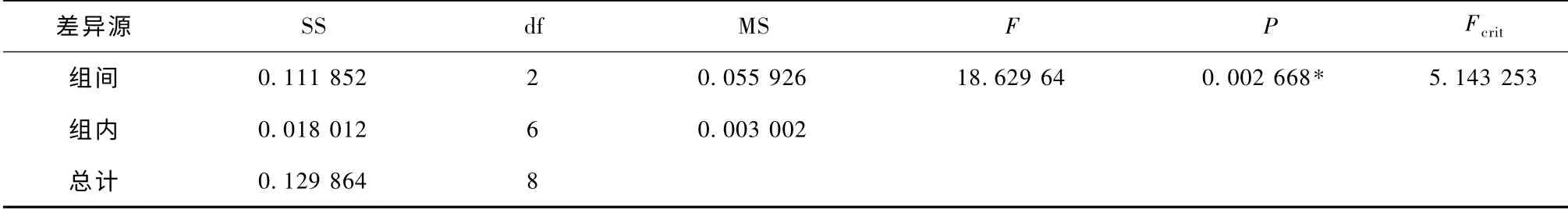
表2 预冻结速率对杨氏模量影响的方差分析(DMSO)(α=0.05)Tab.1 The analysis of variance of effects of cooling rates on Young’s modulus (with DMSO)(α=0.05)
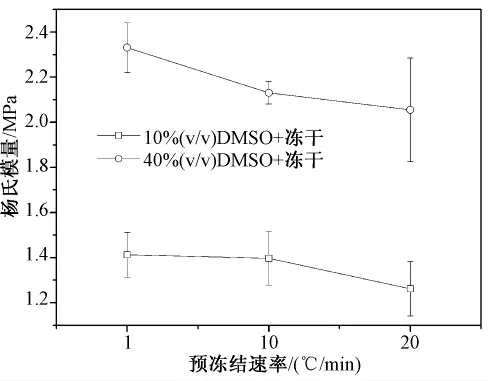
图7 预冻结速率对杨氏模量的影响(DMSO)Fig.7 Effects of cooling rates on Young’s modulus(with DMSO)
2.3 冻干保护剂种类对杨氏模量的影响
分别经浓度为 10%、40%、80% (V/V)的DMSO、丙二醇、甘油处理,并经过1、10、20℃/min 预冻结速率的处理冻干关节软骨样品的杨氏模量如图8 所示。可以看出:在中低浓度范围内,经一定浓度的甘油、丙二醇处理,在相同的预冻结速率下,冻干样品的杨氏模量随着甘油、丙二醇浓度的增大而增大;在高浓度范围内,其杨氏模量随着甘油、丙二醇浓度的增大而减小。可见,这点和DMSO 在不同浓度下对冻干样品的保护效果是一样的。
在中低浓度范围内,在不同预冻结速率下,经一定浓度的甘油、丙二醇处理,冻干样品的杨氏模量随着预冻结速率的增大而减小;在高浓度范围内,其杨氏模量随着预冻结速率的增大而增大。可见,这点和DMSO 在不同预冻结速率下对冻干样品的保护效果是一样的。
在中间浓度范围内,当保护剂的浓度相同时,经DMSO 处理的冻干样品的杨氏模量最大,甘油的杨氏模量次之,丙二醇的杨氏模量最小;而在高浓度下,3 种保护剂的保护效果差不多。究其原因,主要是由3 种保护剂的官能团决定的[22-23]。
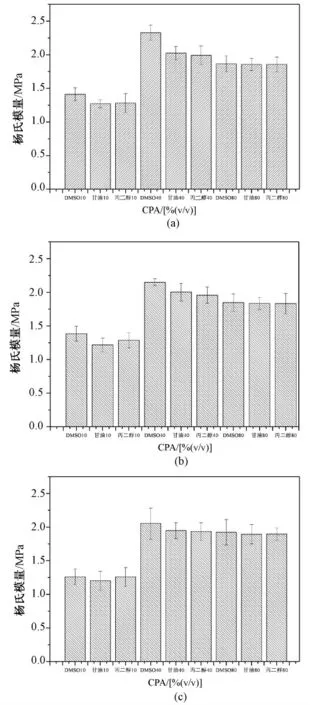
图8 不同温度下不同冻干保护剂对杨氏模量的影响。(a)1℃/min (b)10℃/min (c)20℃/minFig.8 Effects of CPAs on Young’s modulus.(a)1℃/min(b)10℃/min(c)20℃/min
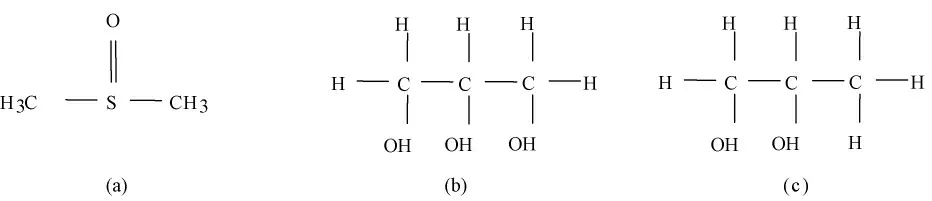
图9 3 种冻干保护剂的分子式。(a)DMSO;(b)甘油;(c)1 -2 丙二醇Fig.9 Formula of the three CPA.(a)DMSO;(b)Glycerin;(c)Propylene glycol 1 -2
3 讨论
从图6 中可以看出,空白对照组的杨氏模量最大,添加冻干保护剂冻干样品的杨氏模量次之,新鲜的未加保护剂冻干样品的杨氏模量最小。当DMSO 的浓度在小于40%(V/V)范围内,杨氏模量随着浓度的增大而增大;在大于40% (V/V)范围内,杨氏模量随着浓度的增大而减小。DMSO 作为冻干保护剂,属于低分子中性物质,在溶液中易结合水分子发生水合作用,使溶液的黏性增加,从而弱化了水的结晶过程,达到了保护的目的。一般认为,这些化合物中的官能团(羟基)与水之间以氢键的形式键合,使得溶液变得黏稠,从而使水溶液中受扩散制约的冰晶生长变得缓慢,玻璃化形成趋势增强,从而对胶原纤维的合理排列分布的破坏减少[14]。所以,添加冻干保护剂的样品的杨氏模量大于新鲜的未加入保护剂冻干样品的杨氏模量。但是,由于在冷冻干燥过程中会产生热应力[15],导致胶原纤维和蛋白多糖的结构破坏,导致冻干样品的杨氏模量小于空白对照组的杨氏模量。课题组以前的研究发现,当DMSO 渗透到组织细胞内部时,高浓度的低温保护剂可以将基质内部大量的分子替换成结合水,而低浓度的低温保护剂只能将小部分水分子转换成结合水,还有大部分水分子是自由水[16-17]。随着DMSO 浓度的增加,溶液中的甲基和羟基的个数也会增加,结合水也越多,冻干保护剂在渗透过程中也置换了一部分在冻结时会产生相变的水的份额。所以在低浓度范围内随着冻干保护剂浓度的增加,杨氏模量是逐渐增大的;在高浓度范围内,杨氏模量却是减小的。可能的原因是:在高浓度范围内,软骨样品在本研究的预冻结温度环境(-60℃)下并没有处于冻结状态。这个原因可以从文献[13]等的研究中得到解释:在溶质浓度很低时,溶质-溶剂之间的相互作用对整个溶液的影响很弱,溶液较多地表现出纯水的性质;随着浓度的升高,溶质-溶剂的相互作用开始加强,并开始对过冷度产生明显的影响。在高浓度区间,过冷度随着浓度的增加而单调增加。Rios 等的研究发现,当保护剂的浓度为60% (V/V)时所有的保护剂基本上不会形成冰晶[18]。由此看来,此时进行冷冻干燥,既没有冰晶生成,也没有出现玻璃化冻结,就相当于在本研究的干燥过程中的风干,这对冻干软骨的生物力学性能可能破坏较大。
从图7 可以看出,经中低浓度DMSO 处理过的样品,随着预冻结速率的增大,杨氏模量减小。这可能的原因是在关节软骨冷冻干燥期间,细胞内外的水分冻结成冰,冰晶生长产生了机械力量,会引起细胞损伤,这种损伤叫做“机械损伤”[19]。关节软骨是种特殊的组织,是由少量的软骨细胞和大量的细胞外基质组成。细胞的主要作用是合成和分泌基质蛋白,维持软骨基质的新陈代谢,而细胞外基质是软骨的主要力学承载者。降温速率越大,成核率也越大,形成数量很多的小冰晶。但是,冰晶生长率相对较低,而降温速率越小则相反,首先中低浓度DMSO,结合水太少。在快速预冻结过程中,软骨细胞内外冰晶体形成速度较快,细胞内的水分尚未转移到细胞外,细胞内外同时结晶[20-21]。细胞内冰晶对细胞的损伤体现在细胞质和细胞核,影响的是软骨细胞的分裂能力;而细胞外降温时的成核率较低,冰晶生长速度较快,形成的大量冰晶迅速引起宏观体积的膨胀,破坏了胶原纤维的合理排列分布,使软骨的支架结构受到破坏,大大降低了软骨的力学承载能力。从图4 ~图5 的扫描电镜观察结果可以看出,在快速预冻结的影响下,原本合理排布的胶原纤维聚集在一起,出现了明显的纤维断裂现象,而慢速预冻胶原出现断裂现象较为轻微。所以,在中低浓度范围内,预冻结速率越快,杨氏模量越小。
从图8 可以看出,在中间浓度范围内,当保护剂的浓度相同时,经DMSO 处理的冻干样品的杨氏模量最大,甘油的杨氏模量次之,丙二醇的杨氏模量最小。而在高浓度下3 种保护剂的保护效果差不多,这主要是由不同保护剂的官能团决定的[22-23]。如图9 所示,DMSO 的分子式中有2 个甲基,甘油有3 个羟基,丙二醇有2 个羟基和1 个甲基。从实验结果可以看出,在相同浓度下,DMSO 的杨氏模量大于甘油的杨氏模量,大于丙二醇的杨氏模量。这种现象的原因:一方面,是因为DMSO 结合水的能力最强,甘油结合水的能力次之,丙二醇结合水的能力最差;另一方面,也是因为DMSO 渗入细胞的速率比甘油和丙二醇快,这无疑会使细胞受到更好的保护。Hey 等用DMSO 和丙三醇进行了多组对照实验[24],发现45% (V/V)DMSO 和50% (V/V)甘油在玻璃化转变和反玻璃化趋势方面有很多共性,这说明在相同的浓度下,DMSO 的结合水能力可能比甘油的结合水能力要强。在给定的冻干保护剂中,除了含羟基化合物,还有含甲基化合物和既含羟基又含甲基的化合物。文献[22 -23]的研究认为,低温保护效果甲基要好于羟基,因为甲基与甲基之间没有相互作用,只与水键合,而羟基除了与水键合外,自身也有键合,从而会弱化对冰晶的抑制效果。DMSO 的分子式中有2 个甲基,甘油的分子式中有3个羟基。虽然甘油中羟基的数目为3 个,但是羟基自身也有键合作用,所以与水的结合能力比DMSO要小,导致了杨氏模量不如DMSO 的大。但是,丙二醇有2 个羟基和1 个甲基,甘油只有3 个羟基。所以笼统的通过比较羟基和甲基的数目是不行的[25]。可能的原因是甘油代替自由水的份额比丙二醇要高,所以,在相同浓度下,含有甘油的基质内的自由水比含有丙二醇的基质内的自由水少,导致甘油的杨氏模量大于丙二醇的杨氏模量。但是在低浓度和高浓度范围内杨氏模量的大小和冻干保护剂的种类之间没有表现出这样一一对应的关系。产生这种情况的原因可能是:在浓度范围内冻干保护剂的作用效果不明显,主要受预冻结速率的影响。在高浓度范围内,冻干保护剂水溶液的冻结温度低于-60℃,加入冻干保护剂的样品并没有实现完全冻结,导致冷冻干燥失败,没有实现真正意义上的冻干,估计对关节软骨的胶原纤维的合理排列分布造成大的破坏,大大降低了软骨的力学承载能力。
4 结论
本实验研究了3 种冻干保护剂、7 种冻干保护剂浓度以及3 种预冻结速率对关节软骨杨氏模量的影响,结果表明:
1)空白对照组的杨氏模量最大,添加冻干保护剂冻干样本的杨氏模量次之,新鲜的未加保护剂冻干样品的杨氏模量最小。
2)冻干保护剂在中低浓度范围内,杨氏模量随着浓度的增大而增大;而在高浓度范围内,杨氏模量随着浓度的增大而减小。
3)对于在中低浓度区间同一浓度的同一冻干保护剂,慢速预冻结更有利于保护其力学性能。
4)当保护剂的浓度在中浓度区间时,相同浓度下DMSO 的杨氏模量最大,甘油的杨氏模量次之,丙二醇的杨氏模量最小。
[1] 卫小春. 关节软骨[M]. 北京:科学出版社,2007:120 -154.
[2] Seddighi MR,Griffon DJ,Schaeffer DJ,et al. The effect of chondrocyte cryopreservation on cartilage engineering [J]. The Veterinary Journal,2008,178(2):244 -250.
[3] Pegg DE, Wusteman MC, Wang LH. Cryopreservation of articular cartilage. Part 1:Conventional cryopreservation methods[J]. Cryobiology,2006,52(3):335 -346.
[4] Song YC,An YH,Kang QK,et al. Vitreous preservation of articular cartilage grafts[J]. J Invest Surg,2004,17(2):65 -70.
[5] Leila L,Ken F,McGann LE,et al. Cryopreservation of porcine articular cartilage :MRI and biochemical results after different freezing protocols[J]. Cryobiology,2007,54(1):36 -43.
[6] 陈百成,陈竞清,高石军,等. 低温保护冻存的异体骨软骨移植修复关节软骨缺损的研究[J]. 中国骨肿瘤骨病,2003,2(6):336 -339.
[7] 李军政,成诗银,崔鹏程,等. 深低温冻存软骨细胞构建组织工程化软骨[J]. 中国误诊学杂志,2004,4(10):1587 -1589.
[8] 曹谊林. 组织工程学[M]. 北京:科学出版社,2008.
[9] Muldrew K,Novak K,Studholme C,et al. Transplantation of articular cartilage following a step-cooling cryopreservation protocol[J]. Cryobiology,2001,43(3):260 -267.
[10] Fishbein KW,Canuto HC,Bajaj P,et al. Optimal methods for the preservation of cartilage samples in MRI and correlative biochemical studies[J]. Magn Reson Med,2007,57,866 -873.
[11] Zheng SK,Xia Y,Bidthanapally A,et al. Damages to the extracellular matrix in articular cartilage due to cryopreservation by microscopic magnetic resonance imaging and biochemistry[J]. Magnetic Resonance Imaging,2009,27,648 -655.
[12] 华泽钊.冷冻干燥新技术[M]. 北京:科学出版社,2006.
[13] 陈儿同,赵林,等. 低温生物降温控制装置[P]。中国专利:91215370.9,1992 -01 -01.
[14] 高才,周国燕,胥义,等. 乙二醇和丙三醇水溶液冻结特性的研究[J].物理化学学报,2004,20(2):123 -128.
[15] Bhowmick S,Zhu L,McGinnk L. et al Desiccation tolerance of spermatozoa dried at ambient temperature:Production of fetal mice[J].Biology of Reproduction 2003;68(5):1779 -1786.
[16] 胥义,周国燕,高才,等. 兔胸主动脉冻结相变膨胀过程的TMA 实验研究[J]. 中国生物医学工程学报,2005,26(6):1013 -1015.
[17] 胥义,华泽钊,周国燕.兔主动脉冻结过程中未冻水份额的研究[J].工程热物理学报,2006,27(3):478 -480.
[18] Rios JL,Rabia Y. Thermal expansion of blood vessels in low cryogenic temperatures,Part II:Vitrification with VS55,DP6,and 7.05 M DMSO[J]. Cryobiology,2006,52(2006):284 -294.
[19] 朱琳,刘宁,张英华,等. 乳酸菌细胞膜的冻干损伤[J]. 食品科学,2006,27(2):266 -269.
[20] 胥义,周国燕,高才。兔主动脉冻结膨胀行为及其影响因素的研究[J]。工程热物理学报,2005,26(6):1013 -1015。
[21] Xu Yi,Hua Zechao,Sun Dawen,et al. Effects of freezing rates and dimethyl sulfoxide concentrations on thermal expansion of rabbit aorta during freezing phase change as measured by thermomechanical analysis[J].Journal of Biomechanics,2007,40(14):3201 -3206.
[22] 徐海峰,高志新,刘宝林,等. 纳米微粒对低温保护剂溶液结晶性质的影响[J].低温与超导2010,38(11):53 -57.
[23] 何培青,李江,王昉,等. 南极细菌胞外多糖溶液冻结特性的差示扫描量热研究[J].生态学报2009,29(11):5766 -5772.
[24] Hey MJ,Macfarlane DR. Crystallization of ice in aqueous solutions of glycerol and dimethyl sulfoxide[J]. Cryobiology,1996,33(2):205 -216.
[25] Macfarlane DR,Forsyth Maria,et al. Recent insights on the role of cryoprotective agents in vitrification[J]. Cryobiology,1990,27(4):345 -358.

