厌氧序批反应器加载活性炭对厌氧产氢的影响
谢 丽,王 磊,罗 刚,周 琪
(1.同济大学 污染控制与资源化研究国家重点实验室,上海200092;2.丹麦技术大学 环境系,丹麦 灵比2800)
随着经济的发展,能源问题引起了人们越来越多的关注和重视.氢气作为一种无污染、可再生的理想燃料,被认为是最具吸引力的石油替代能源.与光合生物制氢相比,厌氧生物制氢不需要光能源,反应装置的设计运行简单,可利用有机废水或废弃物(如淀粉废水、畜牧废水、酒精废水、餐厨垃圾等),达到除废和产能的双重目的[1].
完全混合釜式反应器(completely stirred tank reactor,CSTR)是目前应用最广泛的生物厌氧发酵产氢反应器,产氢微生物在机械搅拌作用下悬浮生长于混合液中,固液间传质阻力小,操作运行简单.然而,CSTR中微生物的量受水力停留时间(HRT)影响较大,在HRT较短时可能会发生产氢微生物被冲出现象,导致氢气产量的下降甚至产氢系统的崩溃.Show等[2]以葡萄糖配水为基质在CSTR中发酵产氢,发现当HRT由6h缩短至3h时反应器中微生物被冲出,污泥量剧减,产氢速率由0.32L·(L·h)-1急剧下降至0.13L·(L·h)-1.厌氧序批反应器(ASBR)可以通过每个周期中的沉降阶段保留反应器内的污泥,使反应器的HRT和污泥停留时间(SRT)分离,避免HRT较短时系统微生物流失,得到稳定的产氢效果.此外序批式运行可以减少反应器内溶解性代谢产物的积累,减轻反馈抑制作用[3].然而Shin等[4]发现 ASBR 出水中可沉淀污泥的产氢性能劣于不可沉淀污泥,大量的产氢微生物并不能通过沉淀阶段得到有效保留、富集,使得ASBR氢气产率偏低.
已有研究表明向CSTR中添加活性炭载体能使产氢菌在活性炭表面形成生物膜,改变产氢微生物的种群结构,提高反应器内产氢微生物量和产氢效果[5].但是目前关于ASBR中添加活性炭生物载体对高浓度有机废水厌氧产氢影响的报道尚不多见.通过向ASBR反应器中投加活性炭可以延长产氢微生物在反应器中停留时间,提高反应器对产氢菌富集效果.因此本文以葡萄糖为基质,考察不同HRT条件下活性炭生物载体对ASBR高温厌氧发酵产氢系统运行稳定性、产氢效率以及代谢产物分布的影响.
1 材料与方法
1.1 葡萄糖溶液和接种污泥
试验以葡萄糖配水为发酵底物,培养基由以下组分构成.
(1)营养液:CoCl2·6H2O为50mg·L-1;酵母提取物(yeast extract)为10 000mg·L-1;ZnSO4为10mg·L-1;MgSO4·7H2O为2 400mg·L-1;NiCl2为10mg·L-1;FeSO4·7H2O为500mg·L-1;H3BO3为10mg·L-1;MnSO4·H2O 为50 mg·L-1;Na2MoO4·2H2O为10mg·L-1;KI为50mg·L-1.
(2)碳氮磷母液:葡萄糖(含1个水)25g·L-1,蛋白胨2.5g·L-1,磷酸氢二钾0.25g·L-1.
(3)缓冲液:碳酸氢钠20g·L-1和碳酸钠10 g·L-1.
配置方法:5ml营养液、80ml碳氮磷母液和15 ml缓冲液相混合,混合液用氮气吹脱后放在4℃冰箱中备用.
接种污泥为江苏太仓新太木薯酒精厂上流式厌氧污泥床(UASB)的中温厌氧污泥.接种污泥中挥发性悬浮固体(VSS)质量浓度、总固体(TS)质量浓度、pH值分别为42g·L-1,70g·L-1和7.5.接种前将污泥于90℃水浴加热1h以抑制产甲烷菌的活性.
1.2 试验装置与步骤
反应在250ml的血清瓶中进行,其中2个血清瓶中分别添加10g粗颗粒活性炭(φ2mm×4mm)、细粉末活性炭(φ1mm~2mm)(国药试剂公司),第3个血清瓶中不添加活性炭.在3个血清瓶中分别加入30ml经过高温预处理的厌氧颗粒污泥和70ml葡萄糖配水,加入蒸馏水定容至200ml,再用2 mol·L-1的 HCl溶液或2mol·L-1的NaOH溶液调节pH值至6.0.用氮气驱除瓶中残余的氧气后,迅速用橡胶塞将瓶密封,置于水浴摇床中,在60℃下进行厌氧发酵,摇床的震荡速率设为150r·min-1.3个反应器均以序批模式在4个HRT(48,24,16,12 h)下运行,每个周期包括4个阶段:进水、反应、沉淀和出水,每个阶段运行时间参数如表1所示.

表1 ASBR反应器运行参数Tab.1 Operating parameters for ASBR
1.3 分析方法
液体样品分析前在11 000r·min-1下离心10 min,上清液用来测定溶解性碳水化合物质量浓度、挥发性脂肪酸(VFA)质量浓度、溶解性COD以及pH值.其中溶解性碳水化合物质量浓度采用苯酚—硫酸法测定,VFA质量浓度用气相色谱仪(Agilent 6890N)测定,色谱柱为J&W DB-WAXetr(30m×0.53mm×1μm);反应过程中产生的气体用集气袋收集,定期用注射器量取气体体积,气体组分用气相色谱仪(Agilent 6 890N)测定,色谱柱为:80/100 M Hayseq Q 0.5M×1/8in预柱(柱1),80/100M Hayseq Q 6ft×1/8in(柱2)和60/100MMolsieve 5A6ft×1/8in(柱3);pH 值用620型pH 值计(上海英格仪器有限公司)测定.
2 结果与讨论
2.1 ASBR中加载活性炭对氢气产量的影响
产氢反应器启动时分别向3个ASBR反应器中加入30ml接种污泥和120ml葡萄糖溶液,用蒸馏水稀释至200ml,间歇发酵3d.ASBR反应器在HRT为48h下半连续运行,15d后达到稳定状态(产气体积波动不超过10%),同一HRT下加载有活性炭的ASBR反应器氢气产量变化不大;无活性炭添加的ASBR每周期产氢体积变化较大,改变HRT时产氢体积波动尤为剧烈(如图1).此外,每天监测出水pH值发现加载活性炭的反应器出水pH值波动均比无活性炭加载的反应器小,改变HRT时前者出水pH值也能很快恢复稳定.这表明向ASBR中添加活性炭载体能使系统运行更加稳定.这可能是由于载体表面形成的生物膜对系统产酸环境的变化具有更好的抵抗能力[3].

图1 ASBR反应器每周期氢气产量Fig.1 Hydrogen production of ASBR per cycle
不同HRT下3个ASBR反应器所产生的气体主要由氢气和二氧化碳组成,其中氢气体积分数为42%~54%,高于文献[1]报道的35%~40%,这可能是由于本试验所用葡萄糖纯基质更易于被降解转化产生氢气.Hawkes等[6]报道 ASBR中较长的SRT在增加反应器内生物量的同时也有利于产甲烷菌等世代周期长的耗氢菌的生长,然而本试验所得的生物气体中没有检测到甲烷的存在,这表明热预处理接种污泥和酸性产氢环境可以有效抑制产甲烷菌的代谢.
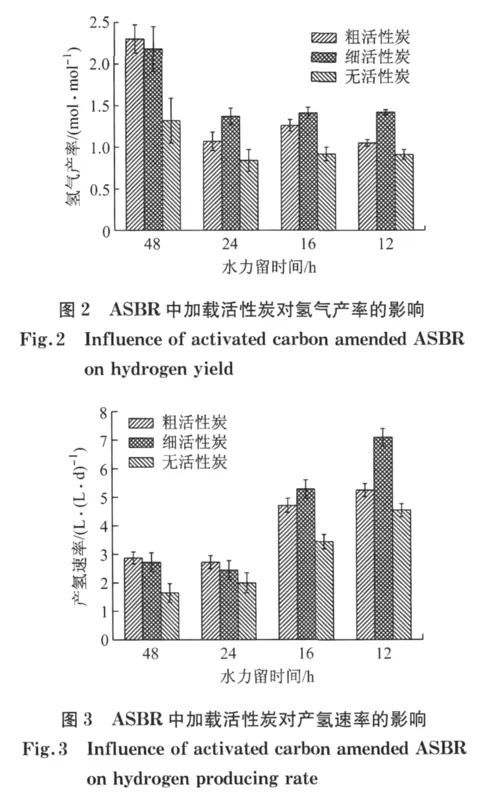
ASBR中活性炭载体的添加显著提高了氢气体积分数,氢气产率(图2)及产氢速率(图3).不同HRT(48,24,16和12h)时,加载细活性炭载体的ASBR反应器氢气产率分别达到(2.18±0.27)mol·mol-1,(1.37±0.10)mol·mol-1,(1.41±0.07)mol·mol-1,(1.42±0.03)mol·mol-1,与无活性炭的ASBR相比分别提高65%,63%,54%和56%,这可能是因为活性炭载体表面形成了生物膜,细菌的分布呈区位化,不同细菌以成簇的方式集中存在于一定的区域内,提高了ASBR系统中微生物的产氢性能.在较短HRT条件下添加细活性炭时ASBR产氢效果优于粗活性炭,这可能是由于细活性炭比表面积更大,富集的微生物相应较多.HRT为12h时添加细活性炭载体的ASBR反应器产氢速率达到最大(7.09±0.31)L·(L·d)-1,与不添加活性炭的 ASBR产氢速率((4.54±0.23)L·(L·d)-1)相比提高了56%.
2.2 ASBR中加载活性炭对溶解性代谢产物分布的影响
产氢菌在利用葡萄糖厌氧发酵产氢的同时伴随产生了VFA、乙醇等溶解性代谢产物(soluble metabolic products,SMP),溶解性代谢产物的产生量与反应器有机负荷、有机物在反应器内反应时间、微生物量以及微生物产氢性能等因素有关.不同HRT下3个ASBR反应器出水中溶解性代谢产物均主要以乙醇、乙酸、丙酸和正丁酸为主,乙酸和正丁酸之和占出水中总溶解性代谢产物的质量分数高达90%以上,其中正丁酸所占质量分数约为46%~66%,是典型的丁酸型发酵.
HRT为24h时加载有粗、细活性炭的2个ASBR反应器出水中溶解性代谢产物的质量浓度分别达到(6 171±218)mg·L-1,(7 588±205)mg·L-1,与不添加活性炭载体的ASBR反应器(出水SMP为(4 490±307)mg·L-1)相比分别提高了37%和69%,其中乙酸和正丁酸质量浓度也相应提高(图4).Babu等[7]在28℃,HRT为24h时利用蔗糖发酵产氢对比生物膜和悬浮生长系统产氢效果,也发现生物膜系统产氢性能优于悬浮生长系统,前者产生的VFA量也更多.这可能是因为活性炭载体表面形成的生物膜增加了反应器内微生物量,更多的底物被转化成了溶解性代谢产物.ASBR中加载细活性炭时出水中SMP质量浓度高于加载粗活性炭的反应器中的,相应氢气产率和产氢速率也较优,这可能是由于细活性炭比表面积更大,表面生物膜中微生物量更多的缘故.

图4 水力停留时间为24h时ASBR中加载活性炭对出水溶解性代谢产物质量浓度的影响Fig.4 Influence of activated carbon amended ASBR on SMP concentration in effluent for HRT 24h
厌氧发酵产氢过程中产氢微生物把1mol葡萄糖降解转化为乙酸和正丁酸分别可以得到4mol和2mol氢气(式(1)、式(2)),代谢产物为乙酸时理论上可以产生更多的氢气.然而有研究[8]表明在接种混合菌种的反应器中氢气产生量与乙酸的产生量呈负相关而与正丁酸的产生量呈正相关.这可能是由于产氢反应器中部分乙酸通过同型产乙酸作用生成,其过程中伴随着氢气的消耗(式3).

式中:nH2为厌氧发酵产生的氢气的物质的量;nHAca为通过式(1)途径产生的乙酸的物质的量;nHAcb为通过式(3)途径产生的乙酸的物质的量;nHPr和nHBu分别为产生的丙酸和丁酸的物质的量.
由式(5)可以计算得 HRT为24h时3个ASBR反应器出水乙酸中同型产乙酸所占总乙酸的质量分数(表2).Shin等[9]研究在35℃条件下利用ASBR反应器发酵淀粉产氢,发现HRT为4~18h时出水中同型产乙酸占总乙酸质量分数为63.4%~51.0%,与本试验相近.添加粗、细活性炭的2个ASBR反应器中同型产乙酸占总乙酸的质量分数分别为46.98%和46.45%,均高于无活性炭添加时的质量分数41.21%,表明活性炭在增加反应器污泥龄的同时也可能有利于世代周期较长的同型产乙酸菌的生长.然而添加活性炭的ASBR反应器中总溶解性代谢产物质量浓度分别为(6 171±218)mg·L-1,(7 588±205)mg·L-1,远高于不添加活性炭时的(4 490±307)mg·L-1;此外加载活性炭时出水中正丁酸占总溶解性代谢产物的质量分数则分别达到62.55%±0.02%,63.53%±0.03%,均高于不加活性炭时正丁酸的质量分数58.80%±0.07%.因此,虽然加载活性炭时ASBR中同型产乙酸较多,但反应器氢气产率仍然高于不加载活性炭的反应器中的.

表2 水力停留时间为24h时ASBR出水乙酸情况Tab.2 Portion of acetate produced by homoacetogens and butyrate to acetate ratio in ASBR effluent for HRT 24h
由于产氢反应器中部分乙酸的生成伴随着氢气的消耗,丁酸与乙酸物质的量比(B/A)常被用来表征底物代谢途径和系统产氢性能的优劣,其比值越大氢气产率越高[10].HRT为24h时加载粗、细活性炭的2个ASBR反应器中B/A(表2)分别为1.39±0.13,1.41±0.07,均高于不加载活性炭时的B/A(1.06±0.10),进一步表明添加活性炭生物载体在一定程度上提高了ASBR系统产氢性能.
不同HRT下添加活性炭的2个反应器中均有丙酸生成,且添加细活性炭时丙酸质量浓度比添加粗活性炭时高,这表明活性炭载体在富集产氢菌的同时也有利于以丙酸为代谢产物的微生物的生长.Chang等[11]在35℃以蔗糖为基质厌氧产氢,也发现填充有活性炭载体的固定床出水中丙酸质量浓度高于悬浮生长系统.氢气可以被直接用来形成丙酸(式(4)),因此通常认为丙酸的产生会降低氢气产率[5],然而本试验中出水代谢产物以正丁酸和乙酸为主,丙酸只占很小比例,并没有导致氢气产率明显下降.
相同HRT下加载活性炭的ASBR反应器产气组分、氢气产率、出水pH值波动,代谢产物分布以及同型产乙酸占总乙酸质量分数均与不添加活性炭的反应器不同,表明添加活性炭载体可能还改变了反应器内微生物的种群结构和产氢性能.Wu等[12]以20g·L-1葡萄糖溶液为基质分别利用CSTR反应器和添加有粉末活性炭载体的AGSB(agitated granular sludge bed)反应器中温(40℃)厌氧产氢,发现活性炭在诱导产生颗粒污泥提高反应器内微生物量的同时还改变了产氢微生物的种群,CSTR反应器中优势产氢菌为C.rumosum和C.indolis,而AGSB反应器中微生物种群结构变得更加复杂,其中C.pasteurianum,K.oxytoca和Streptococcussp占主导.
2.3 HRT对葡萄糖厌氧发酵产氢的影响
HRT由48h缩短至24h时加载细活性炭的ASBR反应器氢气产率由(2.18±0.27)mol·mol-1急剧降低至(1.37±0.10)mol·mol-1(图3),这可能是因为缩短HRT导致反应器内污泥量剧减,悬浮生长的产氢微生物相应减少,致使系统产氢能力下降;此外,较高的有机负荷超出了产氢微生物的转化利用能力,进水中葡萄糖利用不彻底[13].HRT由48 h缩短至24h,出水中溶解性碳水化合物质量浓度从1.16g·L-1升高至3.32g·L-1,继续缩短 HRT至16h和12h,出水中溶解性碳水化合物质量浓度变化不大,分别为2.99,2.98g·L-1,氢气产率也仅在(1.41±0.07)mol·mol-1至(1.42±0.03)mol·mol-1范围内微小波动.这是由于随着运行时间的增长反应器内不易沉降的污泥逐渐随出水冲出,污泥沉降性能趋于稳定,HRT由24h缩短至12h过程中反应器内污泥量随着HRT变化较小.
由于进水中葡萄糖质量浓度(20g·L-1)一定,缩短HRT意味着反应器有机负荷逐渐升高.然而HRT由48h缩短至24h时,ASBR反应器由于底物转化利用不彻底导致氢气产率低,产氢速率变化并不大.继续缩短 HRT至12h时,产氢速率由(2.44±0.33)L·(L·d)-1逐 步 提 高 至 (7.09±0.31)L·(L·d)-1.这可能是因为随着 HRT 的缩短,反应器有机负荷逐步提高,且代谢产物在反应器内滞留时间缩短,产氢反应动力学上更加有利[5].HRT较长时,酸性液相末端发酵产物在系统内的滞留时间长,当进水有机物质量浓度较高时,就会造成酸性物质的大量积累,使得反应系统pH值较低,从而抑制微生物的生物活性.HRT由48h逐步缩短到12h,3个ASBR反应器出水pH值由4.8逐步升高到5.5左右(这一范围被认为较适宜厌氧产氢[14]),这也在一定程度上促进了产氢速率的提高.整体而言,随着有机负荷提高,产氢速率提高而氢气产率下降,文献[15]在35℃条件下以蔗糖为基质发酵产氢,文献[16]在30℃以葡萄糖为基质发酵产氢也得到了类似的试验结果(表3).文献[17]利用自主研发的连续搅拌厌氧反应器(CSABR)在40℃发酵蔗糖产氢,OLR由40g·(L·d)-1提高至120 g·(L·d)-1(HRT由6h逐步缩短至2h),氢气产率变化不大(0.92mol·mol-1至1.05mol·mol-1),而产氢速率由5.04L·(L·d)-1提高至14.55L·(L·d)-1.继续提高 OLR至240g·(L·d)-1(缩短HRT至1h),反应器内生物量(以VSS计)由4.5g·L-1急剧降低至3.2g·L-1,氢气产率和产氢速率也分别降低至0.43mol·mol-1和11.52 L·(L·d)-1.
HRT由48h缩短至24h,加载细活性炭ASBR出水中总SMP质量浓度降低(图5),这可能是因为随着HRT缩短,系统中微生物量随着污泥流失而减少,且HRT降低反应时间相应缩短,底物转化利用不充分;与此相对应,系统氢气产率急剧降低.HRT由24h缩短至16h出水SMP质量浓度分别由7 588mg·L-1略微提高至8 314mg·L-1,继续缩短HRT至12h,出水SMP质量浓度降低至6 310 mg·L-1.然而HRT由24h缩短至12h过程中,加载细活性炭ASBR反应器氢气产率变化并不大,这可能是由于不同HRT下同型产乙酸菌代谢程度不同.HRT为24h和16h时,加载细活性炭ASBR反应器同型产乙酸质量浓度分别为1 083和1 277 mg·L-1,缩短HRT至12h这一质量浓度急剧降低至708mg·L-1,由于出水中一部分乙酸的生成伴随着氢气的消耗,虽然HRT为16h时出水SMP质量浓度较高,但氢气产率相比HRT为24h和12 h相差不大.HRT由24h缩短至12h,同型产乙酸占总乙酸质量分数由46.44%缩短至38.59%,表明较短的HRT会对同型产乙酸菌的代谢产生抑制.HRT为48h时ASBR出水中未检测到乙醇的存在;缩短HRT,反应器中有乙醇产生,这表明较短的HRT条件有利于乙醇的生成.
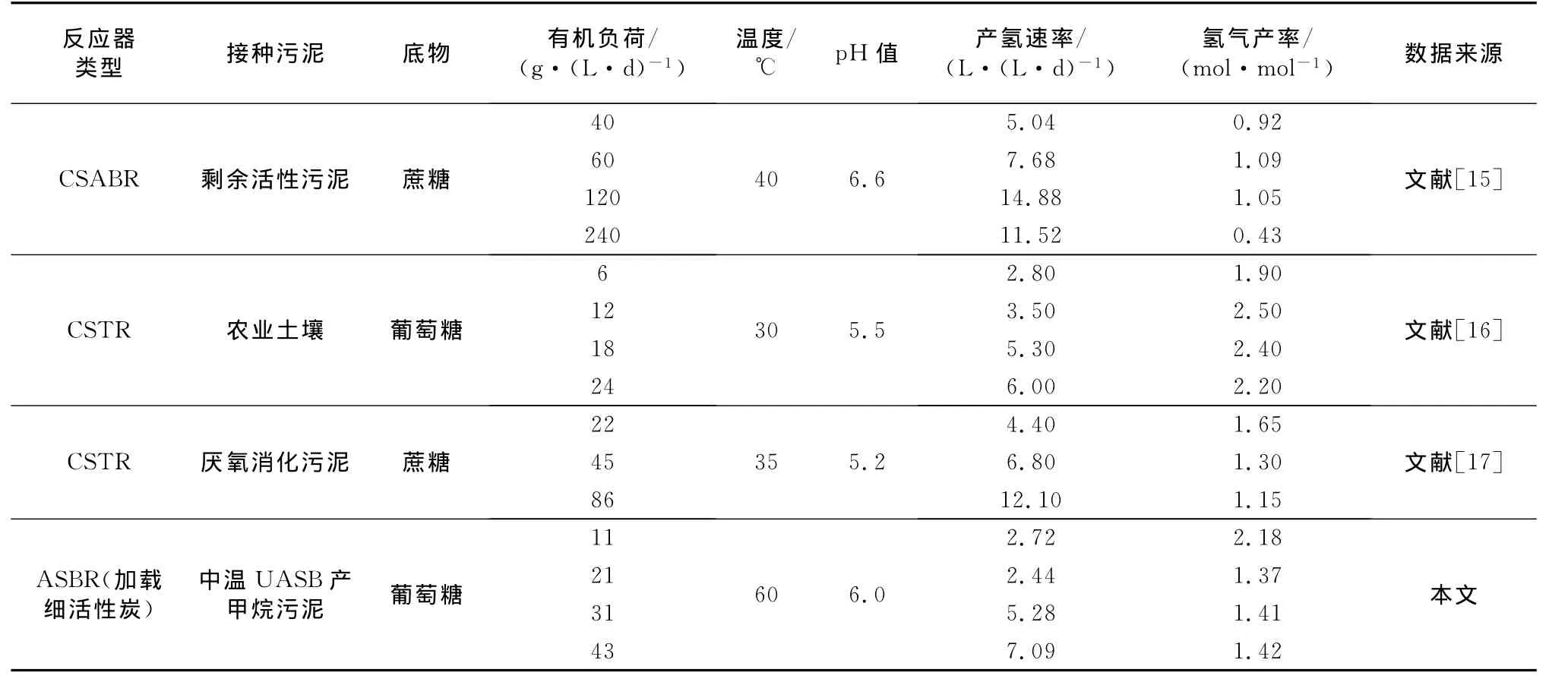
表3 不同条件下发酵纯基质产氢效果对比Tab.3 Fermentative hydrogen production from pure substrates for different HRTs

图5 水力停留时间对加载细活性炭ASBR出水溶解性代谢产物质量浓度的影响Fig.5 Influence of HRT on SMP concentration in smaller size activated carbon amended ASBR
3 结 论
(1)向ASBR中添加活性炭载体能使系统运行更加稳定,出水pH值和每周期产氢体积波动较小.
(2)添加活性炭可以提高ASBR系统氢气产率和产氢速率.HRT为48,24,16,12h时细活性炭的添加使得ASBR反应器氢气产率分别提高65%,63%,54%,56%.HRT为12h时添加细活性炭的ASBR产氢速率达到最大(7.09±0.31)L·(L·d)-1,相应的氢气产率为(1.42±0.03)mol·mol-1.
(3)HRT由48h缩短至24h,3个ASBR反应器产氢速率变化不大,然而氢气产率急剧降低.HRT由24h缩短至12h时,3个ASBR反应器氢气产率变化不大,产氢速率分别由(2.72±0.23)L·(L·d-1),(2.44±0.33)L·(L·d-1),(1.99±0.35)L·(L·d)-1逐步提高至(5.25±0.23)L·(L·d-1),(7.09±0.31)L·(L·d-1),(4.54±0.23)L·(L·d)-1.在利用高浓度有机废水厌氧产氢实际工程中,较短的HRT和较高的产氢速率意味着较小的反应器体积和占地以及较高的能量产出,进而具有较高的经济效益.综合考虑发酵产氢技术效益和经济效益,HRT为12h较优.
(4)主要代谢产物为乙醇、乙酸、丙酸和正丁酸,其中乙酸和正丁酸占出水SMP的质量分数分别高达30%~34% 和46%~66%,是典型的丁酸型发酵.添加活性炭载体可以提高ASBR反应器出水溶解性代谢产物质量浓度.缩短HRT,3个ASBR出水中SMP质量浓度均降低.
[1] 李玉友,褚春凤,堆洋平.厌氧发酵生物制氢微生物及工艺开发的研究进展[J].环境科学学报,2009,29(8):1569.LI Yuyou, CHU Chunfeng, AKUTSU Yohei. Bacterial community and process development for anaerobic hydrogen fermentation[J].Acta Scientiae Circumstantiae,2009,29(8):1569.
[2] Show K Y,Zhang Z P,Tay J H,et al.Critical assessment of anaerobic processes for continuous biohydrogen production from organic wastewater [J].International Journal of Hydrogen Energy,2010,35(24):13350.
[3] Mohan S V. Harnessing of biohydrogen from wastewater treatment using mixed fermentative consortia: Process evaluation towards optimization [J].International Journal of Hydrogen Energy,2009,34(17):7460.
[4] Shin H S,Arooj M F,Han S K,et al.Sludge characteristics in anaerobic SBR system producing hydrogen gas [J].Water Research,2007,41(6):1177.
[5] Ren N Q,Tang J,Liu B F,et al.Biological hydrogen production in continuous stirred tank reactor systems with suspended and attached microbial growth [J].International Journal of Hydrogen Energy,2010,35(7):2807.
[6] Hawkes F R,Dinsdale R,Hawkes D L,et al.Sustainable fermentative hydrogen production:challenges for process optimisation[J].International Journal of Hydrogen Energy,2002,27(11/12):1339.
[7] Babu V L,Mohan S V,Sarma P N.Influence of reactor configuration on fermentative hydrogen production during wastewater treatment[J].International Journal of Hydrogen Energy,2009,34(8):3305.
[8] Kim S H,Han S K,Shin H S.Effect of substrate concentration on hydrogen production and 16S rDNA-based analysis of the microbial community in a continuous fermenter [J].Process Biochemistry,2006,41(1):199.
[9] Shin H S,Arooj M F,Han S K,et al.Continuous biohydrogen production in a CSTR using starch as a substrate [J].International Journal of Hydrogen Energy,2008,33(13):3289.
[10] Saraphirom P,Reungsang A.Biological hydrogen production from sweet sorghum syrup by mixed cultures using an anaerobic sequencing batch reactor(ASBR)[J].International Journal of Hydrogen Energy,2011,36(14):8765.
[11] Chang J S,Lee K S,Lin P J.Biohydrogen production with fixed-bed bioreactors [J].International Journal of Hydrogen Energy,2002,27(11/12):1167.
[12] WU S Y,HUNG C H,LIN C Y,et al.HRT-dependent hydrogen production and bacterial community structure of mixed anaerobic microflora in suspended, granular and immobilized sludge systems using glucose as the carbon substrate [J].International Journal of Hydrogen Energy,2008,33(5):1542.
[13] Lin C N,Wu S Y,Chang J S,et al.Biohydrogen production in a three-phase fluidized bed bioreactor using sewage sludge immobilized by ethylene-vinyl acetate copolymer [J].Bioresource Technology,2009,100(13):3298.
[14] Luo G,Xie L,Zou Z H,et al.Fermentative hydrogen production from cassava stillage by mixed anaerobic microflora:Effects of temperature and pH [J].Applied Energy,2010,87(12):3710.
[15] Wu S Y,Huang C H,Lin C N,et al.Fermentative hydrogen production and bacterial community structure in high-rate anaerobic bioreactors containing silicone-immobilized and selfflocculated sludge [J].Biotechnology and Bioengineering,2006,93(5):934.
[16] Van Ginkel S W,Logan B.Increased biological hydrogen production with reduced organic loading[J].Water Research,2005,39(16):3819.
[17] Kyazze G,Martinez-perez N,Dinsdale R,et al.Influence of substrate concentration on the stability and yield of continuous biohydrogen production [J ]. Biotechnology and Bioengineering,2006,93(5):971.

