可溶性酸性转化酶SAI基因在不同甘蔗基因型中表达分析
黄诚梅,杨翠芳,3,潘有强,魏源文,邓智年,吕维莉,李杨瑞,2
(1.广西作物遗传改良生物技术重点开放实验室,南宁530007;2.中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,南宁530007;3.广西师范大学,桂林541004)
可溶性酸性转化酶SAI基因在不同甘蔗基因型中表达分析
黄诚梅1,杨翠芳1,3,潘有强1,魏源文1,邓智年1,吕维莉1,李杨瑞1,2
(1.广西作物遗传改良生物技术重点开放实验室,南宁530007;2.中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,南宁530007;3.广西师范大学,桂林541004)
探讨与蔗糖代谢相关的甘蔗可溶性酸性转化酶(soluble acid invertase,SAI)基因时空表达,比较了桂糖28号(GT28)、拔地拉、新台糖20号(ROC20)、新台糖22号(ROC22)四个甘蔗基因型的+1、0叶、幼嫩叶鞘和幼茎4个部位在工艺成熟期中甘蔗SAI基因的表达水平。结果表明,在工艺成熟期甘蔗SAI在4个甘蔗基因型中4个部位均检测到其有表达,但甘蔗SAI表达水平在不同甘蔗基因型与组织部位因在不同工艺成熟阶段而有所差异。其中,SAI基因在工艺成熟前期有较高表达,而后逐渐下低,但在不同基因型的不同部位中表达规律性不是很明显,这可能与所用的甘蔗材料遗传背景等有关。
甘蔗;可溶性酸性转化酶;基因表达
甘蔗(Saccharum officinarum L.)是我国最为重要的糖料作物。蔗糖占世界食糖总产量的70%以上,占我国食糖总产量的90%以上。作为C4高生物量和高纤维作物,使甘蔗成为一种理想的能源作物。
甘蔗节间生长及其蔗糖积累过程是一个非常复杂的生理生化过程,参与蔗糖合成代谢相关的酶主要有中性转化酶(neutral invertase,NI)、可溶性酸性转化酶(soluble acid invertase,SAI)、蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)和蔗糖合成酶(sucrose synthase,SS)[1]。SAI是一个非常重要的调控酶,在许多植物中SAI都直接调控蔗糖的累积[1-4]。在甘蔗中,SAI酶活性与蔗糖含量具有明显的相关性[1,3,5],SPS酶活性与蔗糖含量没有明显的相关性,而SPS与SAI酶活性比值与蔗糖含量的相关性高达0.93。SAI在果实生长发育和糖分积累中具有重要的调控作用,是大多数植物果实生长发育和蔗糖积累的关键酶之一[4,6-7]。SAI调控源-库关系所起的作用已经在C3模式植物如烟草、拟南芥、马铃薯和番茄中得到证明。目前,SAI基因已从番茄[8]、玉米[9]、水稻[10]、葡萄[11]、柑橘[12]、甜瓜[4]、甜高粱[13]等植物中被克隆,并对其进行相关功能研究。甘蔗SAI基因于1998年成功克隆(AF062735、AF062734),该基因家族的其它成员也先后被成功克隆出来,如scinvh(AF083855)、scinvh3'2(AF083856)、Shcw1(AY302084)、ShinvA(AY302083),但仅获得基因片段序列,对于该基因家族的功能及表达特性等方面研究报道较少。本研究通过半定量与荧光定量PCR方法对甘蔗SAI基因在工艺成熟期不同甘蔗基因型及其不同部位中的表达水平进行分析,以探讨该基因表达特性以及为了解其对甘蔗高产高糖的贡献作用,这将为甘蔗高产高糖的生产及其育种目标提供一个有效选择标记。
1 材料与方法
1.1实验材料
供试甘蔗材料包括桂糖28号(GT28)、果蔗拔地拉(Badila)、新台糖20号(ROC20)、新台糖22号(ROC22),由广西作物改良生物技术重点开放实验室提供。
甘蔗总RNA提取Trizol购自Invitrogen公司;定量PCR试剂SYBR Premix Ex Taq、DNA Maker、Ex-Taq酶、dNTPs Mixture、载体pMD-18-T-Vector、IPTG、X-Gal等均购自宝生物工程(大连)有限公司(Takara);荧光定量PCR扩增引物由英潍捷基(上海)贸易有限公司(Invitrogen)合成;所用的菌株为由本实验室保存的大肠杆菌JM109,小量胶回收试剂盒购自上海华禹生物工程有限公司、上海华尧核酸技术有限公司;其他试剂均为进口分装或国产分析纯。定量PCR仪为BIO-RAD iCycler iQ荧光定量PCR仪。
1.2实验方法
1.2.1 材料种植、取样试验在广西农业科学院温室大棚进行,采用口径为35 cm、桶底直径为28 cm的黑色塑料桶装沙质土壤进行桶栽,于2011年1月18日下种,每桶4~6芽,齐苗后定苗,每桶2~3株,其余管理措施与一般桶栽试验的管理相同。取样于2011年8月29日(甘蔗处于生长后期、工艺成熟初期)进行,取样方法参考杨翠芳等[14]进行采样,液氮速冻后混匀分装保存用于总RNA提取。
1.2.2 基因表达分析(1)引物设计:根据GenBank中甘蔗SAI基因的核酸序列(登录号AF062735),利用Primer Premier 5.0软件分析设计半定量与定量RT-PCR特异引物,引物序列为:aF1:5'-CGT CCT ACA ACC ACG ACT ACA T-3'和aR1:5'-GGT ACA AGA AGA TGC TTC GCT AT-3'。内参基因的引物参考甘蔗的看家基因25S rRNA的实时PCR引物[15],引物序列为:RF2:5'-GCAG CCAA GCGT TCAT AGC-3'和RR2:5'-CCTA TTGG TGGG TGAA CAAT CC-3'。
(2)甘蔗总RNA提取及cDNA第一链合成:参照Invitrogen的TRIZOL方法[14]提取甘蔗各部位的总RNA。取各个部位的总RNA 500 ng,用TaKaRa公司AMV Reverse Transcriptase XL反转录酶进行反转录合成cDNA第一链,反应结束后将cDNA第一链冻置-20℃备用。
(3)甘蔗SAI基因的半定量RT-PCR分析:以甘蔗工艺成熟中期(2011年11月11日)各基因型各个部位的cDNA第一链为模板,以目的基因甘蔗SAI引物及内参基因25S rRNA的引物进行半定量RT-PCR扩增,分析SAI的表达情况。PCR反应体系与程序参考杨翠芳等[14]进行。反应完成后,取5μL扩增产物用1%琼脂糖凝胶进行电泳检测。
(4)甘蔗SAI基因的实时荧光定量PCR分析:采用BIO-RAD iCycler iQ荧光定量PCR仪进行扩增,分别用甘蔗工艺成熟时期各种部位的cDNA为模板分别进行目的基因和内参基因的定量扩增,每个样品设3个重复。另外,每批设ddH2O作为模板的空白对照。以25S rRNA为内参基因,设定GT28+1叶为校准样本,其它部位均为待测样品,2-△△Ct法分析基因相对表达水平,比较SAI基因在各组织部位表达差异。
反应条件为:94℃,2 min,94℃,30s,50~55℃,15s,Plate Read,72℃,30s,go to line 2 for 40个循环,melting cure from 55.0℃to 90.0℃,reading every 1.0℃holding 10s。
(5)数据分析:将2-△△Ct法分析和修正的数据导入到EXCEL软件,生成各个样本的相对表达量图谱,并采用DPS v8.01软件进行统计分析,以Duncan多重比较检验差异显著性。
2 结果与分析
2.1甘蔗SAI基因的半定量RT-PCR分析
图1结果显示,在甘蔗工艺成熟中期,SAI基因表达水平以在GT28的4个部位较其它3个品种的高,其次是果蔗Badila,而在相对早熟高糖品种ROC20与ROC22中表达量较低。
2.2甘蔗SAI基因的荧光定量RT-PCR分析
2.2.1 甘蔗工艺成熟初期SAI基因表达分析从图2中可见,在甘蔗工艺成熟初期,SAI在4个甘蔗基因型中的+1、0叶、幼嫩叶鞘和幼茎中均检测到其有表达,但SAI表达因甘蔗基因型不同而有所差异。4个甘蔗基因型以ROC22幼嫩叶鞘相对表达量最高,其次该品种的幼茎与+1叶相对表达量也较高,而以GT28在4个部位中相对表达量稍低,ROC20+1叶相对表达量最低。
2.2.2 甘蔗工艺成熟中期SAI基因表达分析在甘蔗工艺成熟中期,SAI相对表达量在4个甘蔗基因型的+1叶、0叶、幼嫩叶鞘、幼茎中的相对表达量均较工艺成熟初期的低,较于GT28+1叶的低,尤其是在ROC22,这与半定量PCR结果相似,在相对早熟高糖品种ROC20与ROC22中表达量均较低(图3)。
2.2.3 甘蔗工艺成熟后期SAI基因表达分析在甘蔗工艺成熟后期,SAI相对表达量在4个甘蔗基因型中以在ROC22幼嫩叶鞘与ROC20+1叶中表达量高,其次为果蔗Badila幼嫩叶鞘,在其它品种中其它部位均有较低的相对表达量(图4)。
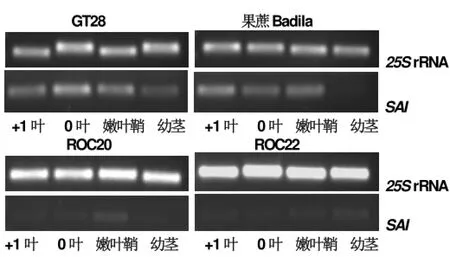
图1 甘蔗工艺成熟中期SAI基因半定量表达分析
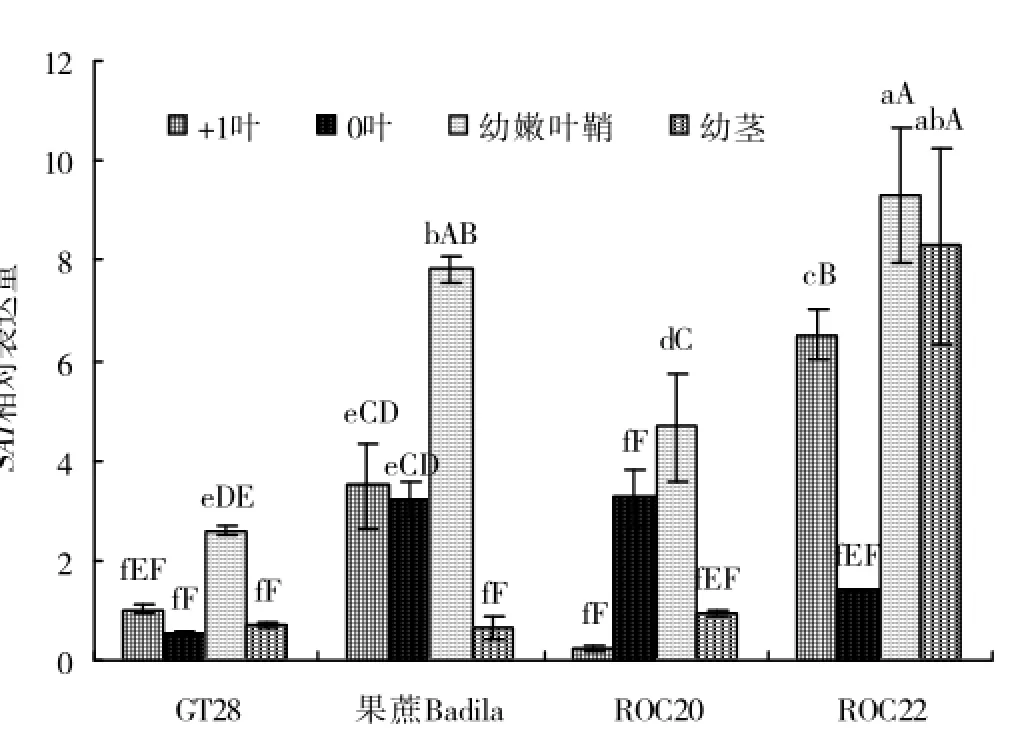
图2 甘蔗工艺成熟初期(2011年8月29日)SAI基因表达分析
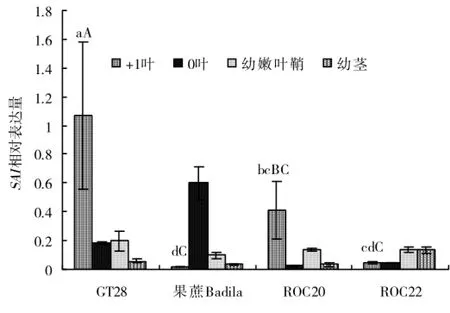
图3 甘蔗工艺成熟中期(2011年11月11日)SAI基因表达分析
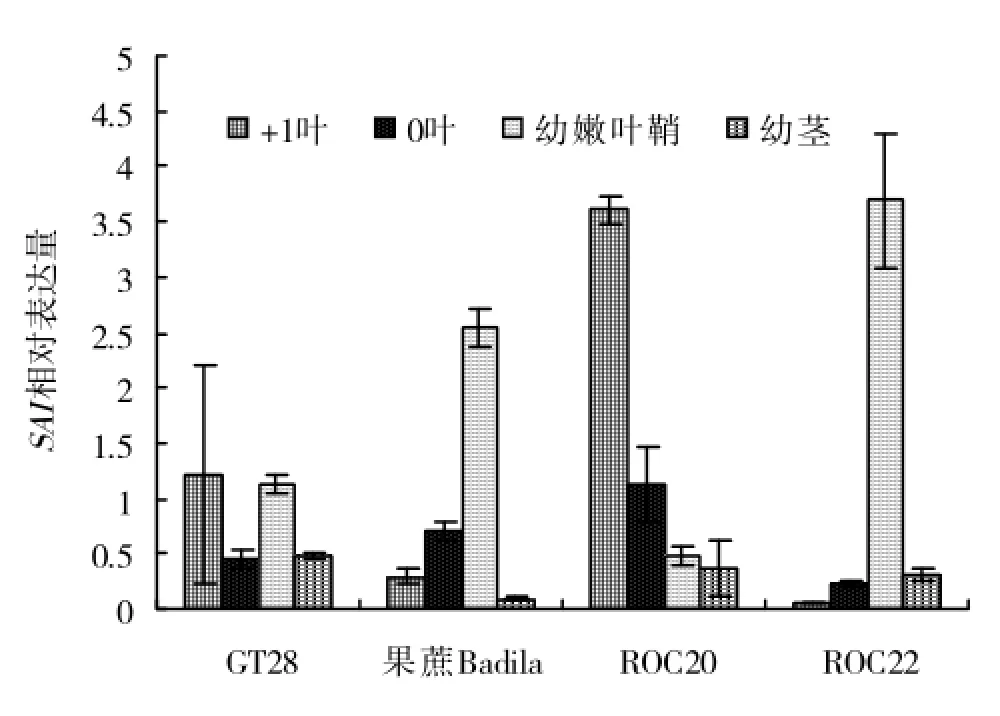
图4 甘蔗工艺成熟后期(2011年12月21日)SAI基因表达分析
3 讨论
蔗糖是甘蔗光合作用的主要产物之一,也是植物体内光合产物运输与分配的主要形式,蔗糖在甘蔗中以一种定向运输和分配的方式调控甘蔗的整个生长和发育进程(包括相关的生理过程、生化代谢途径和基因表达等),同时也决定甘蔗产量和品质[16]。在甘蔗[1]、果实[7]等蔗糖积累代谢研究表明,与蔗糖代谢相关的酶有SAI、NI、SS和SPS。而SAI在许多植物中直接调控蔗糖的累积[1-4]。在甘蔗中,SAI酶活性与蔗糖含量具有明显的相关性[1,3,5]。本研究以不同甘蔗基因型的+1叶、0叶、幼嫩叶鞘、幼茎为试材,通过半定量与荧光定量PCR方法对可溶性酸性转化酶基因时空表达差异进行分析,探讨了该基因表达特性以及进一步了解其对甘蔗高产高糖的贡献作用。
试验研究表明,在工艺成熟期甘蔗SAI在4个甘蔗基因型中4个部位中均检测到其有表达,但甘蔗SAI表达水平在不同甘蔗基因型与组织部位因在不同工艺成熟阶段而有所差异。其中在成熟初期,4个甘蔗基因型以ROC22幼嫩叶鞘、幼茎与+1叶相对表达量均较高,而以GT28在4个部位中相对表达量稍低,ROC20+ 1叶相对表达量最低。在中期,SAI相对表达量在4个甘蔗基因型的+1叶、0叶、幼嫩叶鞘、幼茎中的相对表达量均较工艺成熟初期的低,明显低于GT28+1叶,这与半定量PCR结果相似,在相对早熟高糖品种ROC20与ROC22中表达量均较低。到了成熟后期,以在ROC22幼嫩叶鞘与ROC20+1叶中表达量高,其次为果蔗Badila幼嫩叶鞘,在其它品种中其它部位均有较低的相对表达量。通过对SAI基因在成熟期中相对表达量分析表明,SAI基因在前期有较高表达,而后逐渐降低,而在不同基因型的不同部位中表达规律不是很明显,这可能与所用的甘蔗材料遗传背景等有关,这与本课题组杨翠芳等[14]研究甘蔗SPSⅢ表达情况结果相同。其中GT28、ROC20、ROC22都是生产上的甘蔗品种,遗传背景差异很大。而Badila是甘蔗属中的热带种典型代表之一,2n=80,遗传背景较单一[17]。Ashok K.Verma等[18]研究表明,低糖甘蔗品种叶片的酸性转化酶活性较高,而中性转化酶活性较低。相关分析结果表明,叶片酸性转化酶活性与蔗糖分呈负相关,而与己糖含量呈正相关;相反,叶片中性转化酶与蔗糖分呈正相关,与己糖含量呈负相关。郭家文等[19]研究表明,在甘蔗成熟期,叶片的酸性转化酶活性随着甘蔗的成熟而降低,中性转化酶活性随着甘蔗的成熟而升高,不同的供试材料具有不同的酶活性变化,材料间的差异较大。至于SAI在高、低糖甘蔗基因型及不同成熟度节间的表达水平与蔗糖代谢之间的关系等,我们正在继续研究,以进一步探讨SAI基因表达对甘蔗糖分积累的影响。
[1]Zhu YJ,Komor E,Moore PH.Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase[J].Plant Physiol,1997,115(2):609-616.
[2]Rita Zrenner,Konrad Schüler,Uwe Sonnewald.Soluble acid invertase determines the hexose-to-sucrose ratio in cold-stored potato tubers[J].Planta,1996,198(2):246-252.
[3]Lingle SE,Tew TL.A comparison of growth and sucrose metabolism in sugarcane germplasm from Louisiana and Hawaii[J].Crop Science,2008,48(3):115-1163.
[4]Tian HM,Kong QG,Feng YQ,Yu XY.Cloning and characterization of a soluble acid invertase-encoding gene from muskmelon[J]. Mol.Biol.Rep.,2009,36(3):611-617.
[5]潘有强,罗海玲,李杨瑞.甘蔗节间蔗糖含量与和蔗糖代谢相关的4种酶活性之间的关系剖析[J].植物生理学通讯,2007,43(5):861-864.
[6]赵智中.柑橘果实糖积累的生理基础研究[D].杭州:浙江大学,2001.
[7]樊继德.甜瓜酸性转化酶基因表达特性分析及功能鉴定[D].济南:山东农业大学,2007.
[8]Elliott KJ,Buttler WO,Dickinson CD,Konno Y,Vedvick TS,Fitzmaurice L,Mirkov TE.Isolation and characterization of fruit vacuolar invertase genes from two tomato species and temporal differences in mRNA levels during fruit ripening[J].Plant Mol Biol,1993,21(3):515-524.
[9]Kim JY,MahéA,Guy S,Brangeon J,Roche O,Chourey PS,Prioul JL.Characterization of two members of the maize gene family, Incw3 and Incw4,encoding cell-wall invertases[J].Gene,2000,245(1):89-102.
[10]Ji X,Van den Ende W,Van Laere A,Cheng S,Bennett J.Structure,evolution,and expression of the two invertase gene families of rice[J].J.Mol.Evol.,2005,60(5):615-634.
[11]Davies C and Robinson SP.Sugar accumulation in grape berries.Cloning of two putative vacuolar invertase cDNAs and their expression in grapevine tissues[J].Plant Physiol.,1996,111(1):275-283.
[12]Liu Y,Liu Q,Xiong J,Deng X.Difference of a citrus late-ripening mutant(Citrus sinensis)from its parental line in sugar and acid metabolism at the fruit ripening stage[J].Sci.China C Life Sci.,2007,50(4):511-517.
[13]Jain M,Chourey PS,Li QB,Pring DR.Expression of cell wall invertase and several other genes of sugar metabolism in relation to seed development in sorghum(Sorghum bicolor)[J].J.Plant Physiol.,2008,165(3):331-344.
[14]杨翠芳,黄诚梅,潘有强,等.甘蔗蔗糖磷酸合成酶SPSⅢ基因表达的初步研究[J].南方农业学报,2012,43(6):723-726.
[15]Hayati MI,Robert SS,Rosanne EC,Graham DB,Donald J M,John MM.Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J].Plant Molecular Biology Reporter,2004,22(4):325-337.
[16]王俊刚,赵婷婷,张树珍,等.甘蔗体内的蔗糖转运与运输途径[J].植物生理学通讯,2008,44(3):605-611.
[17]王英,高和琼,庄南生,等.崖城割手密11号与拔地拉核型比较分析[J].中国农学通报,2008,24(3):52-57.
[18]Ashok K.Verma,S.Solomon,Praveen C.Verma,Ashok Singh,S.B.Singh.Relationship between invertase(s)activity and sucrose metabolism in the leaves of high and low sugar cultivars of sugarcane(Saccharum officinarum L.)[J].Guangxi Agricultural Sciences,2010,41(4):313-318.
[19]郭家文,刘少春,张跃彬,等.成熟期不同基因型甘蔗糖分和叶片酶活性的变化[J].中国糖料,2006(3):16-18,21.
Expression Analysis of Soluble Acid Invertase Gene SAI in Different Sugarcane(Saccharum officinarum L.)Varieties
HUANG Cheng-mei1,YANG Cui-fang1,3,PAN You-qiang1,WEI Yuan-wen1,DENG Zhi-nian1,LV Wei-li1,LI Yang-rui1,2
(1.Guangxi Crop Genetic Improvement and Biotechnology Lab,Nanning 530007,China;2.Sugarcane Research Center,Chinese Academy of Agricultural Sciences/Guangxi Key Laboratory of Sugarcane Biotechnology and Genetic Improvement,Ministry of Agriculture,Nanning 530007,China;3.Guangxi Normal University,Guilin 541004,China)
The temporal and spatial expression of soluble acid invertase(SAI)gene related to sucrose metabolism in sugarcane(Saccharum officinarum L.)was investigated.Four sugarcane varieties,GT28,Badila, ROC20 and ROC22 were used as experimental materials.1st and 0 leaf,young sheath and young stalk were sampled to assay the expression of SAI in the technical maturing stage.The results showed that SAI was expressed in all four sampled parts,i.e.,1st and 0 leaf,young sheath and young stalk in all four sugarcane genotypes,but the expression levels varied in different genotypes,different parts and different stages.The expression of SAI was higher in the early technical maturing phase,and low in the late technical maturing phase. No general pattern was observed for the expression of SAI in differentgenotypes and parts during different stages passibly due to their genetic backgrounds.
sugarcane;soluble acid invertase;gene expression
S566.101;Q78
:A
1007-2624(2013)02-0021-04
2013-02-19
广西自然科学基金创新研究团队项目(2011GXNSFF018002)、广西自然科学基金项目(2011GXNSFA018111);广西科学研究与技术开发计划项目:科技创新能力与条件建设(桂科能0815011-6-1)、科技攻关计划(桂科攻1222009-1B);广西农业科学院基本科研业务专项[200802Z(基)]、科技发展基金项目(2007024)。
黄诚梅(1979-),女,副研究员,博士,研究方向:甘蔗栽培与分子生物学。E-mail:huangchengmei@gxaas.net
李杨瑞(1957-),男,教授,博士生导师,研究方向:甘蔗栽培学,E-mail:liyr@gxaas.net

