不同持续时间离心运动对大鼠骨骼肌LDH和SDH的影响
陶霞张宇
(湖南商学院 体育教研部,湖南长沙410205)
0 前言
琥珀酸脱氢酶(SDH)为线粒体的标志酶,可催化琥珀酸生成延胡索酸即参与TCA循环,可用于评定运动员有氧氧化能力的高低。乳酸脱氢酶(LDH)分布于肾脏、骨骼肌、肝脏和心脏等器官,其活性大小可用来评价运动员无氧代谢能力的高低。耐力性运动员肌纤维中有氧代谢酶(SDH)活性高,而无氧代谢酶(LDH)活性低,速度性运动员则相反[1]。
王松[2]等研究发现有氧耐力训练对骨骼肌的影响与年龄有关,提示早期(幼儿时期)进行有氧耐力训练可能是提高有氧运动能力的最佳时期。本文通过观察3周、6周和9周离心运动训练对发育期大鼠股四头肌LDH及SDH活性的变化,探讨离心运动训练对发育期大鼠骨骼肌的影响及其时间适应性变化。
1 材料与方法
1.1 动物与分组
健康SD雄性大鼠48只(分8组,每组6只;发育期24只,3周龄;成年大鼠24只,3月龄),常规饲养。将发育期与成年大鼠随机分为对照组(NC组)、3W训练组(T3组)、6W训练组(T6组)、9W训练组(T9组)。以国家标准啮齿类动物饲养,实验期间室温保持22℃±2℃相对湿度为50%±5%,自然光照,自由饮水,分笼饲养,坚持1-2d换一次垫料。
1.2 运动方案
采用杭州立泰科技有限公司PT动物实验跑台,参照Bedford[3]的运动负荷方案。第一周为熟悉跑台和适应运动负荷阶段,运动强度逐渐增加(跑台坡度由0°-10°,跑台速度由10m/min逐渐增加到26.8m/ min,训练时间逐渐增加),从第二周开始进行正式训练,每次训练保持跑台坡度为10°不变,跑台速度在训练开始后1分钟左右升到26.8m/ min,运动时间为30min。每周训练5天,休息2天。运动时采用毛刷刺激大鼠尾部,必要时采用声音刺激或电刺激,以保证运动强度与运动量。
1.3 检测指标与方法
取待测样品,稍解冻后,剪取股四头肌肌腹红白混合处组织约0.5g,称重,用生理盐水按1∶10稀释后匀浆,以1000~2000r/min离心20分钟(美国Sigma2K-15型低温离心机),吸取上清液待测。以上步骤均在0~4℃条件下进行。
股四头肌SDH活性:采用紫外分光光度法(美国Beckman DU-640)测定10%腓肠肌匀浆液中SDH活性。DH试剂盒购于北京鼎国昌盛生物技术有限责任公司。
腓肠肌LDH活性:采用半自动生化分析仪(Rayto公司,德国)内设的“速率法”测定0.5%腓肠肌匀浆液中LDH活性。
总蛋白浓度∶双缩脲法。采用半自动生化分析仪(Rayto公司,德国)内设的“终点法”测定。总蛋白试剂盒由北京鼎国昌盛生物技术有限责任公司提供。
1.4 统计方法
所有数据均采用SPSS13.0统计软件处理,结果用平均数、标准差)表示。两组样本平均差异的显著性检验(双侧t检验),显著水平取α=0.05。
2 结果
2.1 各组大鼠股四头肌SDH的变化

表1 大鼠股四头肌SDH的变化情况(U/mgpro)

图1
实验结果如表1所示:与NC组相比,发育组大鼠3W与6W组比较SDH升高(p<0.05);与成年组相比,3W与6W组SDH高于DT组(p<0.05)。发育组与成年组比较3周与6周组SDH活性有明显提高,9周组无明显差异。
训练时间对SDH的影响如图1所示,从时间上比较,DT组3W组SDH活性明显高于6W、9W组(p<0.05),而6W组又明显高于9W组。MT组3W、6W组SDH活性与NC组相比呈下降趋势但无统计学意义,9W组SDH升高但亦无统计学意义。DT组随着训练时间的延长,其SDH酶活性曲线先上升后下降,在3周时达到最高峰。MT组先下降后上升,在9周时达到最高。
2.2 各组大鼠股四头肌LDH的变化

表2 大鼠股四头肌LDH的变化情况(U/100mgpro)
实验结果如表2所示:与NC组相比,DT组LDH均下降,但只有6W组具有统计学意义。与MT组相比,DT组LDH活性基本均高于MT组但无统计学意义。
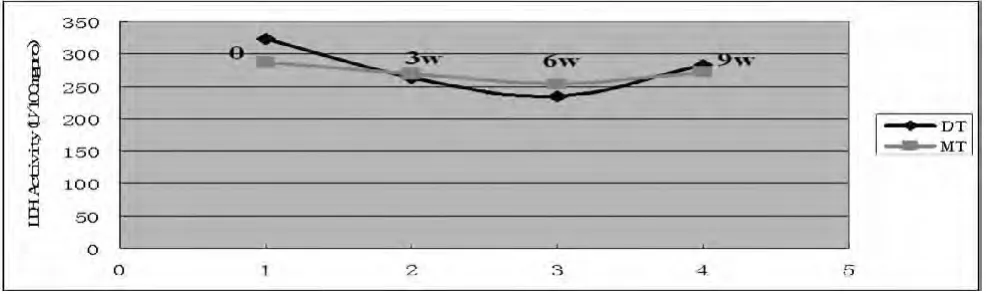
图2
训练时间对LDH的影响如图2所示:DT与MT组一样在3W、6W、9W组的变化为先降低后升高,但均无统计学意义。DT组与MT组LDH酶活性变化曲线呈相似性,随着训练时间的延长,其LDH酶活性曲线先下降后上升,在6周时达到最低,但DT组曲线幅度大于MT组。
3 讨论与分析
3.1 离心运动对大鼠股四头肌SDH活性的影响
琥珀酸脱氢酶(SDH)催化琥珀酸脱氢生成延胡索酸,是有氧代谢途径中的催化酶之一,也是线粒体的标志酶,它活性的高低能反映有氧氧化能力。王松[2]等探讨有氧耐力训练对不同周龄大鼠骨骼肌代谢酶活性的影响,研究发现8周游泳训练后,可提高4周龄组、8周龄组、12周龄组大鼠骨骼肌SDH酶活性,且4周龄组、8周龄组效果更突出。这与本研究结果一致:发育组3周、6周训练SDH酶活性明显升高,而成年组未见这种变化,相反还出现了SDH酶活性的降低(无统计学意义)。且发育鼠3周、6周组SDH酶活性均明显高于成年鼠。李开刚[4]等人采用不同的训练强度对大鼠进行l6周跑台耐力训练,结果发现SDH的活性在各训练组均有不同程度的升高(P<0.05)。Costill等[5]对从事田径项目运动员肌肉SDH活性进行了研究,发现中长跑运动员SDH活性最高,短跑运动员轻微增加,而田赛运动员SDH活性与对照组无差别。这些结果均提示不同强度的耐力训练后,大鼠骨骼肌氧化酶活性,最适宜的变化出现在中等强度。本研究发现成年组3周、6周训练后出现了SDH酶活性的降低(无统计学意义),分析其原因可能是运动强度过大。
于新凯[6]等研究表明1次运动后即刻大鼠血清CK、LDH活性迅速上升,然后逐渐下降;运动后7天虽明显恢复,但仍未恢复到正常值。1周运动组大鼠血清CK、LDH活性的变化趋势类似于1次运动组,但各点均低于1次运动组,而且在7天后恢复到正常值。说明运动初期产生的损伤得到修复,肌肉可对同等强度的运动逐渐产生适应一些。也有研究表明,训练可减少一次运动造成的肌肉损伤,降低血清肌肉酶的活性。三组受试者进行两次间隔分别为3、6、9周的下坡跑后发现,前两组在第二次运动后血清CK活性明显降低;反复的等长运动也发现有同样的变化规律[7]。这与本研究的结果一致,发育期与成年大鼠进行3周、6周大强度离心运动后均有变化,在训练9周后恢复到接近正常水平,由此表明在训练9周时会产生适应性变化。
研究提示,离心运动能明显提高发育期骨骼肌中的琥珀酸脱氢酶活性,越早进行有氧耐力训练,机体越能表现出更强的适应性和可塑性,从而为提高有氧运动能力打下更强的身体机能基础。离心运动对大鼠骨骼肌代谢酶的影响,可随着训练时间的增长产生适应性变化。
3.2 离心运动对大鼠股四头肌LDH的影响
乳酸脱氢酶(LDH)是机体糖酵解供能系统的关键酶之一,催化丙酮酸加氢生成乳酸的可逆反应(无氧酵解的终末步骤)。主要存在于骨骼肌内,对保证肌肉在短暂缺氧时仍能获取ATP至关重要,体现了糖酵解系统供能能力。
Gillespie的研究表明[8]在耐力训练后所有肌纤维的乳酸脱氢酶活性降低。Hickson等人[9]研究也发现,比目鱼肌和腓肠肌的乳酸脱氢酶活性在经过快跑和耐力跑训练后都显著降低。李开刚[3]对大鼠进行了16周不同强度的耐力训练后发现,大鼠骨骼肌乳酸脱氢酶活性在各训练组不变或有降低的趋势,而琥珀酸脱氢酶的活性在各组均有不同程度的增加。本实验的结果与以上的研究类似,各训练组的乳酸脱氢酶活性都有所降低,且发育期大鼠的LDH变化曲线幅度大于成年大鼠。
目前常氧训练对LDH活性影响的研究结论存在争议,这可能与选择观察的骨骼肌类型、观察时间点及复制模型时采用的训练强度与训练周期不同有关。Vogt等人[10]证明,较高强度训练后(血乳酸4~6mM),磷酸果糖激酶(PFK)mRNA表达明显增强,较低强度(血乳酸2~3mM)训练后,PFK mRNA表达呈减弱趋势。还有研究认为,极高强度训练才能提高糖酵解酶活性。毛杉杉[11]等研究未观察到常氧训练条件下LDH活性的升高。Favero[12]等人对雌性SD大鼠建立6、16、26周耐力训练模型,分别于6、16、26周训练结束后取跖肌进行指标测试,结果发现6周和l6周运动训练组LDH活性无变化,26周运动组LDH活性与对照组相比下降45%。王荣辉[13]等发现平原耐力训练3周后,大鼠排肠肌无氧代谢酶LDH活性无显著性变化。本研究发现只有发育期大鼠训练6周时出现了LDH的显著性降低。可能与本次实验训练方案的强度不够有关,该训练强度下所堆积的乳酸尚不足以刺激大鼠LDH活性升高或根本不足以刺激糖酵解途径发挥作用。
4 小结
离心运动可引起发育期大鼠SDH先升高后降低,LDH先降低后升高。离心运动对发育期大鼠SDH、LDH的影响大于成年大鼠,且在运动6W时差异最大。越早进行有氧耐力训练,机体越能表现出更强的适应性和可塑性,从而为提高有氧运动能力打下更强的身体机能基础。离心运动对大鼠骨骼肌代谢酶的影响,可随着训练时间的增长产生适应性变化。
[1]张蓓,周研,沈利岩.运动对骨骼肌酶活性调节的研究进展[J].中华临床医学杂志,2008,09(03):56-58.
[2]王松,刘刚,等.有氧耐力训练对不同周龄大鼠骨骼肌代谢酶的影响[J].山东体育学院学报,2008,24(04):60-63.
[3]TOBYG.BEDFORD,CHARLESM.TIPTON,NOELAC.wILSON,Maximum oxygen consumption of rats and its changes with various experimenta lproeedures[J].
[4]李开刚,陆绍中,冯连世,等.不同强度耐力训练后大鼠骨骼肌酶活性适应性变化的研究[J].中国运动医学杂志,2002,21(02):166-l69.
[5]Costill DL,et a1.Skeletal muscle enzymes and fiber composition in man and female track athletes[J].J Appl Physiol,1976,40∶149.
[6]于新凯,田野,等.下坡跑训练对大鼠血清CK、LDH的影响[J].上海体育学院学报,2000,24(03):30-32.
[7]刘洵,谭思洁,等.相对运动强度与绝对运动强度对血清酶活性的影响[J].体育科学,2005,05(25):44-46.
[8]Gillespie A C,et al.Enzyme adaptation in rat skeletal muscle after two intensities of treadmill training[J].Med Sci Sports Exerc,1982,14∶61.
[9]Hickson Skeletal muscle enzyme alteration after sprint and endurance training [J].J ApplPhysiol,1975,40:868.
[10]Vogt M,Puntschart A,Geiser J,et al.Molecular adaptations in human skeletal muscle to endurance training under simulated hypoxic condition[J].J Appl Physiol,2001,91:173-182.
[11]毛杉杉,潘同斌,王瑞元,等.高住低训对大鼠骨骼肌SDH与LDH活性的影响[J].中国运动医学杂志,2005,24(05):551-554.
[12]Favero TG,eta1.Training—induced alterations in lactatedehydrogenase reaction kinetics in rats:A re-examination[J].Exp Physiol,1999,84:989-998.
[13]王荣辉,刘桂华,胡琪,等.低氧训练对大鼠骨骼肌乳酸脱氢酶和苹果酸脱氢酶活性的影响[J].北京体育大学学报,1998,21(03):31-33.

