树豆脂溶性部位对糖尿病和肥胖小鼠骨密度及血脂水平的影响
叶贵福,王 璐,杨瑞仪,田汝华,胡英杰,沈小玲
(广州中医药大学热带医学研究所中药新药发现实验室,广东广州 510405)
骨质疏松症是一种常见病,主要累及老年人,其特点是骨量减少、骨组织微细结构受损和脆性骨折的风险增加[1-2]。肥胖和糖尿病是常见的内分泌疾病,能够引起或者加速骨质疏松的发生[3-4]。因此认为通过控制血糖和血脂,可以减少糖尿病和肥胖症患者的骨丢失,提高骨密度,改善骨质疏松症状[4-5]。
树豆(Cajanus cajan L.Millspaugh)是蝶形花科(Papilionaceae)木豆属(Cajanus DC.)多年生灌木[6]。树豆嫩枝叶的水提取物能促进坏死股骨头的修复、促进骨髓间充质干细胞的生长、改善雌激素缺乏所致骨质疏松等,在临床上被用于治疗缺血性股骨头坏死[7]。树豆脂溶性部位有降血糖和血脂的作用[8-9],该部位的主要化学成分与水溶性部位成分差异十分明显[10]。当前树豆对骨的作用研究主要集中在其水溶性部位,对脂溶性部位的研究较少,仅见郑元元等[11]报道树豆的茋类提取物具有改善雌激素缺乏大鼠骨质丢失的作用。未见有关树豆用于治疗糖尿病性或肥胖性骨质疏松的研究报道。
db/db小鼠是一种先天肥胖糖尿病小鼠,4周龄时体重和血糖开始明显上升。在长期的高血糖后,db/db小鼠会相继出现糖尿病并发症,这些并发症包括骨质疏松症的出现[4]。ob/ob小鼠是一种先天肥胖高血糖小鼠,4周龄时即出现增重加速并很快出现肥胖表型并伴有高血糖[12],ob/ob小鼠存在着体内脂肪组织异常分布、过度堆积的情况,并且脂肪组织呈现持续性增长,这些因素都有可能引起或加剧骨质疏松症的发生。
鉴于此,我们选择db/db小鼠和ob/ob小鼠作为肥胖和糖尿病性骨质疏松模型,评价了树豆脂溶性部位改善高血糖及肥胖所导致骨质疏松症状的能力。
1 材料与方法
1.1 树豆脂溶性部位的制备取干燥树豆枝叶1 000 g,切成小段,置于10 L圆底烧瓶中,加体积分数为0.95的乙醇6 L回流提取3次,每次2 h,合并提取液,减压回收乙醇至无醇味。将浸膏分散于1 000 ml的热水中,超声处理使其成为均匀的混悬液。将混悬液冷却至室温后放置于4℃冰箱过夜,离心,弃去上清液,沉淀用热水同法洗涤3次后再混悬于水中,先用石油醚500 ml萃取3次以除去叶绿素,再用500 ml氯仿萃取3次。氯仿萃取液减压回收氯仿,得到树豆脂溶性部位11 g,以SDE表示。
将SDE用质量浓度为5 g·L-1的 CMCNa研磨,分别制成 10 g·L-1和 5 g·L-1的混悬液,灭菌备用。
1.2 试剂与仪器电子天平,赛西杰 DTT-B100;固体密度测定仪,DahoMeter DE-120M;酶联免疫检测仪,赛默飞世尔科技公司;对硝基苯(PNP),天津市福晨化学试剂厂,批号20110102;对硝基苯酚磷酸盐(pNPP),Sigma,批号 20110818;甘油三酯(TG)测定试剂盒、总胆固醇(TC)测定试剂盒、高密度脂蛋白胆固醇(HDL-C)测定试剂盒、低密度脂蛋白胆固醇(LDL-C)测定试剂盒均购自长春汇力生物技术有限公司,批号分别为:2012008、2012032、2012032、2012045;钙试剂盒,南京建成生物工程研究所,批号20120720。
1.3 动物和动物实验本实验所用db/db先天肥胖糖尿病小鼠、ob/ob先天肥胖高血糖小鼠,以及杂合子的db和ob小鼠,是通过从美国Jax Lab引入db小鼠和ob小鼠繁育对在SPF级实验室进行繁育得到。实验得到广州中医药大学动物实验伦理委员会的许可[实验许可证号:SYXY(粤)2008-001],并严格按照动物实验有关规定进行。
1.3.1 db/db小鼠的分组和治疗 2月龄db/db小鼠20只[♀9,♂11,体质量(30.0 ± 3.0)g],随机分为模型组6只(♀3,♂3),SDE高剂量组7只(♀3,♂4),SDE 低剂量组7只(♀3,♂4)。另选6只同源杂合子db小鼠(♀3,♂3)作为随机对照组。按0.01 ml·g-1的灌胃体积计,SDE高剂量组(HSDE)100 mg·kg-1·d-1,SDE 低剂量组(L-SDE)50 mg·kg-1·d-1,模型组、随机对照组灌服质量浓度为5 g·L-1的 CMCNa。连续给药8周。每隔3天测1次体重。
1.3.2 ob/ob小鼠的分组和治疗 4月龄ob/ob小鼠21只[♀11,♂10,体质量(58.0±2.6)g],随机分成3组,每组7只,分别为模型组(♀3,♂4)、SDE高剂量组(♀4,♂3)和 SDE低剂量组(♀4,♂3)。同时以6只(♀3,♂3)同源杂合子ob小鼠作为随行对照组。治疗方法与db/db小鼠相同。连续给药8周,每隔3天测1次体重。
1.4 血清生化指标检测末次给药后次日,小鼠禁食不禁水12 h,眼眶静脉取血,离心分离血清。采用总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和钙试剂盒检测血清中各项指标;血清碱性磷酸酶(ALP)以pNPP偶氮法进行测定。
1.5 血清ALP测定(pNPP偶氮法)测定方法参照包蕾等[13]的操作方法并进行改良。具体方法如下:于96孔板中,每孔加入150 μl显色底物溶液和5 μl样品(3个复孔),37 ℃避光放置0.5 h,然后加入50 μl终止液,终止反应,用酶标仪于405 nm波长下测定OD值。样品OD值在ALP标准曲线上计算出酶活性值(U·L-1)。
1.6 骨密度测定将采血后的小鼠颈椎脱臼处死。取两侧胫骨,60℃烘烤24 h后,采用固体密度测定仪测定骨密度。
1.7 统计学方法采用SPSS13.0软件处理,实验数据以±s表示,多组间比较用方差分析,两均数比较采用t检验。
2 结果
2.1 SDE对小鼠体重的影响实验开始和结束时各组小鼠体重记录见Tab 1。可看出,无论是db/db小鼠,还是ob/ob小鼠,其体重都明显比其同龄的杂合子db和ob小鼠要重,且随着年龄的增长这种情况更加严重。本实验中,连续8周的SDE治疗对db/db和ob/ob小鼠的体重未见明显影响,模型组小鼠和治疗组小鼠体重增长基本持平。
2.2 SDE对小鼠胫骨密度、血清碱性磷酸酶(ALP)和血钙浓度的影响测得不同治疗组db/db小鼠的胫骨密度、血清ALP水平和血钙浓度数据见Tab 2、3。实验结束时模型组db/db小鼠胫骨骨密度明显低于同龄杂合子db小鼠,血清ALP水平明显高于db小鼠,血钙浓度明显低于db小鼠。提示db/db小鼠有明显的骨丢失。SDE高、低剂量治疗组小鼠的骨密度值分别为(1.3352±0.0413)g·cm-3和(1.3178 ± 0.0180)g·cm-3,虽然未达到db小鼠的水平,但和模型组比较骨密度已经有明显的增加(P<0.05),同时治疗组小鼠的血清ALP水平明显下降到了db小鼠的水平(P<0.01)。SDE治疗组小鼠的血钙浓度也有一定程度的上升,虽然和模型组比较这种差异并无统计学意义。本实验中SDE对db/db小鼠的治疗作用具有一定的量效关系,高剂量的药效略优于低剂量,但组间差异并无统计学意义。

Tab 1 Effects of SDE treatment on body weight in db/db and ob/ob mice

Tab 2 Effects of SDE on tibial bone density in db/db mice

Tab 3 Effects of SDE on serum ALP and serum Ca2+in db/db mice
不同治疗组ob/ob小鼠的胫骨密度、血清ALP水平和血钙浓度数据见Tab 4、5。实验结束时模型组ob/ob小鼠的骨密度略低于ob小鼠,但组间无统计学差异(P>0.05)。与此同时,ob/ob模型小鼠的血清ALP水平虽然和ob小鼠基本无差异,但其血钙浓度却明显低于ob小鼠。提示ob/ob模型小鼠虽未表现出明显的骨丢失,但骨代谢明显异常。本实验中,两个SDE剂量组ob/ob小鼠骨密度都较模型组小鼠大,血清ALP水平都较模型组有所下降。尤其是低剂量组小鼠,胫骨密度明显增加到了(1.3251 ± 0.0665)g·cm-3(P <0.05),血清 ALP水平则明显下降到(142.83±13.82)U·L-1(P<0.01)。SDE组小鼠的血钙浓度较模型组有轻微上升,但组间差异无统计学意义。
2.3 SDE对小鼠血脂的影响如Tab 6所示,实验结束时模型组db/db小鼠和同龄杂合子db小鼠相比,TC、TG和LDL-C水平偏高,高血脂症状明显。其HDL-C水平也明显偏高。这些结果提示db/db小鼠血脂代谢明显有异于同龄db小鼠。和模型组比较,两个 SDE剂量组小鼠的 TC、TG、LDL-C和HDL-C水平有一定程度的下降,但这种下降并无统计学意义(P>0.05)。
Tab 7所示为ob/ob小鼠血脂相关数据。和随行对照的ob小鼠相比,ob/ob模型小鼠具有超高水平的TC、TG和LDL-C,高血脂症状相当明显。其HDL-C水平也明显高于ob小鼠。和模型组相比,高剂量SDE治疗可明显降低ob/ob小鼠的血清TC、TG和LDL-C。SDE治疗组小鼠的HDL-C水平与模型组相比虽然略有下降,但仍维持在高水平,其下降并无统计学意义。SDE低剂量治疗组取得类似结果。
3 讨论
尽管有研究报道树豆的脂溶性成分具有降脂减肥的作用,但在本实验中未发现SDE抑制db/db小鼠和ob/ob小鼠体重的增长。模型组小鼠和SDE治疗组小鼠的体重增长趋势基本一致(Tab 1)。分析原因,可能是部位的制备方法不同导致成分存在差异或是选用的动物模型不同所致。
碱性磷酸酶(ALP)是广泛分布于人体各组织器官的一组同工酶,以骨、肝、肠黏膜中最为丰富,在排除怀孕、骨折愈合期以及儿童发育期等生理性原因后的血清ALP升高通常代表着严重的肝病如肝炎、肝癌,或骨骼疾病如骨瘤、骨质疏松、佝偻病、软骨病等[14]。

Tab 4 Effects of SDE on tibial bone density in ob/ob mice

Tab 5 Effects of SDE on serum ALP and serum Ca2+in ob/ob mice
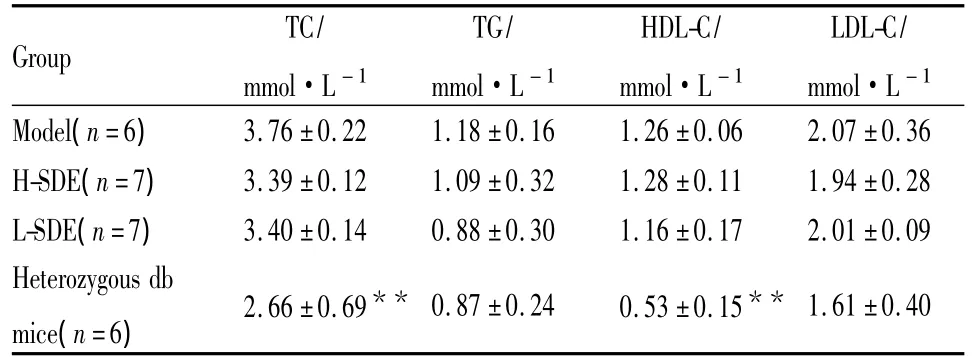
Tab 6 Effects of SDE on blood lipid level in db/db mice

Tab 7 Effects of SDE on blood lipid level in ob/ob mice
本实验中,肥胖和糖尿病性的db/db小鼠具有比其同龄db小鼠更高的血清ALP(P<0.01)和更低的血钙浓度(P<0.05),提示其存在骨吸收强或骨形成弱的问题,这和测得其骨密度明显降低(P<0.01)的结果是一致的,说明肥胖型糖尿病确实造成了db/db小鼠严重的骨流失(Tab 2、3),也说明选择2月龄的db/db小鼠作为糖尿病骨质疏松动物模型是合理的。我们发现,先天性肥胖的ob/ob小鼠比db/db小鼠具有更大的体重和更多的脂肪堆积,但无多饮多尿的糖尿病症状。在本实验中ob/ob小鼠表现为较同龄ob小鼠血钙浓度明显偏低(P<0.05)、血清ALP水平基本一致和骨密度一定程度偏低(Tab 4、5)。说明ob/ob小鼠也存在一定程度的骨流失。采用SDE对db/db和ob/ob小鼠进行治疗的结果显示,SDE可以明显增加db/db小鼠和ob/ob小鼠的骨密度,降低血清ALP水平,提高血钙浓度。我们的研究提示SDE对肥胖型糖尿病性骨质疏松或肥胖致骨质疏松的治疗有积极意义。
我们还发现,尽管ob和 db小鼠都来源于C57BL,但试验中db小鼠和ob小鼠相比,其骨密度明显偏高(P<0.01),血清ALP水平明显偏低(P<0.01),血钙浓度偏高。说明实验选用的ob小鼠虽然比同龄ob/ob小鼠骨密度高,但同样也存在一定程度的骨丢失,也因此其血清ALP水平处于高水平。由于本实验结束时ob和db小鼠的年龄分别为6个月和4个月,因此不排除年龄对ob小鼠的骨密度也存在一定影响。
在血脂代谢方面,通常情况下降低 TC、TG、LDL,提高HDL-C水平对诸多心血管疾病的产生具有预防的作用。HDL-C生理性的偏高对人体有益,而如果是病理性的,则提示机体出现了病变[15]。
肥胖小鼠由于长期处于高血脂状态,肝脏会出现一定程度的脂肪堆积导致脂肪肝,而糖尿病人由于长期的高血糖也会导致一定程度的肝损伤[16]。这可能是试验中db/db模型小鼠和ob/ob模型小鼠的HDL-C水平明显高于随机对照的db和ob小鼠的原因。所以我们认为降低db/db糖尿病小鼠和ob/ob肥胖小鼠的HDL-C水平也是脂代谢紊乱得到改善的表现之一。
从本实验的结果可以看出SDE能够明显降低db/db糖尿病小鼠、ob/ob肥胖小鼠的TC、TG、LDLC水平,同时一定程度地降低HDL-C水平(Tab 6、7),说明SDE在改善肥胖、高血糖小鼠的脂代谢方面有明确的疗效。
通过上述结果,我们可以确定:(1)SDE能够增加db/db糖尿病小鼠、ob/ob肥胖小鼠的骨密度,并能够降低db/db糖尿病小鼠、ob/ob肥胖小鼠的血清ALP水平;(2)SDE能够优化db/db糖尿病小鼠、ob/ob肥胖小鼠的血脂代谢。因此我们认为SDE对糖尿病性骨质疏松和肥胖致骨质疏松有一定的治疗效果,而且SDE能够改善血脂代谢,在一定程度上又能够避免糖尿病慢性并发症如微血管病变、脂肪肝的出现,防止肥胖—糖尿病—糖尿病慢性并发症—骨质疏松的疾病转变。SDE对糖尿病性以及肥胖骨质疏松的治疗作用和改善血脂代谢的机制我们将做进一步的研究。
[1] 李亚东.骨质疏松症[J].中国临床医生,2004,32(11):25-7.
[1] Li Y D.Osteoporosis[J].J Chine Physician,2004,32(11):25-7.
[2] 许碧莲,徐道华,陈文双,等.小檗碱对糖皮质激素性骨质疏松大鼠松质骨和皮质骨的影响[J].中国药理学通报,2011,27(7):965-70.
[2] Xu B L,Xu D H,Chen W S,et al.Effects of berberine on cancellous and cortical bone in rats induced by glucocorticoid[J].Chin Pharmacol Bull,2011,27(7):965 - 70.
[3] 魏雅楠,苗懿德.肥胖与骨质疏松[J].中国骨质疏松杂志,2007,11,13(11):814 - 7.
[3] Wei Y N,Miao Y D.Obesity and osteoporosis[J].Chin J Os-teop,2007,11,13(11):814 - 7.
[4] 吴海清,梁 玉.2型糖尿病与骨质疏松症的关系[J].天津医科大学学报,2011,17(2):286 - 9.
[4] Wu H Q,Liang Y.Relationship of type 2 diabetes and osteoporosis[J].J Tianjin Med Univ,2011,17(2):286 - 9.
[5] 何 競,雷 涛.肥胖对骨质疏松症影响的研究进展[J].同济大学学报,2010,31(6):116 - 8.
[5] He J,Lei T.Effect of obesity on osteoporosis research progress[J].J Tongji Univ(Med Sci),2010,31(6):116- 8.
[6] 宗绪晓.木豆[M].大连:大连出版社,2003:2-4.
[6] Zong X X.Cajanus cajan(L.)Millspaugh[M].Dalian:Dalian Press,2003:2 -4.
[7] 罗文正,刘 红,郑 稼,等.木豆叶总黄酮对股骨头坏死大鼠的作用及机制研究[J].中国药师,2009,12(7):857- 9.
[7] Luo W Z,Liu H,Zheng J,et al.Study on effect and mechanism of total flavonoids of pigeonpea leaf on necrosis of femoral head in rats[J].China Pharm,2009,12(7):857 -9.
[8] 骆庆峰,孙 兰,斯建勇,等.木豆叶芪类提取物对高脂模型小鼠血脂和肝脏胆固醇的降低作用[J].药学学报,2008,43(2):145-9.
[8] Luo Q F,Sun L,Si J Y,et al.Hypocholesterolemic effect of stilbene extract from Cajanus cajan L.on serum and hepatic lipid in diet-induced hyperlipidemic mice[J].Acta Pharm Sin,2008,43(2):145-9.
[9] 邱声祥,沈小玲.一种具有降血糖和减肥作用的菧类天然药物:中国 200810199012.6[P].2011-11-9.
[9] Qiu S X,Shen X L.A natural stilbene medicine on hypoglycemic and slimming effect:Chinese,200810199012.6[P].2011 -11 -9.
[10]林 励,谢 宁,程紫骅.木豆黄酮类成分的研究[J].中国药科大学学报,1999,30(1):21 -3.
[10] Lin L,Xie N,Cheng Z H.Flavonoids from Cajanus cajan L.[J].J China Pharm Univ,1999,30(1):21 -3.
[11]郑元元,杨 京,陈迪华,等.木豆叶芪类提取物对雌激素缺乏性大鼠骨质丢失的影响[J].药学学报,2007,42(5):562-5.
[11] Zheng Y Y,Yang J,Chen D H,et al.Effects of the stilbene extracts from Cajanus cajan L.on ovariectomy-induced bone loss in rats[J].Acta Pharm Sin ,2007,42(5):562 -5.
[12]夏 黎,钱玲梅,孔祥清,等.NYGGF4小鼠同源基因mRNA在遗传性ob/ob肥胖小鼠体内的表达[J].实用儿科临床杂志,2008,23(19):1488 - 90.
[12] Xia L,Qian L M,Kong X Q,et al.Expression of NYGGF4 mRNA murine homologous gene in inherited ob/ob mice[J].J Appli Clin Pediatr,2008,23(19):1488- 90.
[13]包 蕾,邹世恩,张绍芬.雌激素受体和过氧化物酶体增殖物激活受体γ介导大豆苷原对骨形成的量效作用[J].中西医结合学报,2011,9(2):165 - 72.
[13] Bao L,Zhou S E,Zhang S F.Dose-dependent effects of daidzein in regulating bone formation through estrogen receptors and peroxisome proliferator-activated receptor γ[J].J Chin Integr Med,2011,9(2):165- 72.
[14]肖 恩,孟 萍.骨质疏松骨代谢生化指标的研究进展[J].中国骨质疏松杂志,2008,14(13):212 -6.
[14] Xiao E,Meng P.The roles of bone metabolic biochemical markers in patients with osteoporosis:An update[J].Chin J Osteops,2008,14(13):212-6.
[15]李 莉,张 锦,周一军,等.高脂高糖食诱导的糖尿病小鼠肝脏清道夫受体B1的表达[J].中国病理生理杂志,2005,21(8):1584- 6.
[15] Li L,Zhang J,Zhou Y J,et al.Expression of scavenger receptor B1(SR-B1)in the liver of high fat and sugar diet-induced diabetic mice[J].Chin J Pathophysiol,2005,21(8):1584 - 6.
[16]张 莹,张代民,许会彬.糖尿病患者肝功能的变化及其意义[J].临床军医杂志,2005,33(2):151-2.
[16] Zhang Y,Zhang D M,Xu H B.Variation and significance of liver function in patients with diabetic mellitus[J].Clin J Med Officer,2005,33(2):151- 2.