SUR1和KCNJ11基因多态性与磺脲类药物继发性失效的相关性研究
邵 倩,班 博,施锦绣
(1.山东大学医学院,山东济南 250012;2.济宁医学院附属医院内分泌科,山东 济宁 272029;3.上海人类基因组研究中心,上海 201203)
磺脲类降糖药物(SU)是一种胰岛素促泌剂,SU进入人体后作用于胰岛β细胞膜上的ATP敏感性钾离子(KATP)通道[1],该通道是由磺脲类受体1(SUR1)及钾离子内向整流通道(Kir6.2)两种亚单位组成的异八聚体,通过将细胞膜电活动与细胞代谢联系起来,在胰岛素分泌中起着重要作用。长期应用SU,会出现磺脲类药物继发性失效(SFS)[2],具体机制目前尚不明确。本研究选择调节KATP通道的SUR1、KCNJ11基因,采用SNaPshot技术对SUR1基因外显子16-3c/t、KCNJ11基因E23K多态性进行基因分型,并探讨与山东地区T2DM患者SFS的相关性。
1 材料与方法
1.1 资料
1.1.1 受试对象 选取2010年11月~2012年7月在山东济宁医学院附属医院住院的汉族T2DM患者200例(除外:糖尿病急性应激状态,如急性心肌梗死、脑卒中、糖尿病酮症酸中毒、糖尿病非酮症高渗性昏迷等;明显的肝、肾功能异常者;近期使用过影响肝、肾功能药物者),诊断依据WHO1999年标准。SFS标准:曾经有至少3个月初始使用SU(或联合二甲双胍)的有效期,在适当饮食、运动基础上,SU加至每日最大剂量[如格列苯脲(优降糖)15 mg、格列吡嗪(美吡达)30 mg等],失效持续1~3个月,尚未使用 INS,空腹血糖 >10.0 mmol·L-1,糖化血红蛋白>9.0%。SU治疗有效组:糖尿病饮食控制加 SU(或联合二甲双胍)空腹血糖 <9.0 mmol·L-1,糖化血红蛋白<8.4%。按照上述标准纳入SFS组86例(男42例、女44例),SU有效组114例(男63例,女51例),两组胰岛细胞表面抗体(ICA)、胰岛素抗体(IAA)和谷氨酸脱羧酶抗体(GAD-Ab)均阴性。所有对象在知情同意的情况下,签署知情同意书。
1.1.2 临床及生化数据 收集T2DM患者相关临床资料,包括年龄、性别、糖尿病病程、饮食控制等,测量身高、体重,计算体质量指数(BMI),BMI=体重/身高2(kg/m2)。采用全自动生化分析仪(日本HITACHI公司)测定各组的空腹血糖(fasting plasma glucose,FPG)、餐后2h血糖(2 hours plasma glucose,2 hPG)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)等指标,采用单克隆抗体法检测糖化血红蛋白(glycated hemoglobin,HbA1c),采用电化学发光法检测空腹C肽(fasting C-peptide,F-C)及标准馒头餐后2 h-C 肽(2 hours C-peptide,2 h-C)。
1.2 方法
1.2.1 DNA提取 所有受检者取肘静脉血2ml,用EDTA-K2抗凝,采用盐析法抽提全血基因组DNA(QIAGEN,Germany),应用 NanoDrop-1000(Nanodrop,USA)检测其浓度和纯度后,稀释至30 μg·L-1。
1.2.2 SNaPshot技术检测 (1)多重 PCR扩增:PCR 反应体系为 10 μl,含基因组 DNA 1 μl(30 mg·L-1),0.3 μl的 dNTP(10 mmol·L-1),1 μl 10 ×PCR 缓冲液,0.52 μl MgCl2溶液(25 mmol·L-1),0.1 μl HotStar(Sigma 公司),6.68 μl无核酸酶的去离子水,各引物对的终浓度为 0.1 μmol·L-1。多重PCR反应条件:95℃预变性15 min,94℃变性40 s,63℃退火1 min,每个循环下降0.5℃ ,72℃延伸1.5 min,15个循环;94℃变性40 s,56 ℃退火40 s,72 ℃延伸1.5 min,25个循环;72 ℃ 8 min,4 ℃保存,PCR反应在9700热循环仪(ABI公司)中进行。(2)扩增产物的纯化:取1.0 μl扩增产物,加入2.0 U 虾碱性磷酸酶(SAP 酶,USB,USA),2.0 U ExoⅠ酶(Epicentre Biotechnologies,USA),去离子水 2.6 μl,反应总体系为 6 μl,混匀后 37 ℃保温 60 min,然后75℃灭活15 min,4℃保存。(3)延伸标记、纯化,反应体系为 5 μl,含纯化产物 2 μl,SNaP-shot Multiplex Mix(ABI公司)0.5 μl,引物1.2 μl,去离子水1.3 μl,每种引物在反应体系中的终浓度分别为0.2 μmol·L-1。PCR 循环条件为:96 ℃ 预变性10 s,96℃变性 10 s,50℃退火5 s,60℃ 延伸30s,25个循环,PCR反应在9700热循环仪(ABI公司)中进行。反应结束后进行第2次纯化,每反应产物中加入1U SAP酶,37℃保温60min,75℃灭活15 min,4℃保存。(4)每反应体系中加入Hi-Di甲酰胺(ABI公司)9.25 μl,内标 LIZ-120(ABI公司)0.1 μl,第 2 次纯化产物 1 μl,混匀离心后,95℃ 变性5 min,迅速冰冷4 min。于ABI公司3730遗传分析仪进行毛细管电泳,应用GeneMaperV 4.0软件进行数据分析。在所有样本中,每一个SNP的基因分型成功率>98%。在随机抽取的样本中所有的重复分型的一致率均为100%(Fig 1)。
1.3 统计学分析以Hardy-Weinberg平衡法检验研究样本的群体代表性,用χ2检验比较SFS组与有效组之间基因型及等位基因频率分布。检验数据正态分布情况,正态分布计量资料以±s表示,非正态分布的资料采用自然对数转换为正态后进行分析,结果以中位数(25%位数,75%位数)表示,两组临床资料分析采用独立样本t或t'检验。多因素分析用Logistic回归分析。上述数据处理运用SPSS 13.0统计软件。
2 结果
2.1 SUR1 16-3c/t基因型和等位基因分布频率SUR1基因外显子16-3c/t基因型频率在SFS组及有效组均符合Hardy-Weinberg遗传平衡定律,SUR1基因外显子16-3c/t t/t、c/t和c/c基因型频率在SFS组分别为53.5%、34.9%和11.6% ,在有效组分别为 28.9%、55.3%和 15.8%,两组分布差异有统计学意义(P<0.01)。SFS组“t”等位基因分布频率明显高于有效组(P<0.01),见Tab 1。
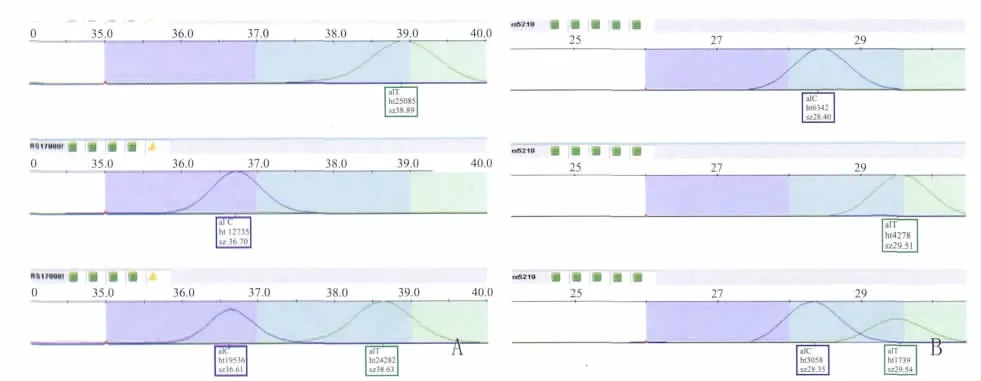
Fig 1 Genotyped result of SNaPshot
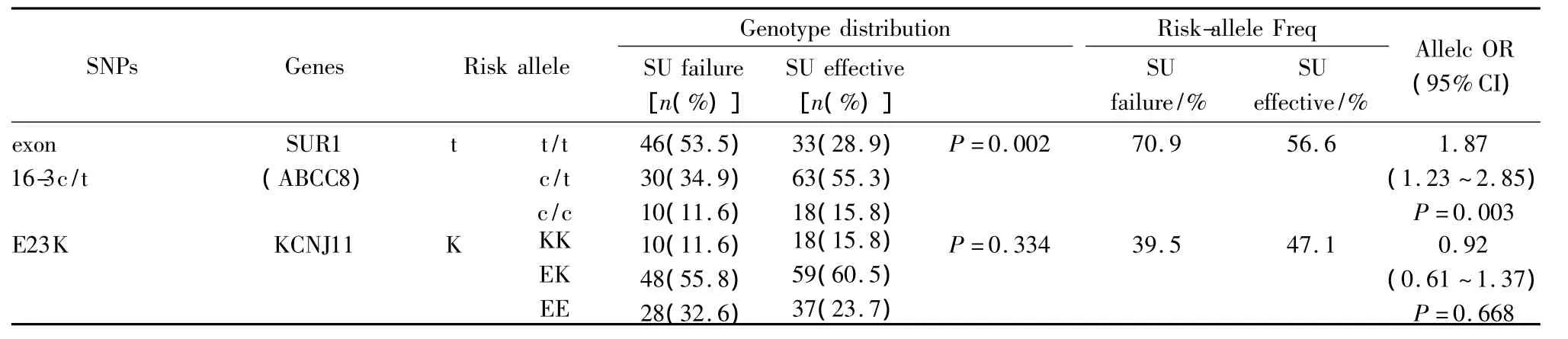
Tab 1 Distribution and frequency of SUR1,KCNJ11 genotypes and alleles between patients with secondary failure and without secondary failure
2.2 KCNJ11 E23K基因型和等位基因分布频率KCNJ11基因多态性位点E23K基因型频率在SFS组及有效组均符合Hardy-Weinberg遗传平衡定律,SFS组 E23K KK、EK和 EE基因型频率分别为11.6%、55.8% 和 32.6%,在有效组中分别为15.8%、60.5% 和 23.7%,两组分布差异无统计学意义(P>0.05)。见Tab 1。
2.3 研究对象的临床特点SFS组糖尿病病程、HbA1c、FPG、2 hPG 明显高于有效组(P < 0.01),2 h-C肽明显低于有效组(P<0.01),见Tab 2。
Tab 2 Analysis of clinical data in the 2 groups(±s)
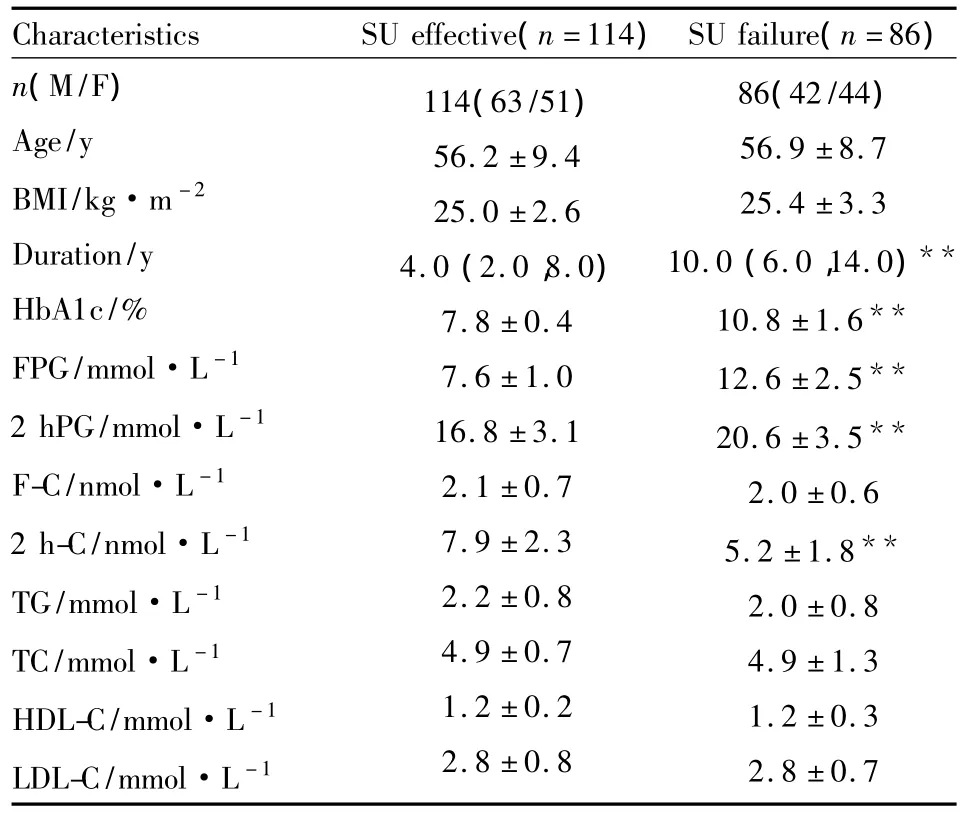
Tab 2 Analysis of clinical data in the 2 groups(±s)
**P <0.01 vs SU effective
Characteristics SU effective(n=114)SU failure(n=86)n(M/F)Age/y BMI/kg·m-2 Duration/y HbA1c/%FPG/mmol·L-1 2 hPG/mmol·L-1 F-C/nmol·L-1 2 h-C/nmol·L-1 TG/mmol·L-1 TC/mmol·L-1 HDL-C/mmol·L-1 LDL-C/mmol·L-1 86(42/44)56.9 ±8.7 25.4 ±3.3 10.0(6.0,14.0)**10.8 ±1.6**12.6 ±2.5**20.6 ±3.5**2.0 ±0.6 5.2 ±1.8**2.0 ±0.8 4.9 ±1.3 1.2 ±0.3 2.8 ±0.7 114(63/51)56.2 ±9.4 25.0 ±2.6 4.0(2.0,8.0)7.8 ±0.4 7.6 ±1.0 16.8 ±3.1 2.1 ±0.7 7.9 ±2.3 2.2 ±0.8 4.9 ±0.7 1.2 ±0.2 2.8 ±0.8
2.4 SUR1基因外显子16-3c/t各基因型的临床及实验室资料比较SUR1基因外显子16-3c/t t/t基因型SFS发生率、FPG、HbA1c、2hPG明显高于 c/t+c/c型组(P <0.01),而 BMI、2h-C 肽明显低于c/t+t/t型组(P <0.01),见 Tab 3。
2.5 多因素Logistic回归分析以SFS是否发生为因变量,校正性别、年龄、BMI、F-C 肽、TG、TC、HDL-C、LDL-C后,发现SUR1基因外显子16-3c/t的t/t基因型是SFS的独立危险因素(OR=2.82,95%CI=1.57 ~5.07,P <0.01)。在回归中分别引入2 hPG(B)、2 h-C肽(C)、糖尿病病程(D)变量后,t/t基因型与SFS的相关性逐渐下降(均P<0.05),在回归分析中引入糖尿病病程>5年(E)变量后,SUR1基因外显子16-3c/t的t/t基因型与SFS的相关性明显增加(OR=3.90,95%CI=1.27 ~11.98,P <0.05),见 Tab 4。
Tab 3 Clinical data in different genotypes of SUR1 gene exon 16-3c/t(±s)

Tab 3 Clinical data in different genotypes of SUR1 gene exon 16-3c/t(±s)
**P <0.01 vs c/c+c/t group
Characteristics c/c+c/t t/t n(M/F)Age/y BMI/kg·m-2 Duration/y SFS/n(%)HbA1c/%FPG/mmol·L-1 2 hPG/mmol·L-1 F-C/nmol·L-1 2 h-C/nmol·L-1 121(64/57)57.1 ±9.9 25.7 ±3.0 6.0(2.0,10.0)40(33.1)8.8 ±1.4 9.2 ±2.4 17.8 ±3.7 2.1 ±0.7 7.2 ±2.6 79(41/38)55.7 ±7.6 24.4 ±2.6**7.0(3.0,14.0)46(58.2)**9.7 ±2.1**10.5 ±3.7**19.3 ±3.8**2.0 ±0.7 6.1 ±2.2**
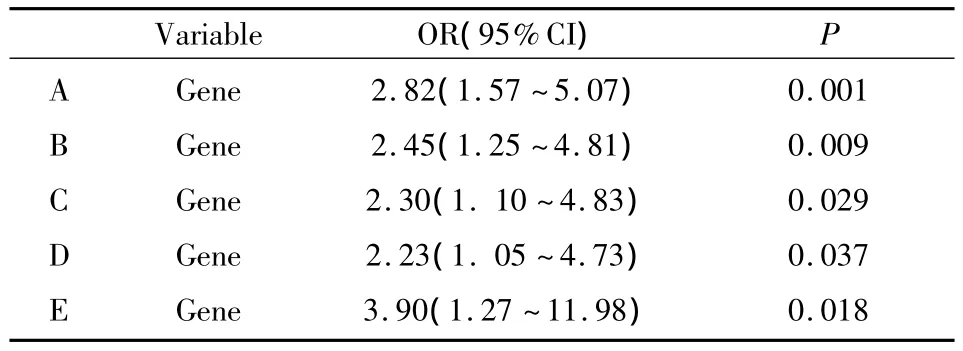
Tab 4 Logistic regression analysis of SFS risk factors
3 讨论
SU作为一种胰岛素促泌剂,通过与胰岛β细胞膜上的磺脲类药物受体(SUR)结合,关闭细胞膜上KATP通道,使钾离子外流减少,细胞膜去极化,导致电压门控性钙通道开放,钙离子内流,从而促进胰岛素的释放。近年来研究表明,KCNJ11、TCF7L2和IRS1等基因与 SFS有关[3-6],但 SUR1基因与 SFS的关系报道较少。KCNJ11基因编码KATP通道的内向整流K+通道蛋白(Kir6.2),SUR1基因编码KATP通道的调节亚单位SUR1,二者均在调节胰岛素的分泌中起着重要作用。
在本研究中,未发现KCNJ11基因E23K多态性与SFS相关(P>0.05),而在 UKPDS的研究中,也未发现E23K多态性与SU降糖疗效相关[7],提示在中国人群中该多态性可能与SU降糖疗效无关。但是,本研究发现SUR1基因外显子16-3c/t多态性与SFS发生相关(P <0.05),且“t”危险等位基因分布频率在 SFS组明显高于有效组(OR=1.87,P<0.05),该结果与袁莉等[8]的研究结果一致,而与Zychma等[9]的报道不同,Zychma等分析阴性结果的主要原因是SFS患者中包含了一部分成人隐匿性自身免疫性糖尿病(LADA),而非真正的T2DM。此外,外显子 16-3c/t t/t基因型组的 FPG、2 hPG、HbA1c均明显高于其他基因型组,而2 h-C肽明显低于其他基因型组(P<0.01),提示t/t基因型携带者胰岛素分泌能力可能受损。多因素Logistic回归分析显示t/t基因型是SFS发生的独立危险因素(OR=2.82,P <0.01),当分别引入 2 hPG、2 h-C 肽后及糖尿病病程后,t/t基因型与SFS的相关性下降(OR 值分别为2.45、2.30 及 2.23,均 P <0.05),考虑到较长的糖尿病病程可能会影响SU疗效,对病程>5年的患者进行逐步Logistic回归分析,发现t/t基因型仍是发生SFS的独立危险因素(OR=3.90,P<0.05),这表明遗传因素是SU降糖反应个体差异的最主要原因,外显子16-3c/t的t/t基因型携带者可能更易于发生SFS。推测可能机制:(1)由于该突变位于外显子16剪切部位上游,在转录过程中,可能影响了正常的剪接,使SUR1功能受到影响,从而影响胰岛素的释放。(2)可能与ABCC8基因上发生变异的其他功能性位点存在强烈的连锁不平衡[10],影响了胰岛素的分泌功能。
综上所述,SUR1基因外显子16-3c/t多态性可能与SFS相关。随着SNPs的深入研究及药物基因组学的发展,SUR1基因的多态性将极大地促进个体化用药和新药的研究。如何对患者针对性的用药,避免或减少SFS风险的发生以及对新药的研发将成为我们今后的研究方向。
[1] Bryan J,Crane A,Vila-Carriles W H,et al.Insulin secretagogues,sulfonylurea receptors and K(ATP)channels[J].Curr Pharm Des,2005,11(21):2699-716.
[2] 杨文英.磺脲类药物应用专家共识[J].中华内分泌代谢杂志,2004,20(4):附录 4b-(1-4).
[2] Yang W Y.Expert consensus of the application of sulfonylureas[J].Chin J Endocrinol Metab,2004,20(4):Appendix 4b-(1-4).
[3] Holstein A,Hahn M,Stumvoll M,et al.The E23K variant of KCNJ11 and the risk for severe sulfonylurea-induced hypoglycemia in patients with type 2 diabetes[J].Horm Metab Res,2009,41(5):387-90.
[4] Sesti G,Laratta E,Cardellini M,et al.The E23K variant of KCNJ11 encoding the pancreatic beta-cell adenosine 5'-triphosphatesensitive potassium channel subunit Kir6.2 is associated with an increased risk of secondary failure to sulfonylurea in patients with type 2 diabetes[J].J Clin Endocrinol Metab,2006,91(6):2334-9.
[5] Holstein A,Hahn M,Körner A,et al.TCF7L2 and therapeutic response to sulfonylureas in patients with type 2 diabetes[J].BMC Med Genet,2011,24(2):1-5.
[6] Sesti G,Marini M A,Cardellini M,et al.The Arg972 variant in insulin receptor substrate-1 is associated with an increased risk of secondary failure to sulfonylurea in patients with type 2 diabetes[J].Diabetes Care,2004,27(6):1394-8.
[7] Gloyn A L,Hashim Y,Ashcroft S J,et al.Association studies of variants in promoter and coding regions of beta-cell ATP-sensitive K-channel genes SUR1 and Kir6.2 with Type 2 diabetes mellitus(UKPDS 53)[J].Diabet Med,2001,18(3):206-12.
[8] 袁 莉,郑 娟,陈璐璐,等.SUR1基因多态性与磺脲类药物疗效的相关性[J].华中科技大学学报(自然科学版),2004,32(2):89-90.
[8] Yuan L,Zheng J,Chen L L,et al.Relationship between SUR1 gene polymorphism and therapeutic responsiveness of sulfonylurea drug in type 2 diabetes[J].J Huazhong Univ Sci Tech(Nat Sci Edit),2004,32(2):89-90.
[9] Zychma M J,Gumprecht J,Strojek K,et al.Sulfonylurea receptor gene 16-3 polymorphism-association with sulfonylurea or insulin treatment in type 2 diabetic subjects[J].Med Sci Monit,2002,8(7):512-5.
[10] Yokoi N,Kanamori M,Horikawa Y,et al.Association studies of variants in the genes involved in pancreatic beta-cell function in type 2 diabetes in Japanese subjects[J].Diabetes,2006,55(8):2379-86.