在线合成心肌灌注显像剂: 碳-11三苯甲基磷
孙慧萍 周卫华 张锦明 张晓军 刘 健 田嘉禾
1 (中国人民武装警察总医院 北京 100039)
2 (中国人民解放军总医院 北京 100853)
在线合成心肌灌注显像剂: 碳-11三苯甲基磷
孙慧萍1周卫华1张锦明2张晓军2刘 健2田嘉禾2
1 (中国人民武装警察总医院 北京 100039)
2 (中国人民解放军总医院 北京 100853)
99mTc-MIBI是常用的心肌灌注显像剂,肝摄取高,临床应用有一定的影响。11C-三苯甲基磷(11C-TPMP)为脂溶性正一价阳离子,用于心肌显像能得到更好的分辨率。以11CH3-Triflate为甲基化试剂,采用LOOP法在线合成了11C-TPMP,研究了11C-TPMP在正常小鼠的分布,正常大鼠行Micro PET显像,并与4位18F-苯基三苯基磷(18F-FTPP)比较。结果显示,LOOP法合成11C-TPMP效率大于90%(校正),放化纯度大于98%。正常小鼠心肌有高的摄取,注射后5 min和60 min,心肌摄取分别为(71.9±19.9)%ID·g–1和(12.87±0.81)%ID·g–1,肝摄取低,注射后5 min和60 min心肝摄取比分别为11.57 和 3.2。正常大鼠micro PET显像显示,从20 min到60 min,心肌显像清晰,肝未显像。表明LOOP法可高效合成11C-TPMP,11C-TPMP是一个很有希望的心肌灌注显像剂。
心肌灌注显像,PET,11C-TPMP,LOOP法合成
脂溶性的阳离子能够通过被动扩散穿过细胞膜进入细胞,再利用跨膜电位富集于线粒体中从而在心肌摄取。99mTc-MIBI和99mTc-tetrofosmin是最常用的亲脂性阳离子,可迅速进入细胞和线粒体结合,用于心肌灌注显像及肿瘤显像剂[1,2]。但99mTc-MIBI在肺和肝内有较高的摄取,影响了部分临床的诊断。近年来报道了几种新型PET心肌灌注显像剂[3],如4位-18F-苄基三苯基磷(18F-FBnTP)和4位-18F-苯基三苯基磷(18F-FTPP)等均为亲脂性阳离子化合物,但这些化合物的合成效率低。11C-Triphenylmethylphosphonium(11C-三苯甲基磷,11C-TPMP)是一个三苯磷的衍生物,文献[4,5]证实了11C-TPMP作为心肌和肿瘤显像剂的价值,但进一步的报道很少,原因之一是采用碘代甲烷作甲基化试剂标记三苯磷效率低[4],产量不高,影响了进一步的研究。本研究采用高活性的Triflate-CH3作甲基化试剂,并用在线LOOP法高效合成了11C-TPMP,为临床研究奠定了基础。
1 材料与方法
1.1设备与试剂
HM-20回旋加速器(日本住友重机械株式会社),PET 自动化碳-11多功能合成模块:内置液相碘代甲烷、Triflate在线转换、甲基化和HPLC纯化(配紫外和放射性检测器)及固相萃取[派特(北京)科技公司];反应LOOP环,自制(φ2 mm的聚四氟乙烯管,长度为2 m,绕成φ50 mm的圆环,两端接接头);分析HPLC仪,配Biocan Flow Count放射性检测器和2487紫外检测器(美国Waters公司);eXPlore Vista小动物PET/CT成像系统(美国GE公司)。
Sep-Pak C-18、Sep-Pak CM柱(美国Waters公司);1 mol/L的氢化锂铝四氢呋喃溶液(德国,ABX公司);57%HI(AR,美国Acros公司);乙醇(USP级,美国Milennium公司);丙酮(AR,美国Sigma公司);三苯基磷(AR,上海阿拉丁试剂有限公司);甲基三苯基磷(AR,江苏常熟华益化工有限公司)。
1.211C-碘代甲烷的合成及在线转换11C-CH3-Triflate[6,7]
对文献[6]方法作部分改动,HM-20加速器质子轰击含0.5%氧的氮气,经14N(p,α)11C核反应产生11C,在靶内与氧气反应生成11CO2;将文献[6]中直接将11CO2传到自动化碳-11多功能合成模块反应管修改为:传到浸于液氮内的LOOP环(图1中V7和V8之间);11CO2被转化成干冰。将Loop环脱离液氮后经空气加热,40 mL/min氮气将LOOP环内
11CO2输入到含0.2 mL 1 mol/L的氢化锂铝四氢呋喃溶液中,11CO2与氢化锂铝生成复合盐,通入氮气并加热除THF。加入0.2 mL 57%氢碘酸,复合盐水解并与氢碘酸反应生成碳-11碘代甲烷,加热并用氮气将之蒸出(图1中A部分,该部分为合成碘代甲烷)。蒸出的碳-11碘代甲烷气体通过不锈钢管(10 mm×70 mm,内装有0.4 g三氟甲基磺酰基银(Triflate-Ag)与0.65 g石墨的混合物),预先加热到200ºC,在不锈钢管内碳-11碘代甲烷被转换成11C-CH3-Triflate (图1中的B部分),被氮气载带进入LOOP环。
1.3 LOOP法全自动化合成11C-TPMP[4]
将10 mg的三苯磷溶于200 μL的乙腈中,加入10 μL 5 mol/L NaOH,将混和液装载于反应LOOP环中,LOOP环装于V21和V22之间。将上述合成的11C-CH3-Triflate气体通入反应LOOP环(图1E部分,该部分为在线反应)。11C-CH3-Triflate通过LOOP环,与环内的前体三苯基磷反应生成11C-TPMP。待放射性传输完毕,将V24内的10 mL乙醇加载到LOOP中,已生成的正一价11C-TPMP吸附在阳离子交换柱CM柱上,用V25中的10 mL纯水清洗CM柱,最后用6 mL生理盐水将产品从柱上洗脱(图1中E部分)。图2为合成11C-TPMP的线路图。
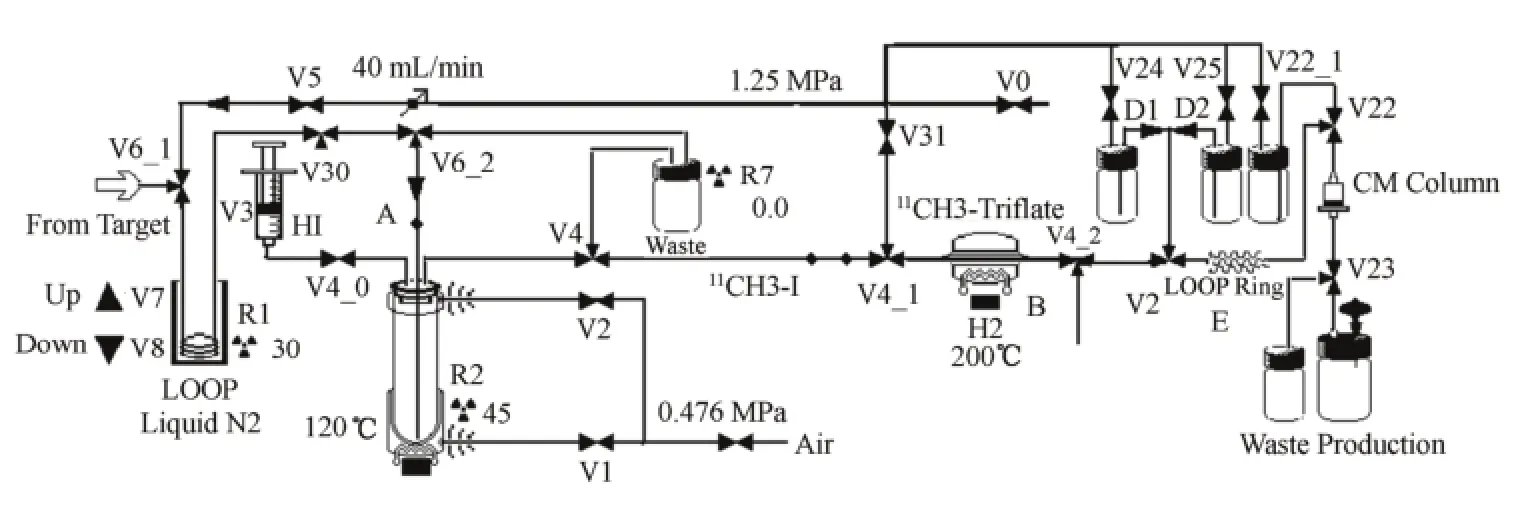
图1 全自动合成11C-TPMP的示意图Fig.1 The scheme of auto-synthesis for 11C-TPMP.
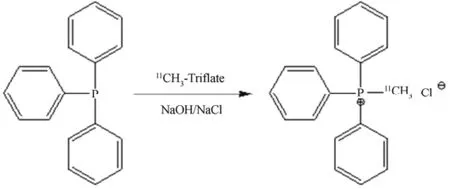
图2 合成11C-TPMP的线路图Fig.2 The scheme of synthesis of 11C-TPMP.
1.4放射化学纯度的测量
HPLC方法测量条件:Waters的HPLC,2487紫外分光光度计,检测波长:254 nm;515双泵,分析柱为反相Nova-Park C-18柱(3.9 mm×150 mm),Bio-Scan的Flow-Count放射性检测器。流动相为25%的乙醇,流速为1 mL/min,未反应的11C-CH3-Triflate的Rt=2 min,11C-TPMP的Rt=5.2 min。
1.511C-TPMP在正常小鼠体内的分布
取(20±2) g的NH雄性小鼠(中国人民解放军总医院动物中心提供)20只,编号后计算机随机分成4组,尾静脉注射11C-TPMP 3.7 MBq/0.1 mL,于注射后 5、15、30、60 min分别处死小鼠,取血、心、肝等主要器官,称重并在井型计数器上计数,计算各器官的%ID·g–1。
1.611C-TPMP的Micro PET/CT显像
取正常的SD雄性大鼠(中国人民解放军军事医学科学院实验动物中心提供),尾静脉注射11C-TPMP 37 MBq/0.2 mL,异氟烷麻醉后置于eXplore Vista Micro PET/CT上扫描。扫描时间分别为注射后20、30、45、60 min。间隔2天后,采18F标记的4-18F-苯基三苯基磷(18F-FTPP),剂量同上,18F-FTPP注射后30 min 在Micro PET/CT显像静态扫描。
2 结果与讨论
2.1 LOOP法全自动化合成11C-TPMP
文献[4]采用碘代甲烷作甲基化试剂,与三苯基磷常温下反应,合成效率仅为9%–13% (从11C-CO2开始,校正效率)。本研究采用高活性的11CH3-Triflate, 在碱性条件下,以LOOP环方式反应,合成效率高达90%(从11CH3-Triflate计,校正效率;n>5),即使从11C-CO2开始计,合成效率也达到50%以上(校正效率)。原因有二个,一是采用高活性的11CH3-Triflate,可提高反应效率;另一方面采用合成11C-胆碱的方法,即LOOP法在线反应和阳离子柱CM柱纯化法,LOOP法在线反应使放射性气体增加了与前体接触的面积,提高了反应效率[8],而阳离子柱纯化法缩短了合成11C-TPMP的时间,纯化和淋洗过程仅6 min。从11CO2开始到合成11C-TPMP结束,全过程仅16 min。HM-20加速器以40 μA质子轰击10 min,能合成8.9 GBq的11C-TPMP,比活度为50 GBq/μmoL,满足临床使用的需求。
2.2放射化学纯度的测量
11C-TPMP为正一价阳离子,因此,预实验中采用分析11C-胆碱的阳离子柱(Waters IC-Pak Cation MD,3.9 mm×150 mm)分析11C-TPMP的放化纯度,结果发现放射性全部吸附在C-18预柱上;去除C-18预柱后,5 mmol/L HCl的流动相仍不能将放射性从阳离子柱上淋洗下来。因此实验改用反相Nova-Park C-18柱,选择20%–35%的乙醇作流动相,最终确定25%乙醇作流动相,流速为1 mL/min,未反应的水溶性的11C-CH3-Triflate,其Rt=2 min,第二个放射性峰的Rt=5.2 min,经与标准品对照证实为11C-TPMP(图3)。图3的分析HPLC放射性结果表明,11C-TPMP的放射化学纯度大于98%。
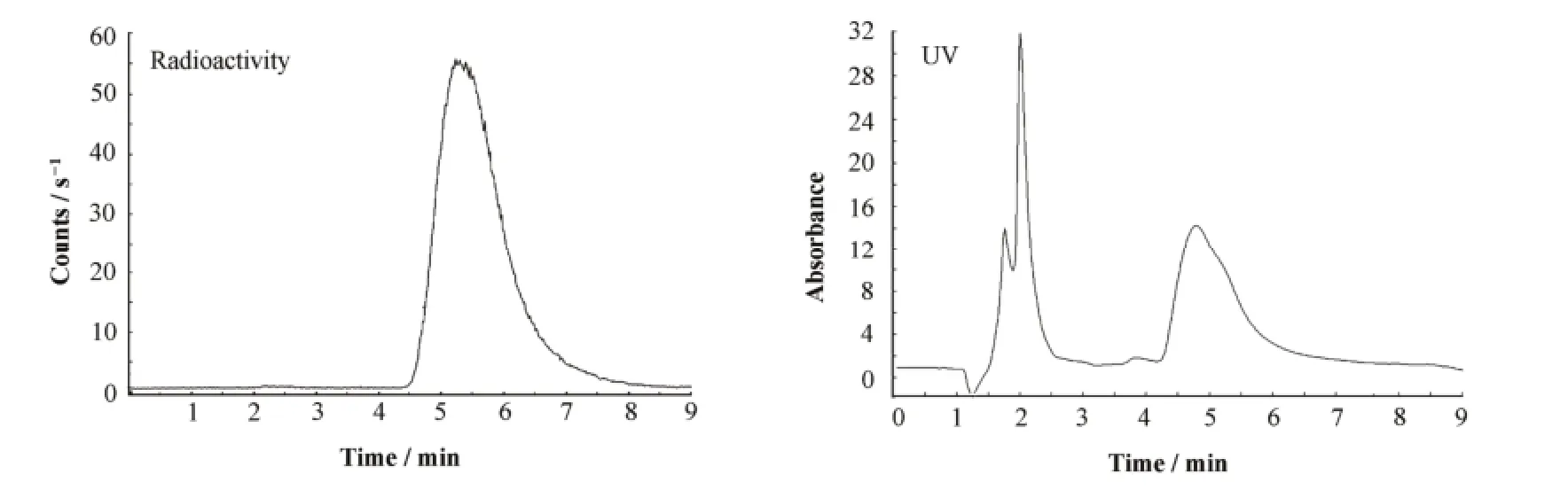
图3 产品11C-TPMP的分析HPLC放射性和紫外曲线Fig.3 The analysis HPLC UV and radio-chromatogram of 11C-TPMP.
2.311C-TPMP在正常小鼠体内的分布
经尾静脉注射11C-TPMP后,血液清除很快,至5 min时仅为(0.31±0.03)%ID·g–1,但血液中一直保持该值,到60 min时仍为(0.33±0.06)%ID·g–1;正常小鼠心肌有高的摄取,注射后5 min和60 min,心肌摄取分别为(71.9±19.9)%ID·g–1和(12.87±0.81) %ID·g–1。肝摄取低,5 min仅为(6.22 ±0.85)%ID·g–1,注射后5 min和60 min心肝比分别为11.57 and 3.2。肾内放射性初时很高,但很快下降,可能该药是经泌尿系统排泄,11C-TPMP在正常小鼠体内的分布结果如图4所示。
2.411C-TPMP的Micro PET/CT显像
注射11C-TPMP后20、30、45、60 min分别行Micro PET显像,结果发现:心肌显像在三个时间段无明显区别,均可见正常心肌均匀摄取放射性;肝脏和肺未见显影(图5中的A冠状面),考虑碳-11的半衰期和放射性药物在体内的清除,11C-TPMP最佳显像时间为注射药物后30 min。
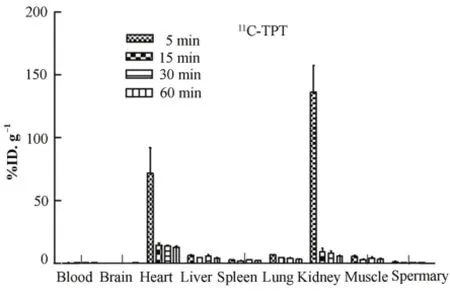
图4 11C-TPMP在正常小鼠体内的生物学分布Fig.4 The biodistribution of 11C-TPMP in normal mice.
按文献[3]方法合成4-18F-苯基三苯基磷(18F-FTPP),行Micro PET显像,对比11C-TPMP与18F-FTPP的区别。图5显示,两者心肌摄取无明显区别,心肌高摄取18F-FTPP(图5中的B),肝内放射性不高。两者的化学结构相似,生物学性质也相似,Micro PET表明两者在正常鼠上的心肌摄取也相似。18F-FTPP的半衰期较碳-11长,18F-FTPP 适于商业化供应使用,但合成效率仅为2%–5%(校正)[3]。碳-11标记的放射性药物由于标记时仅为同位素的替代,体内的生物学性质与底物一致,更适于研究药物的分布及疾病的进程[9,10],尽管碳-11半衰期短,但只要提高合成效率和合成产量,11CTPMP更适于有加速器的单位使用,需进一步研究11C-TMPM在心肌梗塞模型鼠上分布及临床上的应用价值。
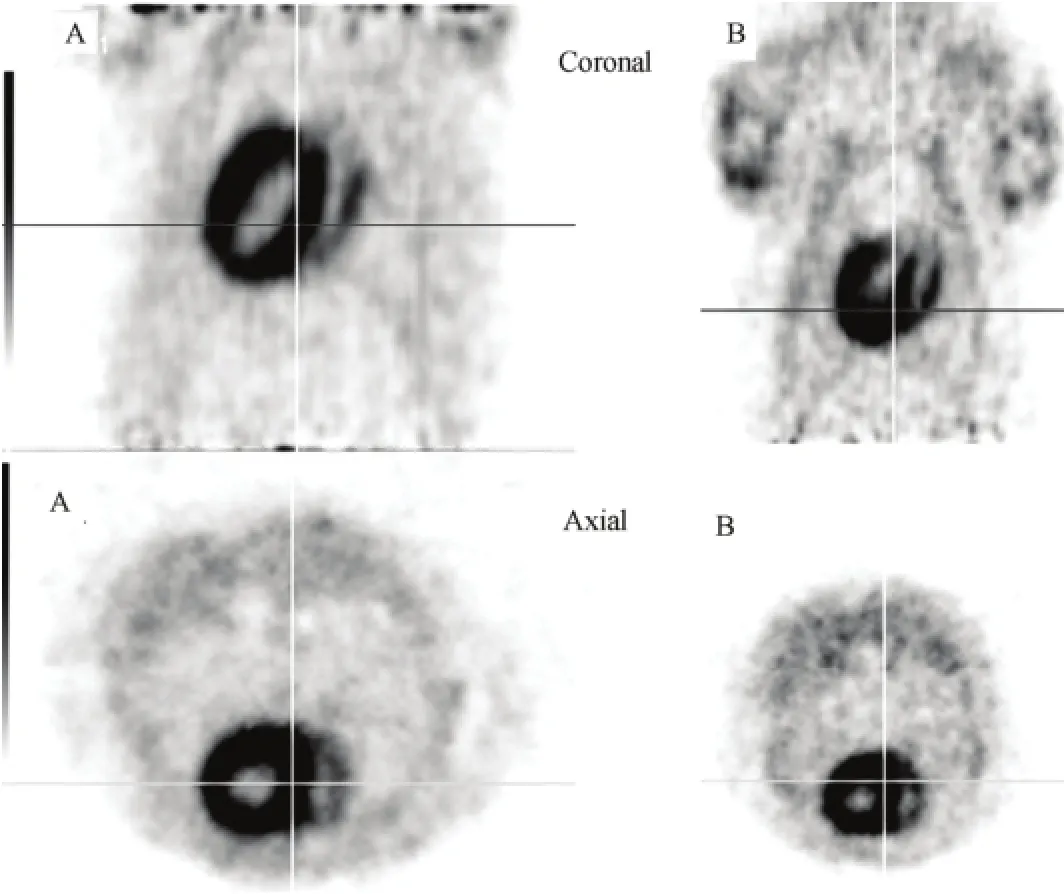
图5 正常大鼠的Micro PET心肌灌注30 min的冠状(上)和矢状(下)显像 A: 11C-TPMP, B: 18F-FTPPFig.5 Micro PET myocardial perfusion imaging at 30 min with normal rats. A: 11C-TPMP, B: 18F-FTPP
3 结语
本研究以高活性的11C-CH3-Triflate作为甲基化试剂,采用LOOP法在线合成了心肌灌注显像剂—11C-TPMP。采用阳离子柱CM柱纯化,合成耗时为16 min,合成效率高达90%(校正效率,n>5),放化纯度大于98%,比活度为50 GBq/μmol;单次合成最终产品活度8.9 GBq。经Micro PET/CT显像证实,正常心肌摄取高,而肝摄取低,60 min心肝比达到3.2 ;同时与18F-FTPP无明显区别。本研究为临床提供了一种可大剂量合成11C-TPMP的方法,为进一步证实11C-TPMP临床价值奠定了基础。
1 Chernoff D M, Strichartz G R, Piwnica-Worms D. Membrane potential determination in large unilamellar vesicles with hexakis(2-methoxyisobutylisonitrile) technetium(I)[J]. Biochimica et Biophysica Acta,1993,1147(10): 262–266
2 Chiu M L, Kronauge J F, Piwnica-Worms D. Effect of mitochondrial and plasma membrane potentials on accumulation of hexakis (2-methoxyisobutylisonitrile) technetium(I) in cultured mouse fibroblasts[J]. Journal Nuclear Medicine, 1990,31(10): 1646–1653
3 Shoup T M, Elmaleh D R, Brownell A L, et al. Evaluation of (4-[18F]Fluorophenyl) triphenylphosphonium Ion. A potential myocardial blood flow agent for PET[J]. Molecular Imaging Biology, 2011,13: 511–517
4 Fukuda H, Syrota A, Charbonneau P, et al. Use of11C-triphenylmethylphosphonium for the evaluation of membrane potential in the heart by positron-emission tomography[J]. European Journal Nuclear Medicine, 1986,11(12): 478–483
5 Madar I, Anderson J H, Szabo Z, et al. Enhanced uptake of [11C]TPMP in canine brain tumor: a PET study[J]. Journal Nuclear Medicine, 1999,40(7): 1180–1185
6 张锦明, 田嘉禾, 王武尚, 等. 单管法自动化合成碳-11-碘代甲烷[J]. 中华核医学杂志, 2004,24(4): 243–244
ZHANG Jinming, TIAN Jiahe, WANG Wushang, et al. An automated synthesis of11C-methyl iodine with single vessel[J]. Chinese Journal Nuclear Medicine, 2004,24(4): 243–244
7 张锦明, 田嘉禾, 王武尚, 等. 在线制备11C-Triflate-CH3[J]. 同位素, 2006,19(2): 124–128 ZHANG Jinming, TIAN Jiahe, WANG Wushang, et al. On-line production of11C-CH3-Triflate[J]. Isotopes, 2006,19(2): 124–128
8 Studenov A R, Jivan S, Adam M J, et al. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals[J]. Applied Radiation Isotopes, 2004,61(6): 1195–1201
9 梁祥, 王红亮, 黄婷婷, 等. (S-[11C]甲基)-D-半胱氨酸的自动合成与动物实验[J]. 核技术, 2012,35(6): 452–456
LIANG Xiang, WANG Hongliang, HUANG Tingting, et al. Automated radiosynthesis and preliminary animal experiment of (S-[11C]-methyl)-D-cysteine[J]. Nuclear Techniques, 2012,35(6): 452–456
10 张锦明, 朱虹, 张晓军, 等.11C-Gefinitib自动化合成及Micro PET显像[J]. 核技术, 2012,35(9): 709–714
ZHANG Jinming, ZHU Hong, ZHANG Xiaojun, et al. Auto-synthesis of11C-gefitinib and Micro PET/CT imaging for A549[J]. Nuclear Techniques, 2012,35(9): 709–714
CLCR445.6, R817.4
In-LOOP synthesis of11C-Triphenylmethylphosphonium for myocardial perfusion imaging
SUN Huiping1ZHOU Weihua1ZHANG Jinmin2ZHANG Xiaojun2LIU Jian2TIAN Jiahe2
1 (General Hospital of Chinese Peoples Armed Police Forces,Beijing 100039,China)
2 (The PLA General Hospital,Beijing 100853,China)
Background:99mTc-MIBI was used as myocardial perfusion SPECT. However, the high accumulation of tracers in the liver and lung may hinder the detection of flow abnormalities in myocardium.Purpose:11C-Triphenylmethylphosphonium (11C-TPMP) was a lipophilic cation, has been investigated as a positron emission tomography (PET) agent for myocardial and tumor imaging to provide a better temporal and spatial resolution than SPECT.Methods:11C-TPMP was prepared by reacting [11C]methyl trifalte with In-LOOP method. Biodistribution studies in mouse were performed. And micro PET was performed with rat, and compared with 4-[18F]fluorophenyl triphenylphosphonium ion(18F-FTPP).Results:The results showed that the11C-TPMP labeling yield was over 90%, the radiochemical purity was over 98%. The biodistribution showed high accumulation of radioactivity in the heart (71.9±19.9)%ID·g–1at 5 min and (12.87±0.81)%ID·g–1at 60 min post injection. The heart/liver ratios were 11.57 and 3.2 at 5 min, 60 min respectively. Micro PET scans showed distinct accumulation of11C-TPMP in the myocardium from 20 min to 60 min. The liver had very lower accumulation of radioactivity.Conclusions:11C-TPMP was a promise PET perfusion agent for myocardial. It would be useful in clinical with In-LOOP synthesis.
Myocardial perfusion agents, PET,11C-TPMP, In-LOOP synthesis
R445.6, R817.4
10.11889/j.0253-3219.2013.hjs.36.020303
北京市自然科学基金(7122162)资助
孙慧萍,女,1967年出生,1993年毕业于第二军医大学,副主任药师,专业:临床药学
张锦明,zhangjm301@yahoo.com.cn
2012-11-22,
2012-12-19