扇贝多肽脂质体制备工艺的优化与表征
郑 媛,纪晓峰,郑兰红,盛 军,王海英,孙 谧
(中国水产科学院黄海水产研究所海洋酶与酶工程实验室,山东青岛266071)
以水产食品鱼类、贝类为原料,利用其下脚料提取活性生物肽,可提升食品加工过程中废弃物的再利用,产生更高的价值,满足更多行业的需求,成为近年来人们研究的热点[1-3]。扇贝多肽(polypeptide from Chlamys farreri,PCF)是来源于栉孔扇贝的一种海洋抗氧化多肽(专利ZL200510000032.2),它分子量小(M r=794u),易溶于水,毒性低。已有研究表明,PCF具有清除羟自由基和超氧阴离子的能力,可以保护紫外线引起的细胞损伤[4-5],这种显著的抗氧化性能决定了其在日化领域有广阔的应用前景[6-8]。
PCF由于其易溶于水的特点,与酯类制剂配伍性差,且不易直接渗透到皮肤角质层,限制了其作为日化添加剂的开发。脂质体作为一种新型载体,利用磷脂双分子层包裹活性成分,直接传递至细胞深层,促进吸收,减少刺激性,目前欧洲、美国和日本市场上有10%的护肤品和防晒品中应用了脂质体技术[9]。脂质体的制备方法有很多种,如薄膜法[10-11]、反相蒸发法[12-13]、复乳法[14]、注入法[15-17]、梯度法[18]等,不同方法获得脂质体的包封率不同。本研究选用了pH梯度法,根据Handerson-Hasselbalch理论,产生内外梯度差,使目的物跨膜加速聚集,因此包封率大大高于被动载体,胰岛素应用此法获得的脂质体包封率可以由20%左右提高到50%[19]。
众所周知,脂质体作为药物载体,应用广泛[20],但用于化妆品以及食品工业中的报道相对较少[21-22],是近年来才兴起的研究领域。为保持多肽蛋白类药物的生物活性和稳定性,各种新型的、条件温和的脂质体制备方法应用其中,取得了较好的效果[23],但还没有用于日化工业生物活性物质脂质体体系的构建报道。本文研究了将其用于PCF化妆品制剂制备的可行性,探讨了pH梯度法制备PCF脂质体的条件,优化获得最佳工艺,并对获得的脂质体性能进行评价。
1 材料与方法
1.1 材料与仪器
扇贝多肽(polypeptide from Chlamys farreri,PCF) 系本实验室纯化,方法见文献[24],纯度>95%;乙醚、磷酸氢二钠、柠檬酸、柠檬酸钠、吐温80、卵磷脂(大豆)、胆固醇 均为分析纯,国药集团化学试剂有限公司。
RE-52C旋转蒸发仪 亚荣;JY96-ⅡN超声破碎仪 新芝;Zetasizer Nano激光散射粒径分析仪Malvern;JEM-200EX型电子显徽镜 TEM。
1.2 实验方法
1.2.1 pH梯度法制备PCF脂质体工艺流程 称取一定量的大豆卵磷脂、胆固醇和吐温80→溶解于适量乙醚→置于圆底烧瓶,50℃恒温减压旋转蒸发掉有机溶剂,使磷脂在蒸发瓶底形成一层薄膜→加入一定pH的0.3mol/L柠檬酸盐溶液10mL→50℃水化30min→样品4℃放置保存。
在空白脂质溶液中加入PCF干粉混匀→饱和Na2HPO4溶液将pH调高3→超声5min(间歇超声,1s/1s)→静置2h→使用0.45μm滤膜过滤→样品4℃放置保存。
1.2.2 脂质体包封率的测定
1.2.2.1 多肽定量 PCF的量由双缩脲法确定[25]。
1.2.2.2 脂质体分离方法 根据文献报道,超滤法可用于脂质体包封率的测定[26]。取PCF脂质体5m L至Millipore超滤杯中超滤,使用1万分子量超滤膜截留脂质体,收集滤出液,定容至适当浓度,测定其中游离PCF总量。
1.2.2.3 包封率的计算 超滤法将脂质体与游离PCF分离,测定游离PCF量,根据下式计算脂质体包封率(EE):EE(%)=(Ct-Cf)/Ct×100。式中,Cf是游离PCF含量,Ct是加入的总PCF含量。
1.2.3 脂质体制备工艺优化
1.2.3.1 单因素实验 直接称取卵磷脂200mg,溶解于乙醚后蒸干成膜,使用不同的柠檬酸盐溶液(pH分别为1、2、3、4)水化后,用饱和Na2HPO4溶液调节pH增加3,确定pH梯度对脂质体包埋效果的影响。称取卵磷脂200mg制备空白脂质,按照0.5~4mg/m L分别添加PCF,确定PCF最佳载量。固定卵磷脂量为200mg,改变胆固醇的加量(30~90mg)和吐温80的加量(0~100mg),考察胆固醇和吐温80的加入对脂质体包封效果的影响。
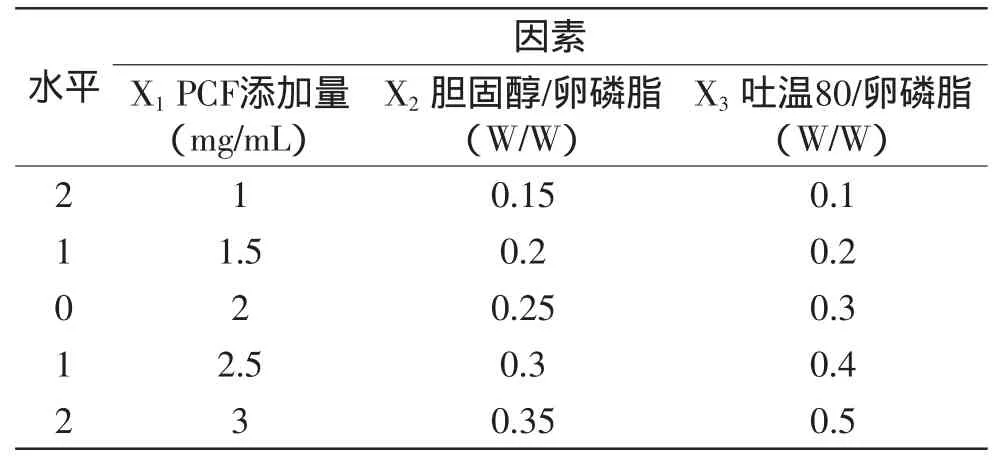
表1 实验因素水平表Table1 Factors and levels of experiment
1.2.3.2 复合设计及响应面分析 依次改变PCF脂质体制备时PCF添加量、胆脂比(胆固醇/卵磷脂)以及吐温80量,以包封率作为评价指标。选择三因素进行复合设计及响应面分析,优化其制备条件。实验设计中的水平及编码表见表1。
1.2.4 脂质体的粒径和形态 吸取少量脂质体悬液,稀释至卵磷脂含量在0.025%(W/W),装入小瓶,放入激光散射粒径分析仪中进行检测。
1.2.5 脂质的稳定性 将制备的PCF脂质体分别置于室温(25℃)和冷藏环境下(4~6℃),每隔一天测量其包封率。测试PCF脂质体的温度稳定性,以初始制备的脂质体包封率为100%。
2 结果与讨论
2.1 单因素条件对PCF脂质体制备的影响
2.1.1 pH梯度对脂质体包埋效果的影响 PCF为水溶性多肽,常规方法制备脂质体的包封率较低。pH梯度法通过形成内外水相的不同H+梯度,使PCF向脂质内部主动聚集,可以实现包封率的提高,且不易泄露。根据Henderson-Hasselbalch理论,脂质体内外pH梯度差为3个单位时,理论上就会造成内外浓度的1000倍之差[27]。研究了不同pH梯度条件下,脂质包封率的影响,发现pH 4~7和pH 3~6梯度的包封率都较高,超过了85%,而其中pH 4~7梯度条件温和,对于多肽是更为稳定的环境,因而确定制备脂质体的pH梯度范围为pH4~7。

表2 pH梯度对包封率的影响Table2 Effectof pH gradienton encapsulation efficiency of liposome
2.1.2 PCF载量对脂质体包埋效果的影响 制备空白脂质,按照0.5~4mg/m L分别添加PCF。从图1结果中可以看出,脂质体对于PCF的包埋能力是有一个限度的,超过2mg/m L浓度后,包封率开始下降,这与卵磷脂的浓度以及磷脂双分子层的稳定性有关。

图1 PCF添加量对脂质体包埋效果的影响Fig.1 Effectof PCF to phospholipids ratio on encapsulation efficiency of liposome
2.1.3 胆固醇对脂质体包埋效果的影响 胆固醇可以调节磷脂双分子层的流动性,对包封率和脂质体的稳定性有重要影响。通过考察胆固醇/卵磷脂比对脂质体包封率的影响,结果如图2所示。
随着胆固醇添加量的增加,包封率先提高后降低,胆固醇在最初添加时,可以嵌入到磷脂膜中,与磷脂分子交替排列,可以增加膜的稳定性,减少泄露。但是胆固醇的量如果过大,反而会干扰双分子层的形成,使膜的流动性增加,相变温度变低,因此包封率也会随之降低。当卵磷脂量为200mg时,胆固醇的最适添加量为50mg,即胆脂比(胆固醇与卵磷脂质量之比)为1∶4时,此时的包封率最高,可以达到90%左右。

图2 胆固醇加量对脂质体包封率的影响Fig.2 Effectof cholesterol on encapsulation efficiency of liposome
2.1.4 吐温80对脂质体包埋效果的影响 吐温80是常用的非离子型亲水性表面活性剂,适当的添加吐温80在脂质体中,可以防止脂质体悬液中的小脂粒聚集、融合和沉淀。通过考察不同浓度的吐温80对形成PCF脂质体的影响,结果如图3所示。
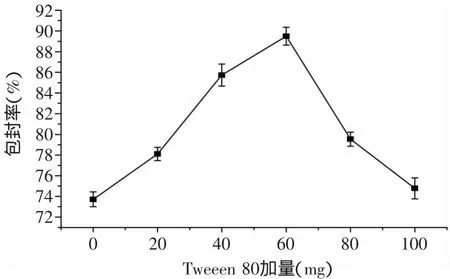
图3 吐温80对脂质体包封率的影响Fig.3 Effectof Tween 80 on encapsulation efficiency of liposome
结果表明,当卵磷脂为200mg时,吐温80添加60mg可以达到较好的包封效果。
通过单因素实验结果发现,使用pH梯度法制备PCF脂质体,合适的梯度范围是3~6或者4~7,考虑到蛋白多肽类的保存环境需要更温和,选取了4~7的pH梯度。之后在制备时固定其他因素的量,优化胆脂比为1∶4,吐温80/卵磷脂为3∶10。胆固醇和吐温80都与磷脂双分子层小球的形成稳定性有关系,配合PCF的载量变化,会显著影响到包封率的高低。杜丹丹等制备石榴皮多酚脂质体时,发现胆脂比和两相体积比之间存在较为显著的交互作用[28];赵圣书等则在制备黑加仑花苷脂质体时发现各个因素之间表现出一定的正负相关性[29];这种现象还在其他脂质体的制备过程中被发现[13-17],因此,采用响应面方法考察PCF脂质体制备工艺中重要因素之间的作用可以进一步理清其中的关系。
2.2 脂质体制备工艺的复合设计及响应面优化
根据单因素实验结果,选取对包封率影响显著的三个因素:PCF载量、胆固醇/卵磷脂以及吐温80/卵磷脂,以包封率为响应值,设计20组实验。实验结果见表3。

表3 中心复合设计以及包封率的实验结果Table3 Central composite design and values of encapsulation efficiency
利用Minitab 15.0对表3中的数据进行二次多元回归拟合,获得了以下多元回归方程:

其中,Y为包封率,X1、X2、X3为PCF添加量、胆固醇与卵磷脂的加量比及吐温80与卵磷脂的加量比的编码值。方差分析表见表4和表5,由结果可见,该模型回归显著(p<0.001),预测值和实测值之间有高相关性(R2=0.9236),说明该模型拟合程度良好,实验误差小,可用此模型对PCF脂质体制备工艺进行分析和预测。在所选的各因素水平范围内,对包封率影响的主次顺序为:X2>X3>X1,模型中X、X、X项对包封率的影响也极显著(p<0.01),线性和平方回归的拟合度较好。
多元二次回归方程对应的响应曲线图见图4~图6,各个因素及其之间相互的影响可以从图上直接分析得到。从图上可以对其响应面曲线以及等高线图进行分析,直观看出优化区域,并可以在优化区域内根据脂质体制备过程中的实际需要调整各因素的数值大小,从而得到包封率较高的脂质体[29]。由图4~图6可知,曲面效应比较显著,PCF添加量、胆固醇与卵磷脂的加量比及吐温80与卵磷脂的加量比之间存在着明显协同作用,在一定范围内,同时增加才能提高脂质体的包封率。响应曲面的弯曲程度大,表明各响应值对影响因素的改变颇为敏感。

表4 优化实验回归模型系数显著性检验Table4 Significant regressionmodel coefficients test

图4 胆脂比和载量影响脂质体包封率的曲面图Fig.4 Response surface plotof encapsulation efficiency between cholesterol/phospholipids ratio and PCF
由曲面图4可知,在一定的范围内,随着胆脂比的升高,包封率先增加后降低,说明一定量的胆固醇可以调节磷脂膜的流动性,有学者从电化学角度证明,含有胆固醇的磷脂双层膜相对较为稳定,不易形成孔洞或缺陷,是因为胆固醇的两性特点对脂类的物理状态有重要的调节作用,且这种作用与胆固醇的浓度有关[30-31]。随着磷脂双层膜稳定性的改变,PCF的载量也随之变化。

图5 吐温80/卵磷脂和PCF载量影响脂质体包封率的曲面图Fig.5 Response surface plotof encapsulation efficiency between Tween80/phospholipids ratio and PCF
由图5可以看出,表面活性剂吐温80与包封率之间也存在着影响关系,随着吐温80的加入,包封率也呈现先增加后降低的趋势。吐温80是一种非离子型表明活性剂,可以物理吸附到脂质层表面,其亲水集团覆盖在脂质表面,增加了脂质体小球的厚度。为了使这种覆盖更加完全,吐温80的浓度需要维持在一定数值,使其在溶液和脂质层中的分配平衡[32],本研究的结果也证明了这一特点。此外,PCF的载量也随之发生了相应的正相关变化。
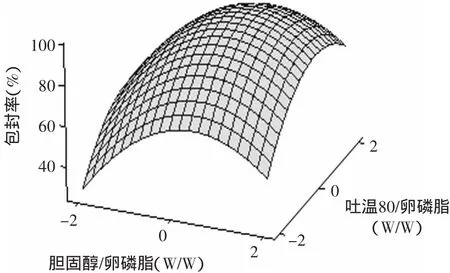
图6 吐温80/卵磷脂和胆脂比影响脂质体包封率的曲面图Fig.6 Response surface plotofencapsulation efficiency between Tween80/phospholipids ratio and cholesterol/phospholipids ratio

表5 包封率在中心复合设计中回归方程方差分析表Table5 ANOVA for the regression equation of encapsulation efficiency in Central composite design
由图6可知,等高线的疏密程度以及陡度大于图4和图5,说明胆脂比和吐温80的共同改变对包封率的影响更为明显。在实验设计的水平范围内,各个因素在中心水平附近都可以获得最大的包封效果,充分说明脂质体的形成需要合适的胆脂比、吐温80以及包裹量,过大浓度添加PCF、胆固醇和吐温80不但不利于脂质体的形成,反而会加速双分子膜的破裂或聚合。
建立中心复合设计模型后,在模型范围内寻找最佳配方,得到的PCF添加量为2.15mg/m L,胆固醇与卵磷脂的加量比0.28,吐温80与卵磷脂的加量比为0.34,获得脂质体包封率的预测值为96.76%。考虑到实际操作的便利,采用卵磷脂为200mg,胆固醇加量为56mg,吐温80加量为68mg,PCF添加量为2.15mg/m L,pH梯度为4~7,制备三批脂质体样品,平均包封率为96.05%,与预测值之间的偏差小于1%,说明通过响应面优化建立的模型与实际值能够很好契合。
2.3 PCF脂质体质量评价
2.3.1 粒径分布及微观形态观察 按照上述配方和工艺制得PCF脂质体,由马尔文电位仪Nano-ZS90对所制脂质体粒径主要分布及电位进行测定,结果显示,优化工艺所得脂质体的粒径平均分布在200nm以下,符合透皮吸收的要求(图7)。Zeta电位结果表明,抗氧化肽脂质体带负电荷,平均Zeta电位为-21.3mV,具有较强的稳定性。透射电镜观察,PCF脂质体为圆球形单室脂质体,磷脂双分子膜清晰可见(图8)。
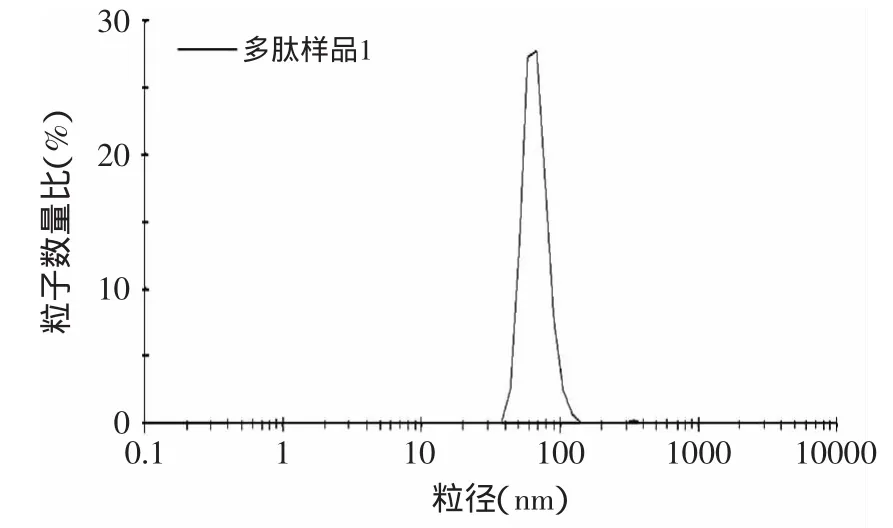
图7 pH梯度法制备的PCF脂质体的粒径分布图Fig.7 Particle size distribution of PCF liposomes prepared by pH gradientmethod

图8 pH梯度法制备的PCF脂质体的电镜图(50000×)Fig.8 Electronmicroscope imagine of PCF liposomes prepared by pH gradientmethod(50000×)
2.3.2 脂质体的稳定性 从图9可以看出,随着时间的延长,PCF脂质体的包封率总体有下降的趋势,尤其是在25℃接近室温的条件下,脂质体存放30d后,包封率只有最初的81.7%。长期存放后的脂质体局部会形成较大的膜块,在贮存过程中,脂质体会发生絮凝,所包容的活性成分也会逐渐泄漏,但低温环境可以延缓这一变化,从图9可以看出,4~6℃条件下保存的脂质体包封率的衰减得到明显控制,同样在30d后,包封率还能超过最初包封率的95%以上,说明冷藏条件对于PCF脂质体的保存非常有利。总体上来看,使用pH梯度法制备的PCF脂质体稳定性较为良好,即使在室温条件下保存一个月包封率也保持在80%以上。
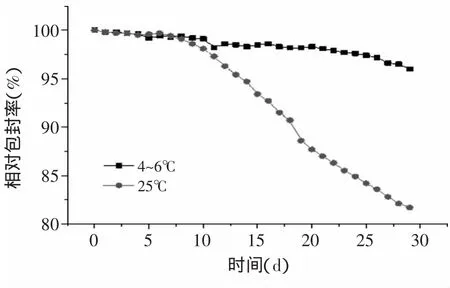
图9 温度及存放时间与包封率的关系Fig.9 The relationship between temperature and time
3 结论
梯度-超滤法制备扇贝多肽PCF脂质体,通过单因素筛选和中心复合设计响应面分析方法优化了制备方法,以提高脂质体的包封率及稳定性。研究了PCF脂质体制备过程中的三个重要因素:PCF载量、胆脂比和吐温80加量,以包封率为响应值拟合出回归模型,经过验证,能较好契合脂质体实际制备工艺中的参数。最终确定了pH梯度法制备脂质体工艺和配方:卵磷脂为200mg,胆固醇加量为56mg,吐温80加量为68mg,PCF添加量为2.15mg/m L,pH梯度为4~7,包封率最高能达到96.05%。PCF脂质体为圆球形单室脂质体,粒径小于200nm,符合透皮吸收的要求,在4~6℃具有较强的稳定性。
与已经报道的pH梯度法制备水溶性物质脂质体相比[27,33-34],进行PCF包裹得到的包封率更高,能达到90%以上,说明PCF很适合使用这种包裹工艺。但是PCF的载量相对较小,超过2mg/m L左右的量包封率就开始大幅下降,还难以满足实际应用的需要,因此仍需在提高PCF载量方面进一步探讨。
[1]Mendis E,Rajapakse N,Byun H G,et al.Investigation of jumbo squid(Dosidicus gigas)skin gelatin peptides for their in vitro antioxidant effects[J].Life Sciences,2005,77(17):2166-2178.
[2]Sun L,Zhang Y,Zhuang Y.Antiphotoaging effect and purification of an antioxidant peptide from tilapia(Oreochromis niloticus)gelatin peptides[J].Journal of Functional Foods,2013,5(1):154-162.
[3]Li C,Song L,Zhao J,et al.Preliminary study on a potential antibacterial peptide derived from histone H2A in hemocytes of scallop Chlamys farreri[J].Fish&Shellfish Immunology,2007,22(6):663-672.
[4]Zhang Z,Liu X,Liu T,et al.Polypeptide from Chlamys farreri inhibits UVB-induced apoptosis of HaCaT cells via iNOS/ NO and HSP90[J].Chinese JournalofOceanology and Limnology,2009,27(3):594-599.
[5]Li J L,Liu N,Chen X H,et al.Inhibition of UVA-induced apoptotic signaling pathway by polypeptide from Chlamys farreri in human HaCaT keratinocytes[J].Radiation and Environmental Biophysics,2007,46(3):263-268.
[6]张昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29(4):443-447.
[7]陈华,易湘茜,陈忻,等.海洋胶原蛋白肽的制备及生物活性研究进展[J].中国食物与营养,2010(8):57-60.
[8]任舒文,管华诗.海洋生物活性提取物在化妆品中的应用[J].中国海洋药物,2007,26(2):47-51.
[9]严勇朝,解素花.脂质体——一种新型的化妆品体系[J].北京日化,2002(2):19-23.
[10]Bangham A D,Standish M M,Watkins JC.Diffusion of univalent ions across the lamellae of swollen phospholipids[J].Journal ofMolecular Biology,1965,13(1):238-252.
[11]Maestrelli F,Gonzalez-Rodriguez M L,Rabasco A M,et al.Effect of preparation technique on the properties of liposomes encapsulating ketoprofen-cyclodextrin complexes aimed for transdermal delivery[J].Int JPharm,2006,298:53-60.
[12]Vyas S P,Singh R P,Jain S,et al.Non-ionic surfactant based vesicles(niosomes) for non-invasive topical genetic immunization against hepatitis B[J].Int JPharm,2005,296:80-86.
[13]任文霞,李建科.茶多酚脂质体的制备[J].食品工业科技,2008,29(11):186-189.
[14]张伟光,安红,初文君.大豆磷脂维生素E脂质体的制备[J].食品工业科技,2007,28(5):140-142.
[15]曹宁宁,羡菲.脂质体的制备方法及研究进展[J].天津理工学院学报,2003,19(1):30-35.
[16]夏书芹,许时婴.辅酶Q10纳米脂质体的制备[J].食品工业科技,2006(2):164-167.
[17]Mayer L D,Tai L C,Bally M B,et al.Characterization of liposomal systems containing doxorubicin entrapped in responseto pH gradients[J].Biochim Biophys Acta,1999,97:135-141.
[18]谢文磊,纪俊敏.脂质体作为药物载体的研究进展[J].郑州工程学院学报,2002,23(4):68-72.
[19]王成涛,籍保平,曹雁平,等.豆豉纤溶酶载酶纳米脂质系统的构建与评价[J].食品科学,2008,29(9):158-161.
[20]江献芳,周诺.脂质体在基因治疗中的应用研究及进展[J].中国组织工程研究,16(8):1463-1466.
[21]吴韶敏,曹劲松.脂质体技术应用于食品工业的最新研究进展[J].中国油脂,2007,32(3):42-46.
[22]穆筱梅.脂质体在化妆品中的研究进展[J].日用化学工业,2007,37(1):46-49.
[23]张宏波,项琪,赵文等.多肽,蛋白类药物脂质体研究进展[J].中国生物工程杂志,2007,27(6):101-106.
[24]牛瑞,孙谧,于建生,等.扇贝裙边酶解制备抗氧化肽的实验研究[J].中国水产科学,2011,18(1):214-221.
[25]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[26]郜海涛,顾黎,张鹏英,等.牛蒡寡糖脂质体的制备和性质鉴定[J].科技通报,2010,26(6):863-868.
[27]王祥,王淼,范明辉,等.pH梯度法制备谷胱甘肽脂质体[J].食品工业科技,2008(3):88.
[28]杜丹丹,李建科.响应曲面法优化石榴皮多酚脂质体的制备及质量评价[J].食品工业科技,2012,33(4):296.
[29]赵圣书,王振宇.响应面法优化黑加仑花色苷脂质体制备工艺的研究[J].食品工业科技,2012,33(23):258-262.
[30]王建国,江黎丽,惠飞,等.脱氧胆酸钠与支撑磷脂双层膜作用的电化学研究[J].化学学报,2007,65(3):239-245.
[31]McMullen T PW,McElhaney R N.Differential scanning calorimetric studiesof the interaction of cholesterolwith distearoyl and dielaidoyl molecular species of phosphatidylcholine,phosphatidylethanolamineand phosphatidylserine[J].Biochemistry,1997,36(16):4979-4986.
[32]胥传来,姚惠源.吐温-80与脂质体膜相互作用机理的研究[J].西安石油大学学报:自然科学版,2005,20(6):45-48.
[33]郑庆忠,刘利军.pH梯度法制备氧化苦参碱脂质体[J].中国医药工业杂志,2006,37(10):679-681.
[34]叶鹏,宋金春,郭成希.pH梯度法结合逆向蒸发法制备氟尿嘧啶脂质体[J].中国药师,2009,12(3):308-311.

