绿色木霉β-葡萄糖苷酶基因在大肠杆菌中的克隆
刘 颖,韩春然,张 帅,张玮玮,窦博鑫
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
纤维素酶是将纤维素水解成纤维二糖和葡萄糖的一组复杂酶系的总称,细菌、真菌、放线菌等微生物均能产纤维素酶[1-5]。其中β-葡萄糖苷酶(βglucosidase,纤维二糖酶或CB,EC3,2,1,21)能催化水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖,防止纤维二糖的积聚,减轻其对纤维素酶的抑制作用,决定了纤维素糖化过程的最终效率,是促进纤维素降解过程的关键酶,同时它也能水解其他有重要生理作用的β-葡萄糖苷[6-8]。但是β-葡萄糖苷酶含量却最低,不足1%,且活性普遍偏低,是纤维素酶解转化的关键酶[9]。许多国内外学者正致力于β-葡萄糖苷酶分子生物学方面的研究,以期改善纤维素酶的催化效率,实现纤维素资源的高效生物转化。天然纤维素酶由于酶活较低以及生产成本较高等因素的限制,大规模的工业化应用有一定的困难,对纤维素酶基因进行克隆,利用基因工程手段构建高效纤维素酶产生菌越来越受到人们的重视,同时也为纤维素酶的大规模生产提供了新途径。现已在纤维素酶基因克隆方面取得了一定的研究进展,研究者几乎将已克隆的纤维素酶基因转化至大肠杆菌进行了表达。目前已有数千种纤维素酶基因序列和相应的氨基酸序列被公布在GenBank、欧洲分子生物学实验室(EMBL)核苷序列数据库、日本DNA数据库(DDBJ)等共享数据库中[10-14]。
实验首先利用绿色木霉(Trichoderma viride)的总RNA为模板,在GenBank上检索β-葡萄糖苷酶基因(bglⅠ)DNA序列,根据检索结果设计特异性引物。然后运用PT-PCR进行了扩增bglⅠ片段,并将其与pMD18-T载体连接,并转化到大肠杆菌JM 109进行测序研究。获得绿色木霉β-葡萄糖苷酶基的相关基本信息,并与GenBank上检索的β-葡萄糖苷酶基因的核苷酸序列进行了比较分析。
1 材料与方法
1.1 材料与仪器
绿色木霉Trichoderma viride AS3.3711 中科院微生物研究所;大肠杆菌JM 109、质粒PMD18-T、RNA提取试剂盒、DNaseⅠ酶、RT-PCR试剂盒、TaqDNA聚合酶、DNA片段回收试剂盒、RNase A、限制性内切酶 大连宝生物工程公司;过硫酸铵、TEMED、溴酚蓝、溴化乙锭EDTA Sigma公司;SDS 济南赛恩斯科技有限公司;Tris 上海伯奥生物科技有限公司;PDA培养基 马铃薯(去皮切块)300.0g、葡萄糖20.0g、琼脂20.0g、蒸馏水1000m L、121℃灭菌20min。
Thermal Cycler PCR仪 美国BIO-RAD公司;JY5000型电泳仪 北京市君意机电技术有限公司;HLQ-C型空气浴振荡培养箱 天津实验仪器厂;UV1900型紫外分光光度计日本岛津。
1.2 实验方法
1.2.1 绿色木霉总RNA的提取 绿色木霉起始菌体量为0.10g菌丝体,采用Trizol法提取其总RNA。
1.2.2 PCR引物设计 从GenBank中查找β-葡萄糖苷酶基因(bglⅠ),根据bglⅠ(M 55080)基因的序列,应用Primer Prem ier 5.0和Dnamen软件分析基因内部是否带有该载体卡盒中的限制性核酸内切酶BamHI、EcoRI、HindⅢ、PstⅠ、SacⅠ、XbaⅠ的酶切位点[9,14-15]。引物合成由大连宝生物工程公司TaKaRa完成。最终确定引物序列如下:正链引物为5’-AGGAG TTGCG TGTTT GTCT-3’;反链引物为3’-AAACT GCTCG ACTAA CGCC-5’。
1.2.3 PCR扩增目的基因 以绿色木霉的基因组cDNA为模板,用β-葡萄糖苷酶基因特异引物进行PCR扩增。将PCR产物进行1.0%琼脂糖凝胶电泳检测,并进行PCR产物回收。PCR反应体系如下:模板cDNA(0.1μg/m L):1.00μL;正链引物(100pmol/L):2.00μL;10×Buffer(1.0mmol/L):5.00μL;反链引物(100pmol/L):2.00μL;dNTP(1.0mmol/L):8.00μL;Taq DNA聚合酶(5.0U/μL):1.00μL;灭菌ddH2O:6.00μL;总体积:25.00μL。
PCR反应条件为:94℃预变性处理1min;94℃变性30s,50℃退火40s,72℃延伸90s,循环次数30次;最后72℃延伸7m in,于4℃保存备用。
1.2.4 PCR产物回收 采用DNA回收试剂盒方法回收,PCR产物用电泳检测。PCR产物回收后与dATP连接(72℃,30min),再与载体连接。
1.2.5 连接反应 在微型离心管中,加入1.0μL PMD 18-T Vector,3.0μL Insert DNA,灭菌1.0μL ddH2O;向上管中加5.0μL Ligation solutionⅠ(用前于冰上融化),16℃过夜。
1.2.6 PCR产物克隆及转化 将上述纯化的PCR扩增产物与pMD18-T载体连接。采用含有16μL的XGal、4μL的IPTG和16μL 100mg/m L的Amp的LB平板筛选阳性克隆,转化大肠杆菌JM 109感受态细胞,对筛选到的转化子抽提质粒[16-22]。
1.2.7 鉴定目的基因 采用PCR以及酶切实验这两种方法验证目的基因。用HindⅢ进行酶切,酶切体系的总体积20.00μL,其成分为:质粒,8.00μL;Buffer M(1.0mmol/L),2.00μL;HindⅢ,1.00μL;灭菌ddH2O,9.00μL。将混合反应物置于37℃下,反应3h左右。加入0.5mol/L EDTA终止反应,电泳观察。
PCR鉴定目的片段的反应体系总体积为25.00μL,其主要成分:模板,1.00μL;10×Buffer,5.00μL;dNTP,8.00μL;正链引物,2.00μL;反链引物,2.00μL;Taq DNA聚合酶,1.00μL;灭菌ddH2O,6.00μL。PCR反应条件:94℃预变性处理1m in;94℃变性30s,50℃退火40s,72℃延伸90s,循环次数30次;最后72℃延伸7m in,于4℃保存备用。
1.2.8 目的基因测序及序列分析 将经酶切鉴定的带有目的基因片段的重组菌株进行测序,由上海博亚生物技术有限公司完成。将所克隆基因序列的测序结果与GenBank上的相应序列进行BLAST比较分析,比对分析其核苷酸序列和编码的氨基酸序列。
2 结果与讨论
2.1 绿色木霉总RNA的提取结果
真菌细胞RNA中以rRNA含量最为丰富,由28S、18S和5S组成。本实验采用改良的Trizol法提取绿色木霉的基因组RNA,琼脂糖电泳结果图1显示出基因组RNA的28S、18S、5S片段情况,28SRNA和18S RNA条带清晰,无拖尾,5S部分降解较少。经紫外分光光度计检测,RNA样品的OD260/OD280均值为1.964,说明抽提的总RNA完整性较好,纯度高,虽然有少量被降解的迹象,仍然能够满足后续RT-PCR的要求。
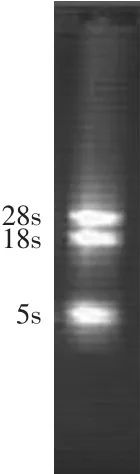
图1 绿色木霉的总RNAFig.1 Total RNA of Trichoderma viride
2.2 PCR扩增目的基因
以反转录得到的cDNA为模板,用β-葡萄糖苷酶基因特异引物进行PCR扩增。通过电泳图2结果分析,可以扩增出约1.5kbp的目的大小片断。用PCR回收试剂盒回收PCR产物,将回收产物与载体PMD-18连接,转化大肠杆菌感受态细胞[23-24]。
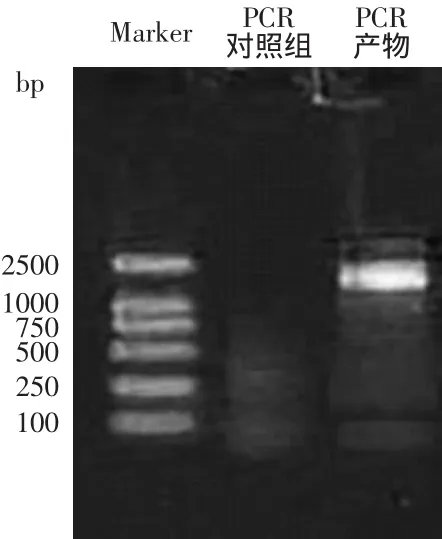
图2 RT-PCR扩增bglFig.2 RT-PCR amplification of bgl
2.3 质粒的提取
挑取转化平板上的菌落,采用碱法提取少量质粒DNA,如电泳图3所示。通过琼脂糖凝胶电泳可以初步检查质粒的大小及浓度,其中提取的质粒为三条带,超螺旋带最亮,说明质粒提取质量较好。
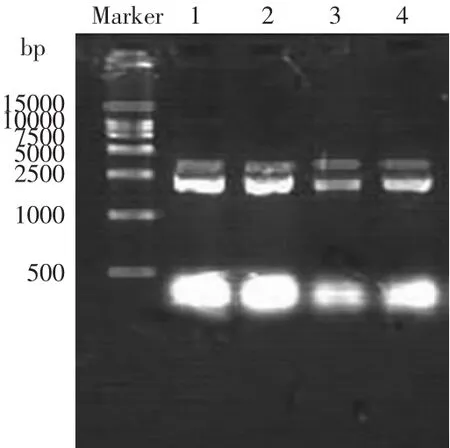
图3 质粒电泳图Fig.3 Electrophoresis picture of the plasmid
2.4 重组克隆载体的鉴定结果
经琼脂糖凝胶电泳,选取质粒用HindⅢ进行酶切鉴定,结果如图4所示,1、2泳道仅有约2.5kbp大小的片断,是未与目的片断连接的载体电泳结果;3泳道显示有大约4.0、2.5kbp的片断,质粒载体与目的基因片断之和约为4.0kbp,目的片断约为1.5kbp,证实其已克隆至载体上。应用特异引物,以提取的质粒DNA为模板,进行PCR反应。由图5中2泳道所示,PCR反应可以获得1.5kbp的目的片断,进一步证实目的片断已克隆到载体上。经PCR扩增后,pMD18-T-bgl能够得到与目的片段大小相符的特异性条带,条带与载体及目的片段大小相对应,表明bgl已经成功克隆至载体上。

图4 限制性内切酶鉴定目的片断Fig.4 Identification of the objective fragments by digestion endonucleas

图5 PCR鉴定目的片断Fig.5 Identification of the objective fragments by PCR
2.5 基因序列测定及分析
所测β-葡萄糖苷酶基因序列共1532bp,将所克隆基因序列的测序结果与GenBank上的绿色木霉相应序列进行BLAST比较分析,该序列中仅有几处发生碱基缺失,同源性达到98.8%。不同菌株中的β-葡萄糖苷酶基因有所差别,这说明不同菌株的β-葡萄糖苷酶基因变异是普遍的。
3 结论
本实验以绿色木霉(Trichoderma viride)的总RNA为模板,首先根据GenBank上检索的β-葡萄糖苷酶基因(bglⅠ)DNA序列,设计出特异性引物。然后运用PT-PCR进行了扩增bglⅠ片段,并将其连接到pMD18-T载体,并成功转化到E.coli JM 109测序。实验所获得的绿色木霉β-葡萄糖苷酶基因bgl全长为1532bp,与GenBank上检索的β-葡萄糖苷酶基因的核苷酸序列相比,其DNA序列同源性可达到98.8%。
[1]Dan S,Marton I,Dekel M,et al.Cloning,expression,characteriza-tion and nucleophile identification of family 3,Aspergillus nigerβ-glucosidase[J].The Journal of Biologicai Chemistry,2000,275(7):4973-4980.
[2]Iwashita K,Nagahara T,Kimura H,et al.The bgl A gene of Aspergillus kawachii encodes both extracellular and cell wallbound β-glucosidases[J].Applied and Environmental Microbiology,1999,65(12):5546-5553.
[3]张彬彬,李杰,柏锡,等.里氏木霉β-葡萄糖苷酶基因的克隆及序列分析[J].东北农业大学学报,2004,35(2):129-134.
[4]张敏,江正强,唐荦,等.海栖热袍菌耐高温β-半乳糖苷酶基因的克隆和表达[J].微生物学通报,2008,35(4):507-511.
[5]JIANG Chengjian,LI Shuangxi,LUO Fengfeng,et al.Biochemical characterization of two novelβ-glucosidase genes by metagenome expression cloning[J].Bioresource Technology,2011,102(3):3272-3278.
[6]孟宪文,宋小红,陈历俊,等.β-葡萄糖苷酶的研究进展[J].乳品加工,2010(10):42-45.
[7]唐开宇,张全,佟明友.β-葡萄糖苷酶发酵技术的进展[J].纤维素科学与技术,2009,17(3):65-69.
[8]李文佳,林亲录.绿色木霉产纤维素酶的研究进展[J].现代食品科技,2007,23(5):90-95.
[9]周晓明,莫隽颖,陶冶,等.黑曲霉β-葡萄糖苷酶基因在大肠杆菌中的克隆与表达[J].化学与生物工程,2010,27(6):50-53.
[10]FAN Hongxia,MIAO Lili,LIU Ying,et al.Gene cloning and characterization of a cold-adaptedβ-glucosidase belonging to glycosyl hydrolase family 1 from a psychrotolerant bacterium Micrococcus antarcticus[J].Enzyme and Microbial Technology,2011,49(1):94-99.
[11]卢敏,王帅豪,狄元冉,等.纤维素酶基因克隆与表达[J].动物营养学报,2012,24(6):1013-1018.
[12]Capaldo A,Walker ME,Ford CM,et al.β-Glucoside metabolism in Oenococcus oeni:Cloning and characterisation of the phospho-β-glucosidase bgl D[J].Food Chemistry,2011,125(2):476-482.
[13]Jeya M,Joo AR,Lee KM,et al.Characterization ofβglucosidase from a strain of Penicillium purpurogenum KJS506 [J].Biotechnologically Relevant Enzymes and Proteins,2010,86:1473-1484.
[14]Nakazawa H,Kawai T,Ida N,et al.Construction of a recombinant Trichoderma reesei strain expressing Aspergillus aculeatusβ-glucosidase 1 for efficient biomass conversion[J].Biotechnology and Bioengineering,2012,109(1):92-99.
[15]张舒平,周鹏,苏春元,等.重组枯草芽孢杆菌壳聚糖酶的纯化和性质研究[J].中国农业大学学报,2012,17(1):125-131.
[16]李敬坡.极端嗜热天冬氨酸激酶在大肠杆菌中克隆表达、纯化及酶学性质研究[D].苏州:苏州大学,2008.
[17]郑艳,管艺飞,刘长江.甘油脱水酶结构基因(gld ABC)克隆及序列分析[J].食品科学,2007,28(3):203-205.
[18]祝婷,李成磊,吴琦,等.苦荞和甜荞二氢黄酮醇4-还原酶基因(dfr)的克隆及序列分析[J].食品科学,2010,31(13):219-223.
[19]曾凡杰,华子春,胡勤刚,等.重组人骨形成蛋白2基因在大肠杆菌中的克隆[J].东南大学学报:医学版,2001,20(3):158-160.
[20]王桂珍,李保强,董占双,等.肺炎支原体P1蛋白羧基端基因片段在大肠杆菌中克隆的研究[J].微生物学杂志,2001(2):13-14.
[21]安洁.囊丝黄精(Polygonatum cyrtonema Hua.)凝集素Ⅱ基因在大肠杆菌中克隆表达、重组蛋白纯化及性质研究[D].成都:四川大学,2006.
[22]谭志文.极端嗜热菌Thermus thermophilus HB27的腺苷酸激酶基因在大肠杆菌中克隆表达及酶学研究[D].杭州:浙江大学,2010.
[23]李智,刘勇,郑晓峰,等.MNDA及MNDA-HIN200片段在大肠杆菌中克隆、表达及纯化[J].生物技术通报,2011(8):181-186.
[24]杨宁,赵凌侠,唐克轩.重组人胰岛素类似物蛋白在大肠杆菌中克隆、表达与纯化[J].武汉大学学报:医学版,2010,31(3):281-287.

