MBTH 法检测木聚糖酶活性
■徐丽 王冠 丁皓 程瑛
(武汉新华扬生物股份有限公司,湖北武汉 430074)
木聚糖是植物半纤维素的主要成分,是自然界中仅次于纤维素的可再生资源,主要成分为D-木糖。虽然木聚糖是一类广泛存在于植物体内的半纤维素,但是,由于木聚糖在动物消化道内不能被消化吸收,并且阻碍其它营养成分的消化利用,具有很强的抗营养特性,因而限制了许多饲料的应用。木聚糖酶是一类重要的木糖苷键水解酶酶系,可将木聚糖逐次降解为低聚木糖及木糖,从而消除木聚糖的抗营养作用,提高动物对饲料的利用率。目前检测木聚糖酶最常用的方法为DNS法,但此法灵敏度低,难以满足饲料中微量添加量的检测。3-甲基-2-苯并噻唑酮腙(MBTH)法主要用来测定醛的含量,由于木糖的半缩醛结构具有一定的还原性,MBTH首先与还原糖反应生成嗪,过量的MBTH被Fe3+氧化成阳离子,再与嗪反应生成青蓝色化合物,在一定范围内,还原糖的量和反应液的颜色强度呈正比例关系。本文根据这一原理检测木聚糖酶的酶活力,旨在验证该方法的可行性。
1 材料与方法
1.1 试剂与设备
木糖(sigma)、木聚糖(sigma)、木聚糖酶、3-甲基-2-苯并噻唑酮腙(MBTH)、二硫苏糖醇(DTT)、硫酸铁铵、氨基磺酸、乙酸、乙酸钠、氢氧化钠试剂等。
紫外-可见分光光度计(Unico UV2800)、水浴摇床(常州国华)、漩涡混合器、电子天平(精确至0.000 1 g)、带搅拌的恒温水浴锅(HH-4,常州国华)、移液器、秒表设备等。
1.2 样品
木聚糖酶及饲料样品均采购于市场。
1.3 溶液及其配制
50 mM pH值5.5的乙酸-乙酸钠缓冲液:称取三水乙酸钠5.785 g,加入冰乙酸0.425 ml,加水溶解,定容至1 000 ml。测定溶液pH值,如果偏离5.50,再用乙酸或乙酸钠溶液调节至5.50。
MBTH显色液:3 mg/ml的MBTH溶液和1 mg/ml的DTT溶液等量混合即得,现用现配,1 d内有效。
硫酸铁铵试剂:准确称量5.000 g硫酸铁铵[FeNH4(SO4)2·12H2O]和5.000 g氨基磺酸,溶解,转移至1 000 ml容量瓶中,加入36%~38%的浓盐酸41.75 ml,溶解,定容,充分混匀,转移至棕色瓶中,于4℃冰箱贮藏待用。
1 mg/ml木糖标准溶液:精确称取干燥至恒质量的木糖0.100 1 g,用缓冲液定容至 100 ml,得 1 mg/ml的木糖溶液。
1.4 制作标准曲线
分别吸取木糖标准溶液0.4、0.8、1.2、1.6、2.0、2.4 ml和 2.8 ml,用缓冲液定容至 100 ml,配制成浓度为4、8、12、16、20、24、28 μg/ml木糖溶液。
分别取上述各浓度木糖溶液500 μl(3组平行样),加入到500 μl 0.5 M的NaOH溶液中,再分别加入MBTH试剂500 μl,充分混匀,80℃水浴加热15 min后,迅速趁热加入硫酸铁铵试剂1 ml,室温冷却后在650 nm处测定吸光度值。以相应缓冲溶液代替木糖溶液制成空白样。
以木糖浓度为Y轴,吸光值为X轴,得出标准曲线。
1.5 反应用酶液的制备
1.5.1 饲料中木聚糖酶反应样品的预处理
除按GB/T 14699.1的规定进行采样外,对于用喷涂方式添加木聚糖酶的颗粒配合饲料,应开包将颗粒及粉化的料混匀后,按四分法缩分至200 g,并粉碎通过0.45 mm标准筛,混匀后装入密封容器内备用。
1.5.2 固体样品反应用酶液制备
称取0.5 g样品(颗粒及粉状样品均按1.5.1进行预处理)于150 ml锥形瓶中,精确至0.000 1 g,加入50 ml缓冲液,在回旋式振荡器上提取30 min。提取后的试样在离心机上以12 000 r/min离心10 min,取上清液待测。
1.5.3 液体样品的反应用酶液制备
液体样品直接用乙酸-乙酸钠缓冲液进行稀释,定容。
1.6 木聚糖酶活力测定
将经预处理的且37℃预热过的0.5 ml酶液和0.5 ml底物溶液(0.8 mg/ml)于试管中混合好后开始计时,于37℃水浴反应30 min,加入1 ml 0.5 M的NaOH溶液,充分混合以终止反应,再分别加入MBTH试剂1 ml,充分混匀,80℃水浴加热15 min后,迅速趁热加入硫酸铁铵试剂2 ml,室温冷却后在650 nm处测定吸光度值,对照标准曲线计算木糖的量。同时以缓冲溶液代替酶溶液检测以作为空白对照。
1.7 回收率试验
精确添加一定量木聚糖酶至已知酶活饲料中,按1.6检测酶活,计算回收率。
1.8 计算公式
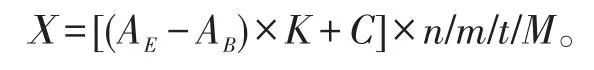
式中:X——木聚糖酶活性(U/g);
AE——酶反应液吸光值;
AB——空白对照吸光值;
K——标准曲线的斜率;
C——标准曲线的截距;
n——样品的稀释倍数;
m——样品质量(g);
t——反应时间(min);
M——木糖的摩尔质量,为150.13 g/mol。
2 结果与分析
2.1 MBTH法测木糖标准曲线
MBTH法测木糖标准曲线为y=30.157x-1.037 7,R2=0.999 2(1 cm比色皿);y=56.265 3x+0.051 6,R2=0.999 5(0.5 cm比色皿)。
2.2 MBTH法检测木聚糖酶酶活
取不同公司的酶制剂样品,采用MBTH法检测其中木聚糖酶的活性,结果见表1。
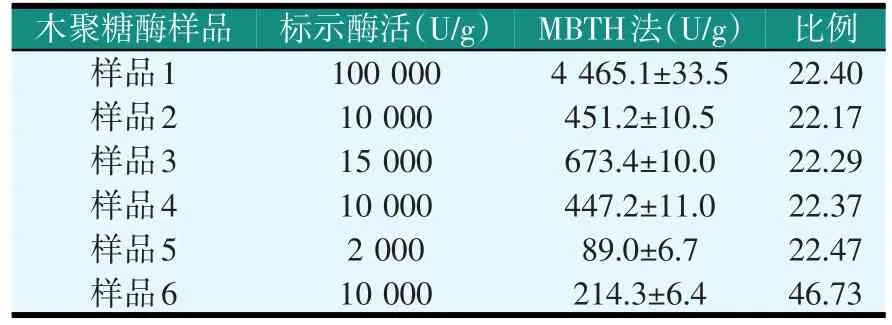
表1 MBTH法检测木聚糖酶酶活(1 cm比色皿)
如表1所示,除样品6外,其它样品采用MB⁃TH法测得的木聚糖酶活性均为标示酶活(国标法)的1/22左右,这可能是由于国标法检测的指标是还原性末端,无论多糖还是单糖,只要具有还原性末端均能发生显色反应,而MBTH则只是检测木糖或者寡糖的含量,因而,MBTH法测得的活性就比国标法要低。但是样品6的木聚糖酶采用MBTH法测得的木聚糖酶活性仅有国标法的1/46左右,说明该酶的酶解反应产物主要是多糖,而木糖和寡糖所占的比例极小,饲料酶需要将多糖分解为单糖和寡糖才有意义,也就是说样品6的木聚糖酶的实际应用效果较差,同样活性的情况下几乎只有其它样品中木聚糖酶效果的50%左右。这可能是由于发酵菌种的不同造成的。综上所述,可以使用MBTH法检测木聚糖酶的活性。
2.3 MBTH法检测饲料中木聚糖酶酶活(见表2)
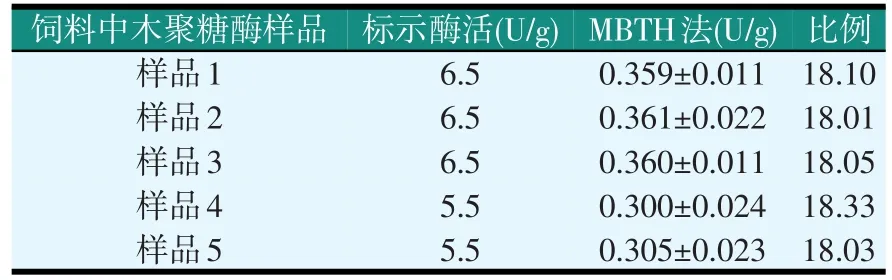
表2 MBTH法检测饲料中木聚糖酶酶活(1 cm比色皿)
如表2所示,对饲料中的木聚糖酶采用MBTH法进行检测,结果发现,与标示添加量的比例在18左右,与单纯检测木聚糖酶活性的结果(22倍)有些出入。为了验证该方法的准确性,做了如下的方法学验证(见表3)。

表3 MBTH方法学验证试验(1 cm比色皿)
MBTH法的准确度为103.13%,符合饲料中酶制剂不高于15%的检测误差要求,因此,MBTH法检测饲料中酶制剂的结果是准确可靠的。
2.4 MBTH法检测木聚糖酶酶活(0.5 cm比色皿)
由于检测饲料中木聚糖酶时MBTH法的空白吸光值过高,严重干扰了样品的检测,导致实际应用效果不理想;参考专利的办法,将1 cm的比色皿改为0.5 cm的,从而减少其空白吸光值,以减小空白对样品检测的干扰。
取不同公司的木聚糖酶样品,使用0.5 cm比色皿重做MBTH法的标准曲线,采用MBTH法检测木聚糖酶的酶活,结果见表4。
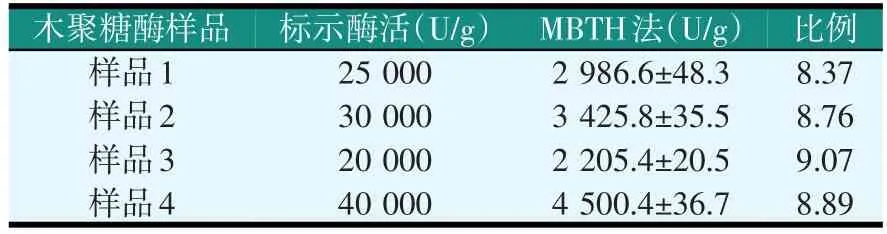
表4 MBTH法检测木聚糖酶酶活(0.5 cm比色皿)
更换比色皿后,两种方法测得的结果间比例有所不同,使用1 cm比色皿是22倍左右,而使用0.5 cm比色皿则是9倍左右。
再取饲料样品,检测其中的木聚糖酶酶活,见表5。
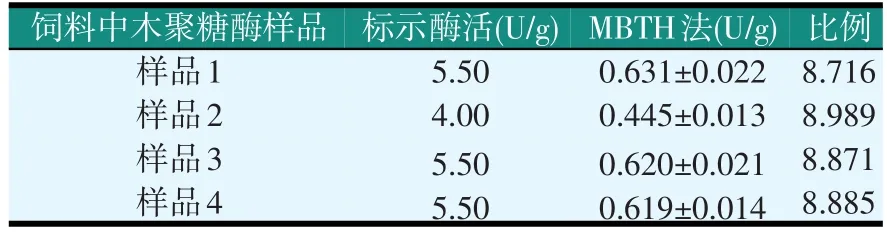
表5 MBTH法检测饲料中木聚糖酶酶活(0.5 cm比色皿)
结果发现,MBTH法检测饲料中木聚糖酶的结果较稳定,和标示酶活的比例仍是1/9左右。采用0.5 cm比色皿后,检测结果较稳定,与标示酶活相比木聚糖酶和饲料中木聚糖酶的比例都是1/9左右,但这样做牺牲了MBTH的检测灵敏度,因为空白吸光值降低的同时样品吸光值也降低了。仍取表5中样品1和样品2,采用MBTH法检测,并在正常检测的基础上增大取样量,以验证其灵敏度(见表6)。
结果发现,正常检测的情况下,样品1的空白值是0.515,样品吸光值为0.252;当取样量加倍时,空白及样品吸光值都升高了,但空白吸光值增幅更大,从而干扰检测结果,使得检测结果偏低。样品2也得到同样的结果,而且吸光值偏高,很容易超出线性范围。
3 讨论
MBTH法可用来检测醛类物质,也会与半缩醛结构的单糖、寡糖发生反应,结合本试验结果发现,MBTH法确实可检测木聚糖酶的活性,并且其酶活可在一定程度上反映其实际应用效果。但是应用到饲料中木聚糖酶的检测时还存在一定弊端,由于MBTH还可与饲料中的某些还原性物质反应,样品空白对照受到严重干扰,使得检测值偏低,检测限下降。即使采用0.5 cm比色皿对该法进行改进,也不能完全消除这种干扰,因此,此法虽可用,但若能更好地降低空白对照吸光值又不影响样品吸光值,才能体现出该法的优越性。
(参考文献若干篇,刊略,需者可函索)

