延长饲用油脂货架期的初步试验
■丁 聪 王顺喜 孙德光
(中国农业大学工学院,北京 100083)
油脂是畜禽饲料生产中必需脂肪酸的主要来源,也是提高饲粮能量的首选添加物,在畜禽生产中具有重要的作用,比如在蛋鸡饲料中加入0.2%的花生油,可显著提高鸡的繁殖性能[1]。然而饲用油脂在储藏期间,因空气中的氧气、光照、微生物和酶的作用,油脂容易哈喇,即产生令人不愉快的气味和苦涩味,同时产生一些有毒、有害的化合物,这种现象统称为油脂酸败(rancidity)[2]。目前,主要采用改善饲用油脂储存条件和添加化学抗氧化剂来预防油脂酸败,延长其货架期。长期食用合成抗氧化剂具有致癌、致畸等有害作用[3],因此,开发绿色、高效的抗氧化剂显得十分重要。
1 试验材料与方法
1.1 试验材料
枸杞、黄芪、甘草、鲁花花生油均购于北京市农贸市场。试验所用试剂均为分析纯。
1.2 试验仪器
电子天平、真空冷冻干燥机、水浴锅、紫外可见分光光度计、万能粉碎机、旋转蒸发仪、离心机、实验室其他常用玻璃仪器。
1.3 试验方法
1.3.1 醇提物的制取
取适量原料干燥至恒重,60目粉碎。按料液比1∶8(w/v)加入60%乙醇,回流提取2次,每次3 h,合并滤液,离心10 min(4 500 r/min),取上清液,用旋转蒸发仪浓缩至膏状,用冷冻离心机干燥,得粉末状醇提物,备用。
1.3.2 对-二苯代苦味酰基自由基(DPPH·)的清除率
准确称取10 mg对-二苯代苦味酰基自由基(DPPH·)粉末于50 ml容量瓶中,用无水乙醇定容,即得质量浓度为0.2 mg/ml对-二苯代苦味酰基自由基溶液,备用。取适量的醇提物,用无水乙醇溶解并配备浓度分别为2、4、6、8、10 mg/ml的溶液样品5份,再取适量2,6-二叔丁基-4-甲基苯酚(BHT)配置成浓度分别为2、4、6、8、10 mg/ml的溶液作对照。吸取各浓度的醇提物溶液、BHT溶液各4 ml,加入2 ml对-二苯代苦味酰基自由基溶液,振荡摇匀后静置30 min,以无水乙醇溶液做对照,分别测定其在517 nm处的吸光值。对-二苯代苦味酰基自由基的清除率按下式计算:

式中:E1——对-二苯代苦味酰基自由基的清除率;
A1——醇提物样品溶液在517 nm处的吸光值;
A2——无水乙醇代替醇提物样品在517 nm处的吸光值;
A0——蒸馏水代替醇提物样品在517 nm处的吸光值。
1.3.3 超氧阴离子自由基(O2-·)清除能力
采用邻苯三酚氧化法[4],配制浓度分别为0.2、0.4、0.6、0.8、1.0 mg/ml的醇提物溶液、BHT溶液。分别取各浓度的醇提物溶液、BHT溶液1.0 ml于试管中,每支试管加入3 ml Tris-HCl缓冲液(pH值8.2),0.1 ml醇提物溶液、BHT溶液,25 ℃水浴加热20 min后,加入0.3 ml 7 mmol/l的邻苯三酚准确反应4 min,加入1 ml 10 mmol/l HCl终止反应,在420 nm处测吸光度,按下式计算清除率:

式中:E2——超氧阴离子自由基(O2-·)清除率;
A1——醇提物溶液样品在420 nm处的吸光值;
A2——蒸馏水代替醇提物溶液在420 nm处的吸光值;
A0——蒸馏水代替反应试剂在420 nm处的吸光值。
1.3.4 羟基自由基(HO·)清除能力
采用结晶紫分光光度法测定[5]。在若干50 ml具塞比色管中分别加入0.4 mmol/l的结晶紫溶液1.5 ml,加入1.0 mmol/l的FeSO4溶液2.0 ml,再加入2.0 mmol/l的H2O2溶液1.0 ml,调节pH值到4.0,稀释到50 ml并摇匀,静置30 min后,在580 nm处的吸光度A'',同时测定不加H2O2时在580 nm处的吸光度A0'',则羟自由基的产生量可以用△A=A''-A0''来表示。
样品液对羟自由基清除率的测定:在上述反应体系中加入H2O2之前加入一定量的不同浓度的醇提物溶液、BHT溶液,测定其吸光度A1'',样品组对羟自由基的清除率按下式计算:

1.3.5 烘箱加速氧化法
向100 ml烧杯中加入50 g花生油,再加入醇提物,搅拌油样,使充分混合,敞口,置于(65±0.5)℃的恒温环境中强化保存,每24 h测一次油样的 POV(过氧化值)[6]和 P-A.V(茴香胺值)[7]。
2 结果与分析
2.1 自由基清除率测定结果(见图1~图3)
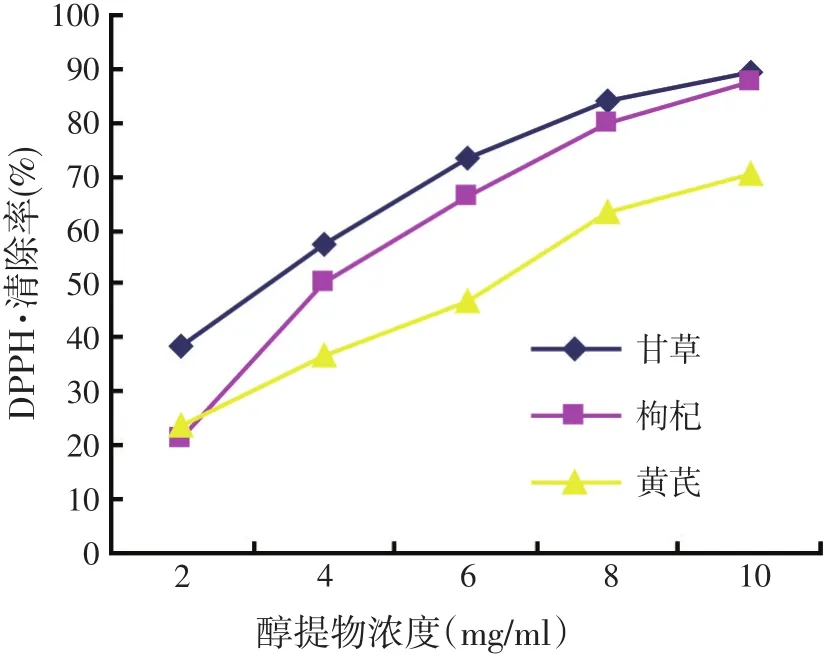
图1 醇提物对对-二苯代苦味酰基自由基的清除率

图2 醇提物对羟基自由基的清除率

图3 醇提物对超氧阴离子自由基的清除率
2.1.1 对-二苯代苦味酰基自由基清除率
对-二苯代苦味酰基自由基(DPPH·)在有机溶剂中具有很高的稳定性,并呈现深紫色,在517 nm下具有最大吸光值,在对-二苯代苦味酰基自由基与抗氧化剂的反应过程中,对-二苯代苦味酰基自由基会渐渐从紫色变成黄色,吸光值也会逐渐减少,吸光值减少得越多代表抗氧化能力越强,因此可以评价化合物的抗氧化能力。
由图1可知,随着醇提物浓度的增大,其自由基清除率也愈大,表明清除自由基能力与浓度呈明显的量效关系。醇提物浓度达到8 mg/ml时,甘草和枸杞醇提物的清除率高达80%。
2.1.2 羟基自由基清除率
由图2可知,随着醇提物浓度的增大,各试验组中自由基清除率也逐渐增大,表明自由基清除能力与醇提物浓度有明显的量效关系。其中,甘草、黄芪效果较好,枸杞次之,当甘草浓度达到10 mg/ml时,对羟基自由基的清除率达到90%以上。
2.1.3 超氧阴离子自由基清除率
由图3可知,随着醇提物浓度的增大,其自由基清除率也逐渐增大,表明自由基清除能力与醇提物浓度呈明显的量效关系。在醇提物浓度为2 mg/ml时,3种醇提物的自由基清除率基本相同。
2.2 过氧化值测定结果
2.2.1 添加0.02%醇提物后油脂的过氧化值(见图4)
由图4可知,随着时间的推移,各试验组的过氧化值逐渐增大。单一醇提取物对花生油均有一定的抗氧化作用,其中甘草醇提物的抗氧化效果最好,枸杞和黄芪次之。醇提物混合物抗氧化效果与单一醇提物相比,没有明显的提高,表明3种提取物间没有协同增效作用。

图4 各试验组的过氧化值
2.2.2 添加不同量的醇提物时过氧化值的测定结果(见图5~图7)

图5 添加不同量的甘草醇提物时的过氧化值
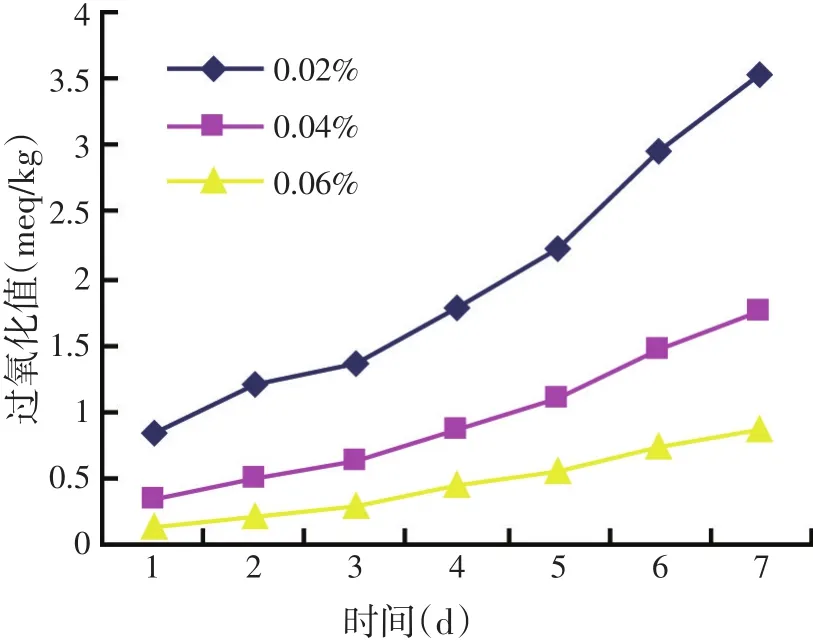
图6 添加不同量的枸杞醇提物时的过氧化值

图7 添加不同量的黄芪醇提物时的过氧化值
由图5~图7可知,各试验组的过氧化值随着醇提物量的增加而减小,也即抗氧化效果随着醇提物量的增加而逐渐增强。
2.3 茴香胺值测定结果(见图8)

图8 各试验组的茴香胺值
由图8可知,甘草醇提物的茴香胺值较其他醇提物组小,即抗氧化效果好,醇提物混合物的抗氧化效果与各提取物相比,没有明显的提高,这也说明各提取物间没有协同增效作用,与图4所得结论相一致。
2.4 全氧化值
全氧化值(total oxidation value)[8],即两倍的茴香胺值与过氧化值之和。过氧化值表征氧化酸败初期过氧化物的量,过氧化物不稳定容易分解成小分子物质,而茴香胺值表征酸败后期小分子物质的含量,国际上常用两倍的茴香胺值与过氧化值之和来表征油脂的氧化情况。

图9 各试验组的全氧化值
由图9可知,全氧化值的曲线趋势与过氧化值、茴香胺值的趋势基本一致。在三幅图中,黄芪、枸杞和混合物的全氧化值曲线基本重叠。
2.5 诱导期的计算
根据各试验组的过氧化值数据,利用DSP软件和Excel求得不同提取物的回归方程,再根据回归方程进行诱导期的计算,国家食用植物油卫生标准[9]花生油的过氧化值上限为20 meq/kg,以此计算花生油的诱导期,所得结果如表1所示。
从表1的诱导时间可以看出,添加醇提物后的诱导期均大于空白对照组,说明各种醇提物对花生油有一定的抗氧化作用,均能在一定程度上延长油脂的酸败诱导期。

表1 花生油的诱导期
2.6 过氧化值的变化率
由上述研究可知,过氧化值随时间而逐渐增大,因此可以由过氧化值的变化速度得到油脂的酸败速度,从而可得出抗氧化物质的稳定性和抗氧化效果的持续性。由图4知,黄芪的抗氧化效果次于甘草,但从图10中可以看出,黄芪醇提物过氧化值变化率低于甘草醇提物,这可能与有效成分的功效持续性有关。除此之外,抗氧化作用的强弱还与有效成分的溶出度[10-11]和油脂成分有关。同种中草药的抗氧化成分在花生油和芝麻油的溶出度不同,会影响其对油脂的抗氧化作用。此外,中草药成分和油脂成分之间存在相互作用,这种相互作用也会影响中草药对油脂的抗氧化作用[12-13]。
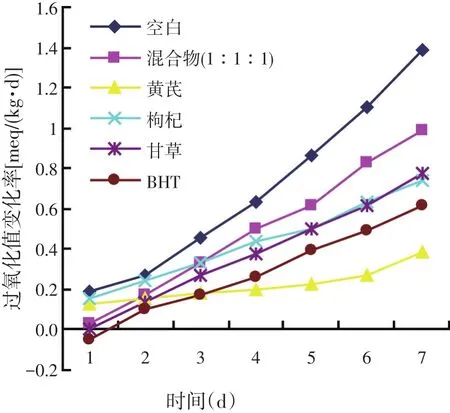
图10 各试验组的过氧化值变化率
2.7 油脂货架期的预测
温度对反应速度常数的影响,Arrhenius提出方程[14]:
指数形式为:K=Ae-E/RT;
式中:K——速度常数;
E——活化能;
T——温度;
A——频率因子;
R——气体常数。
此方程定量地描述了温度与反应速度之间的关系。可运用若干个温度梯度进行加速氧化试验,通过回归计算,测出不同温度下的速度常数,以lgK对1/T作图得一直线,直线斜率为-E/2.303R,故可计算出活化能E,若将直线外推至室温,就可求出室温时的速度常数和货架寿命[15-16]。对于正常的化学反应,反应温度每升高10℃,反应速度升高1倍,即:

而反应速度常数与货架期成反比,即反应速度常数越大,货架期越小[17],因此


表2 温度与货架期的关系
由表2中的数据可知,65℃的1 d相当于25℃贮存16 d,因此可以根据花生油65℃的诱导期可预测它们在25℃的货架期。

表3 花生油的货架期预测
从表3可以看出,添加各种醇提物后,花生油的过氧化值均低于空白对照,诱导时间均大于空白对照,说明各种醇提物对花生油有一定的抗氧化作用,均能延缓油脂的酸败诱导期。
3 结论
甘草醇提物、枸杞醇提物和黄芪醇提物对自由基都有一定的清除能力,这3种醇提物对花生油的酸败也都有一定的预防作用,其中甘草醇提物的效果最好。虽然甘草醇提物效果比合成抗氧化剂BHT效果差,但天然抗氧化剂比较健康、安全,在实际应用中可以考虑增加添加量以达到与合成抗氧化剂相同的效果,最终达到延长货架期的目的。

