DKK1对乳腺癌细胞迁移侵袭能力影响的研究*
王学涵 王福刚 田 刚
DKK1对乳腺癌细胞迁移侵袭能力影响的研究*
王学涵①王福刚②田 刚③
目的:探讨Dikkopf 1(DKK1)对乳腺癌细胞迁移侵袭能力的影响。方法:采用免疫组织化学方法检测DKK1在乳腺癌组织中的表达,并通过免疫荧光对DKK1在细胞中的定位进行分析;DKK1过表达的真核表达载体转染乳腺癌细胞MDA231,应用Western blot检测转染后乳腺癌细胞MDA231中DKK1蛋白表达水平。划痕实验检测转染后MDA231细胞的迁移能力,Transwell实验检测MDA231细胞侵袭能力的改变。结果:免疫组织化学检测到乳腺癌组织原发病灶及转移病灶DKK1表达明显高于对应的癌旁组织(P<0.05)。DKK1表达的阳性率在有淋巴结转移组织中明显比无淋巴结转移组织中低。免疫荧光结果显示DKK1主要呈细颗粒状散在分布于细胞质中。Western blot检测表明DKK1过表达明显。过表达DKK1的MDA231细胞迁移和侵袭能力明显比阴性对照组和空白组低。结论:DKK1的表达与乳腺癌细胞迁移和侵袭能力呈负相关。
乳腺癌 DKK1迁移 侵袭
乳腺癌是严重影响妇女健康的重大疾病,其发病率和死亡率已升至妇女恶性肿瘤的第2位。乳腺癌转移是影响患者预后的主要因素,如何抑制癌细胞的扩散已成为各国学者研究的热点。Dikkopf家族包括4个成员,其中Dikkopf1(DKK1)是一种分泌性糖蛋白,且能抑制Wnt/β-catenin信号通路的转导[1],其在肿瘤进程中的作用已引起广泛关注,DKK1在肝癌、乳腺癌、胶质瘤和骨髓瘤中有不同的表达,与肿瘤致病机制的关系还有待进一步探讨[2-3]。本研究就其在乳腺癌迁移侵袭中的作用进行一些有意义的探讨,现报告如下。
1 材料与方法
1.1 材料
1.1.1 组织标本、细胞系和质粒 选取新疆医科大学第五附属医院2006年3月至2010年4月乳腺癌手术病例31例,取材包括癌组织,癌旁组织及转移淋巴结。乳腺癌细胞株MDA231由上海生物细胞所提供。pCMV Tag-2b-DKK1和pCMV-Tag-2b由本研究构建。
1.1.2 主要试剂 RPMI 1640、新生小牛血清(NBS)及Lipofectmine2000购自Gibco公司;DKK1兔抗人单克隆抗体及兔抗人β-actin多克隆抗体购自Invitrogen公司;Boyden小室、Transwell小室均购自美国Millipore公司。
1.2 方法
1.2.1 细胞培养 乳腺癌MDA231细胞使用含10% NBS、100 μg/mL链霉素、100 U/mL青霉素的RPMI 1640培养。细胞进入对数生长期后,使用PBS清洗2次,0.25%胰酶消化,接种到6孔板内继续培养备用[4]。1.2.2 免疫组织化学和免疫荧光检测DKK1表达1)免疫组织化学操作按试剂盒说明。用已知阳性切片(乳腺癌)为阳性对照,阴性对照片采用PBS代替一抗。染色结果由2名病理科医生采用双盲原则评定。浅黄至棕黄色为阳性细胞[5]。2)免疫荧光操作按试剂盒说明。含有3%BSA的PBS一抗(1:200稀释),室温下孵育60 min后使用PBS洗5 min×3次,罗丹明标记的二抗在室温下反应60 min进行染色,再使用PBS洗5 min×3次,用DAPI对细胞核进行染色,最后在激光共聚焦显微镜下进行观察[6]。
1.2.3 重组质粒转染 转染pCMV Tag-2b-DKK1(实验组)、pCMV-Tag-2b(阴性对照组)和不转染载体(空白对照组)后,置37°C,5%CO2孵化箱内培养6 h后,换成普通的RPMI 1640+10%FBS培养液;细胞转染24 h后传代;细胞贴壁后加入Hygromycin B筛选[7]。
1.2.4 Western blot检测DKK1的表达 乳腺癌细胞培养进入对数生长期,向反应板加入RIPA裂解细胞液(300 μL/孔,其中PMSF浓度为0.1%),冰上裂解30 min后,将其收集在1.5 mL EP管中,4℃下15 000 r/min离心15 min,将上清液转移至另一灭菌EP管中,BCA法测定蛋白浓度。每个样品取50 μg蛋白进行检测,用10%SDS-PAGE胶进行电泳,蛋白电转到PVDF膜上;5%脱脂奶粉4℃过夜封闭,用DKK1的兔抗人单克隆一抗(1:1 000)室温下孵育2 h,再用过氧化物酶标记的羊抗兔二抗(1:5 000稀释)室温下孵育30 min,以β-actin为内参,采用Bandscan 5.0软件分析蛋白条带总灰度值,检测表达差异。
1.2.5 细胞迁移能力实验 6孔培养板接种5×105/孔细胞孵育过夜,待底层长满细胞后,每隔0.5~1 cm用无菌移液枪头划均匀直线一道。用PBS冲洗去除划落细胞,加入无血清培养基。放入37℃、5%CO2培养箱中分别于0和24 h观察划痕处细胞愈合距离,最后在激光共聚焦显微镜下拍照[8]。
1.2.6 细胞侵袭能力实验 冰上将Matrigel胶与无血清的DMEM培养基以1:5比例稀释,然后在12孔Transwell小室中加入120 uL/孔,然后置于37℃孵育1 h使基质胶凝固。消化重悬细胞并调整细胞浓度为5×105/mL,将400 uL细胞悬液加入Transwell小室,下室中加入800 uL含10%血清的培养基,37℃孵育48 h后,小心去掉Matrigel胶,擦去未穿过膜的细胞,4% PFA固定10 min,采用0.005%结晶紫染色40 min,显微镜下观察透过膜的细胞数(×200),随机取5个视野计数取平均值[9]。
2 结果
2.1 DKK1在乳腺癌中的表达和分布
通过免疫组织化学分析了临床手术切除的乳腺癌标本中DKK1表达情况,高倍镜下观察到胞核中显像棕黄色颗粒为阳性。根据着色深浅分4种强度:深棕色为强阳性(+++),棕黄色为阳性(++),浅黄色为弱阳性(+),无着色为阴性(-)。癌旁组织中阳性例数4例,癌组织中阳性例数27例,无淋巴转移组织中阳性例数20例。乳腺癌原发病灶及转移病灶DKK1表达明显高于对应的癌旁组织(P<0.05)。有淋巴结转移组织中DKK1表达的阳性率明显比无淋巴结转移组织中的阳性率低(χ2=28.36,P<0.01)。可见DKK1的表达与乳腺癌是否转移,特别是淋巴结转移相关。免疫荧光检测乳腺癌MDA231细胞中DKK1的表达,结果显示DKK1主要分布在细胞质中,呈细颗粒状散在分布(图1)。
2.2 Western blot检测MDA231细胞的DKK1过表达水平
MDA231细胞转染pCMV Tag-2b-DKK1(实验组)、pCMV-Tag-2b(阴性对照组)和不转染载体(空白对照组)后,结果表明DKK1在实验组表达明显增高。
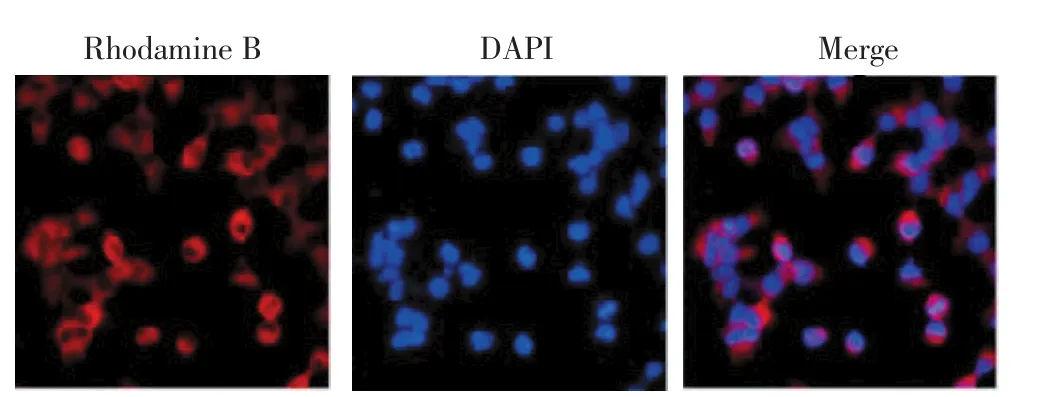
图1 DKK1在乳腺癌细胞中的分布Figure 1 Distribution of DKK1 in breast cells
2.3 过表达DKK1的MDA231细胞迁移能力变化
24 h后,阴性对照组和空白对照组细胞的划痕几乎完全愈合,而实验组的细胞愈合明显落后,即低表达DKK1的MDA231细胞迁移能力显著下降。
2.4 过表达DKK1的MDA231细胞侵袭能力变化
通过Transwell小室检测MDA231细胞转染低表达DKK1的重组质粒后细胞侵袭能力的改变。结果显示:转染pCMV-Tag-2b-DKK1的乳腺癌细胞通过Transwell小室基底膜的细胞数(40个/高倍视野)明显低于转染pCMV-Tag-2b组(200个/高倍视野)和空白对照组(209个/高倍视野)细胞数,表明过表达DKK1的MDA231细胞侵袭能力受到抑制。
3 讨论
Wnt/β-catenin是Wnt经典信号通路,通路活化过程是胞外Wnt蛋白与相应的受体结合抑制了糖原合成激酶降解复合物形成,从而抑制β-catenin磷酸化,继而激活其下游靶分子而发挥一系列功能作用[10-11]。DKK1是一种分泌性糖蛋白,能够与细胞膜上的Wnt受体LRP5和DKK1共受体Kremen1结合,形成内吞小体,从而阻断Wnt信号通路[12-13]。可见DKK1发挥生物学效应与抑制Wnt通路有关。肿瘤细胞的迁移侵袭能力制约是其杀灭的关键。国内有学者证实在高迁移的乳腺癌细胞DKK1的表达降低,低迁移的乳腺癌细胞DKK1表达有升高趋势[14]。国外有文献报道DKK1表达缺失具有促进肿瘤细胞转移的作用[15]。本研究的结果发现过表达DKK1的乳腺癌细胞“伤口愈合”能力明显降低,且乳腺癌细胞的侵袭能力也明显受到抑制。本研究所得结论与国内外学者报道相符。
本研究通过免疫组织化学方法对乳腺癌组织患者的标本进行DKK1表达观察发现,乳腺癌组织DKK1表达高于相应的癌旁组织,且有淋巴结转移的乳腺癌组织DKK1的表达明显低于无淋巴结转移的乳腺癌组织。这一点也充分表明DKK1的表达与乳腺癌远端转移能力呈负相关。可见DKK1作为Wnt通路的抑制因子,可通过抑制β-catenin的表达而遏制肿瘤细胞的迁移和侵袭。高表达DKK1可促进乳腺癌细胞的静息程度。免疫荧光检测DKK1在乳腺癌细胞中主要分布于细胞质,呈细颗粒状散在分布,符合DKK1是分泌性蛋白的称谓,其分布位置和特点为深层次研究DKK1在肿瘤侵袭中的作用提供了重要的依据。
总之,本研究为进一步揭示Wnt/β-catenin通路与乳腺癌侵袭转移的关系奠定了一定的实验参考。
1 Yu B,Yang X,Xu Y,et al.Elevated expression of DKK1 is associated with cytoplasmic/nuclear beta-catenin accumulation and poor prognosis in hepatocellular carcinomas[J].J Hepatol,2009,50(5): 948-957.
2 Hirata H,Hinoda Y,Nakajima K,et al.Wnt antagonist DKK1 acts as a tumor suppressor gene that induces apoptosis and inhibits proliferation in human renal cell carcinoma[J].Int J Cancer,2010,55 (9):1012-1015.
3 Takahashi N,Fukushima T,Yorita K,et al.Dickkopf-1 is overexpressed in human pancreatic ductal adenocarcinoma cells and is involved in invasive growth[J].Int J Cancer,2010,126(7):1611-1620.
4 Tian G,Wang X,Zhang F,et al.Down-regulation of cPLA2γ expression inhibits EGF-induced chemotaxis of human breast cancer cells through Akt pathway[J].BBRC,2011,409(3):506-512.
5 阳泽斌,田 刚,孙 杨,等.磷脂酶C-γ1(PLC-γ1)在乳腺癌组织中表达及其对细胞运动作用的研究[J].现代检验医学杂志,2011,26(3): 90-92.
6 李书军,和宇峥,吕宝雷,等.DKK1在食管癌组织中的表达及其生物学功能[J].世界华人消化杂志,2011,19(20):2116-2122.
7 李书军,和宇峥,闫红红,等.siRNA沉默artermin蛋白对食管癌TE11细胞侵袭能力的影响[J].中国肿瘤临床,2010,37(24):1432-1436.
8 王洪玉,郭立莎,吴 敏,等.EHD2干扰影响永生化乳腺上皮细胞的增殖和迁移[J].中国肿瘤临床,2011,38(11):601-604.
9 田 刚,王学涵,应国光,等.EHD2下调促进乳腺上皮细胞转化的研究[J].现代检验医学杂志,2012,27(1):88-90.
10姜 博,廉永云.DKK1蛋白的研究现状进展及临床意义[J].医学与哲学,2012,33(1):101-103.
11 Mao B,Wu W,Davidson G,et al.Kremen proteins are Dickkopf receptors that regulate Wnt/beta-catenin signalling[J].Nature,2002, 417(6889):664-667.
12 Makale M.Cellular mechanobiology and cancer metastasis[J].Birth Defects Res C Embryo Today,2007,81(4):329-343.
13 Heider U,Kaiser M,Mieth M,et al.Serum concentrations of DKK-1 decrease in patients with multiple myeloma responding to anti-myeloma treatment[J].Eur J Haematol,2009,82(1):31-38.
14周晓雷,张晓东,业丽红.DKK1通过上调nm23表达抑制乳腺癌细胞迁移[J].中国生物化学与分子生物学报,2010,26(2):164-169.
15 Yao X,Jiang H,Zhang C,et al.Dickkopf-1 autoantibody is a novel serological biomarker for non-small cll lung cancer[J].Biomarkers,2010,15(2):128-134.
(2013-07-15收稿)
(2013-09-03修回)(本文编辑:周晓颖)
Effects of DKK1 on breast cancer cell migration and invasion capability
Xuehan WANG1,Fugang WANG2,Gang TIAN3
Gang TIAN;E-mail:tiangang_chn@126.com
1Department of Clinical Laboratory,FifthAffiliated Hospital of Xinjiang Medical University,Urumqi 830011,China
2Department of Clinical Laboratory,People's Hospital of Kelamayi,Kelamayi 834000,China
3Department of Clinical Laboratory,Tianjin Gong'an Hospital,Tianjin 300040,China
Objective:To analyze the DKK1 expression in breast cancer cell line MDA-MB-231 and examine its effect on the migration and invasion of the cell line.Method:DKK1 expression in the breast cancer tissues was detected immunohistochemically,and DKK1 distribution in the breast cancer cells was observed using immunofluorescence.Western blot was used to investigate DKK1 expression in breast cancer tissues and their matched normal breast tissues.A eukaryotic expression vector of DKK1 was constructed and transfected into MDA231 cell line.The migration and invasion ability of the cells were observed through scratch assay and Boyden chamber,respectively.Results:Immunohistochemical staining showed that DKK1 in the transfected lymph node or non-lymph node was highly expressed in the breast cancer tissues(P<0.05).The positive DKK1 expression in lymph node metastasis was less significant than those in non-lymph node transfected cells.Immunofluorescence localization results showed a remarkable bright red granular fluorescence in the cytoplasm of the MDA231 cell line.Western blot analysis showed that the DKK1 protein expression in carcinoma tissues were obviously higher than that in matched normal breast tissues.The migration and invasion ability of DKK1-overexpressed MDA231 cell was lower than those of MDA231 cell transfected with pCMV-Tag-2b empty vector.Conclusion:Negative correlation was found between DKK1 expression and the migration and invasion ability in breast cancer cells.
breast cancer,DKK1,migration,invasion
10.3969/j.issn.1000-8179.20131491
①新疆医科大学第五附属医院检验科(乌鲁木齐市830011);②新疆克拉玛依市人民医院检验科;③天津市公安医院检验科
*本文课题受天津市滨海新区卫生局科研基金项目(编号:2100BHKL004,2100BHKY023)资助
田刚 TIANGANG_CHN@126.COM
This work was supported by the Scientific Research Funds of Tianjin Binhai Prefectural Municipal Bureau of Health(Nos. 2100BHKL004 and 2100BHKY023)

