缺陷型及非缺陷型首发精神分裂症患者听觉感觉门控P50的对照研究☆
李喆 邓伟 林鄞李名立 李寅飞 刘祥 郑重 李涛
缺陷型及非缺陷型首发精神分裂症患者听觉感觉门控P50的对照研究☆
李喆*邓伟*林鄞*李名立*李寅飞*刘祥*郑重**李涛
目的 探讨缺陷型与非缺陷型首发精神分裂症患者听觉感觉门控P50的特征及与临床特征的相关性。方法 运用条件(S1)-测试(S2)刺激模式检测60例非缺陷型首发精神分裂症患者(非缺陷组)、47例缺陷型首发精神分裂症患者(缺陷组)及60名正常对照(对照组)的P50,并比较三组间差异;采用阳性和阴性症状量表(Positive and Negative Syndrome Scale,PANSS)评估患者精神症状,大体功能评定量表(Global Assessment of Functioning Scale,GAF)评定患者社会、职业和心理功能的总体功能水平。控制性别等因素,偏相关分析非缺陷组及缺陷组P50同临床特征的关系。结果 缺陷组的S2-P50波幅(3.76±1.69)较非缺陷组(2.16±1.20)和对照组(2.13±0.94)增高(P<0.01);而与后两组分别比较,缺陷组的S2/S1波幅比增高[缺陷组(0.82±0.11)vs.非缺陷组(0.43±0.10)vs.对照组(0.40±0.06)](P<0.01),S1-S2波幅差值[缺陷组(0.78±0.49)vs.非缺陷组(2.77±1.49)vs.对照组(3.19±1.18)]和P50抑制度[缺陷组(17.59±10.58)vs.非缺陷组(57.32±9.79)vs.对照组(60.41±5.79)]均降低(P<0.01)。偏相关分析显示,缺陷组的S2-P50波幅与其PANSS总分(r=0.40,P=0.01)和阴性量表分(r=0.33,P=0.02)呈正相关,而S1-P50波幅与其PANSS总分(r=-0.39,P=0.01)呈负相关;缺陷组的P50抑制指标同临床特征均无相关性(P>0.05);而非缺陷组的S1-P50波幅、S2-P50波幅,S1-P50潜伏期、S2-P50潜伏期及P50抑制指标的三种表达式与临床特征相关性均无统计学意义(P>0.05)。结论 精神分裂症缺陷型存在听觉感觉门控P50的抑制缺陷,而非缺陷型无此损害,两类亚型可能存在不同神经病理机制;P50抑制可能是缺陷型精神分裂症的素质性标记。
精神分裂症 缺陷型 非缺陷型 感觉门控 听觉P50电位
感觉门控(sensory gating,SG)是人脑的一种正常抑制功能,可以保护大脑对有意义刺激信息的敏感性[1]。感觉门控诱发电位P50是定量测定SG的常用方法。大量研究发现[1-2],精神分裂症患者存在SG P50缺陷,但其SG P50同临床特征是否存在相关性以及缺损可能机制的研究结果不一致[3],可能与精神分裂症有很高异质性有关。目前研究显示[4],不同诊断亚型可以影响感觉门控P50,但是目前的分型方法仍然存在一定异质性,导致结果很难重复[5]。随着生物学研究的深入,近年来,Carpenter等[6]提出的缺陷型和非缺陷型精神分裂症分型方法受到关注,研究提示具有突出的原发性阴性症状的缺陷型精神分裂症亚型可能同质性更高[7]。目前国外对于两类精神分裂症亚型感觉门控P50的比较研究,主要为慢性稳定期或服药的患者,无法排除药物的影响[8-9]。而目前国内尚未见两类精神分裂症亚型感觉门控P50的研究报道,本研究将初步探索缺陷型与非缺陷型首发精神分裂症的感觉门控P50特征及其与临床特征相关性。
1 对象与方法
1.1 研究对象来自2007年1月至2011年12月期间于四川大学华西医院心理卫生中心住院或门诊就诊的首发精神分裂症患者。纳入标准:①符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and statistic manual of mental disorder-IV,DSM-IV)精神分裂症或分裂样精神障碍诊断标准;②16~45岁;③右利手,汉族,小学毕业或以上文化程度;③首次发病,从未用过任何抗精神病药、抗抑郁药、苯二氮䓬类或其他影响中枢神经系统的药物;④若入组时诊断为分裂样精神障碍患者,需进行6个月的随访,在随访过程中明确为精神分裂症的诊断。排除标准:①患神经系统疾病、严重的内分泌或代谢性疾病等明显躯体疾病;②伴有其他DSM-IV轴I、II疾病(心境障碍、物质有关的障碍、精神发育迟滞等)。共纳入107例首发精神分裂症患者。采用中文版缺陷型精神分裂症诊断量表(the Schedule for the Deficit Syndrome,SDS)[10-11]将患者分为缺陷型和非缺陷型。缺陷组47例,男 24例,女 23例;年龄 17~43岁,平均(26.12±7.35)岁;受教育年限4~18年,平均(11.34±3.17)年;病程1~75个月,中位数13个月;发病年龄13~40岁,平均(24.67±8.39)岁。非缺陷组60例,男28例,女32例;年龄16~41岁,平均(25.12±6.53)岁;受教育年限5~17年,平均(11.79±4.27)年;病程1~73个月,中位数9个月;发病年龄15~39岁,平均(23.87±6.24)岁。
对照组来自社区及广告募集的志愿者。由受过专业培训的精神科医生行DSM-IV用定式临床接谈工具(非病人版)(Structured Clinical Interview for DSM-IV,Non-Patient Version,SCID-NP)筛查。纳入标准:①16~45岁;②右利手、汉族、小学毕业以上文化,成都市五城区生活3年以上的健康公民;③从未患任何精神疾病;④精神疾病家族史阴性。排除标准:同患者组。共纳入60名对照,男29名,女31名;年龄17~42岁,平均(25.69±5.74)岁;受教育年限6~16年,平均(12.13±2.54)年。
所有受试者均为右利手,三组在性别(χ2=1.512)、年龄(F=1.587)、受教育年限(F=0.281)方面差异均无统计学意义(均P>0.05);两组患者病程(Z=-0.753)、发病年龄(F=0.120)差异均无统计学意义(均P>0.05)。所有患者或其监护人及对照均对本研究知情同意并签署知情同意书,本研究获得四川大学华西医院伦理委员会审核批准。
1.2研究方法
1.2.1 患者精神障碍的诊断及临床特征的评估 在研究对象入组后3天内,由受过专业培训的精神科医生采用DSM-IV用定式临床接谈工具(病人版)(Structured Clinical Interview for DSM-IV,Patient Version,SCID-P),评定受试者精神状况后明确精神分裂症的诊断。同时采用阳性和阴性症状量表(Positive and Negative Syndrome Scale,PANSS)评估患者的疾病严重程度,并采用大体功能评定量表(Global Assessmentof Functioning Scale,GAF)评定患者的社会、职业和心理的总体功能水平。
1.2.2 感觉门控P50检测 在研究对象入组后3天内,采用Nihon Kohden公司生产的MEB-9200肌电图/诱发电位仪对所有被试的感觉门控P50进行检测。测定程序采用MEB-9200自定义编辑建立独立 的 Auditor-P50 项 目 。 灵 敏 度(amplifier)为50uV/div,采样分析时间(acquisition)为30ms/div;触发(Trigger)频率0.1Hz,其中条件(S1)延迟0ms,测试(S2)延迟500ms,构成刺激间隔(inter-stimulus interval,ISI)为500ms的S1-S2成对短声(click)刺激,每组成对刺激的间隔为10s,左右耳刺激声压为105dB nHL,声音极性(phase)为交替(alter),刺激声时程(druation)为0.1ms,最后叠加16组S1-S2系列。电极安置参照国际脑电图学会10/20系统,记录电极置于中央顶部(Cz点),参考电极并联后置于双耳后乳突(A1、A2点),前额(FPz点)接地,电极电阻<5kΩ。检测在安静的电生理检查室进行,受试者取平卧位、闭目放松、保持清醒并集中注意力。分析指标包括:①S1-P50波幅和潜伏期;②S2-P50波幅和潜伏期;③反映感觉门控P50抑制功能指标的三种表达式:S1-P50、S2-P50 波幅比(S2/S1),S1-P50 和 S2-P50 波幅差(S1-S2),P50抑制度100(1-S2/S1)。
1.3 统计学方法 所有资料采用SPSS 15.0进行统计分析。三组的性别比较采用χ2检验,缺陷与非缺陷组的病程比较采用Mann-Whiteny U非参数检验,其余一般人口学资料以及P50相关指标的比较使用单因素方差分析,Bonferroni法进行组间两两比较;控制性别、年龄、受教育年限,采用偏相关分析P50与临床特征之间的相关性。检验水准α为0.05,双侧检验。
2 结果
2.1 患者的疾病严重程度以及社会、职业和心理功能的总体功能水平比较 缺陷组与非缺陷组比较,缺陷组的PANSS总分(F=4.996,P=0.021)、阴性量表分(F=89.541,P<0.01)均高于非缺陷组;缺陷组的GAF(F=8.867,P<0.01)低于非缺陷组,差异均有统计学意义。见表1。
2.2 三组感觉门控P50的比较三组间比较,S2-P50波幅(F=27.38,P<0.01)、P50抑制指标的三种表达式 S2/S1波幅比(F=70.87,P<0.01)、S1-S2波幅差值(F=62.23,P<0.01)、P50抑制度 100(1-S2/S1)(F=70.87,P<0.01)差异均有统计学意义。而两两比较,缺陷组的S2-P50波幅较非缺陷组(P<0.01)和对照组(P<0.01)均增高,缺陷组的S2/S1波幅比较非缺陷组(P<0.01)和对照组(P<0.01)均增高,缺陷组的S1-S2波幅差值较非缺陷组(P<0.01)和对照组(P<0.01)均降低,缺陷组的P50抑制度 100(1-S2/S1)较非缺陷组(P<0.01)和对照组(P<0.01)均降低,差异均有统计学意义。见表2。
表1 患者PANSS及GAF评分的比较(±s)

表1 患者PANSS及GAF评分的比较(±s)
1)与非缺陷组比较,经单因素方差分析,P<0.05
n组别缺陷组非缺陷组47 60 PANSS总分95.8±14.11)88.7±15.8 PANSS阳性症状分21.2±6.3 22.5±5.2 PANSS阴性症状分28.3±6.11)17.3±4.9 PANSS一般精神病理47.1±9.5 48.3±8.2 GAF 27.1±5.31)31.9±9.5
2.3 缺陷组的感觉门控P50与临床特征之间的相关性 S2-P50波幅与 PANSS总分(r=0.40,P=0.01)和阴性量表分(r=0.33,P=0.02)正相关,S1-P50波幅与PANSS总分(r=-0.39,P=0.01)负相关;而P50抑制指标的三种表达式与临床特征相关性无统计学意义(P>0.05)。见表3。
2.4 非缺陷组的感觉门控P50与临床特征之间的相关性 S1-P50波幅、S2-P50波幅,S1-P50潜伏期、S2-P50潜伏期及P50抑制指标的三种表达式与临床特征相关性均无统计学意义(P>0.05)。见表4。
表2 三组感觉门控P50的比较(±s)
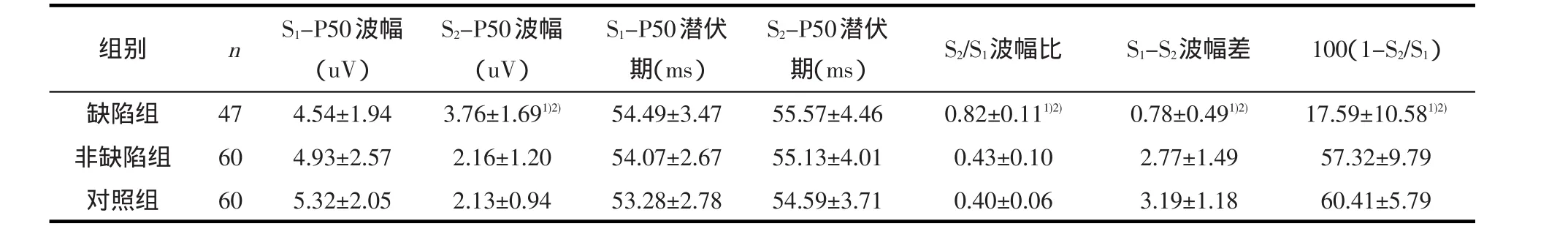
表2 三组感觉门控P50的比较(±s)
1)与非缺陷组比较,经Bonferroni检验,P<0.05;2)与对照组比较,经Bonferroni检验,P<0.05
n组别缺陷组非缺陷组对照组47 60 60 S1-P50波幅(uV)4.54±1.94 4.93±2.57 5.32±2.05 S2-P50波幅(uV)3.76±1.691)2)2.16±1.20 2.13±0.94 S1-P50潜伏期(ms)54.49±3.47 54.07±2.67 53.28±2.78 S2-P50潜伏期(ms)55.57±4.46 55.13±4.01 54.59±3.71 S2/S1波幅比0.82±0.111)2)0.43±0.10 0.40±0.06 S1-S2波幅差0.78±0.491)2)2.77±1.49 3.19±1.18 100(1-S2/S1)17.59±10.581)2)57.32±9.79 60.41±5.79
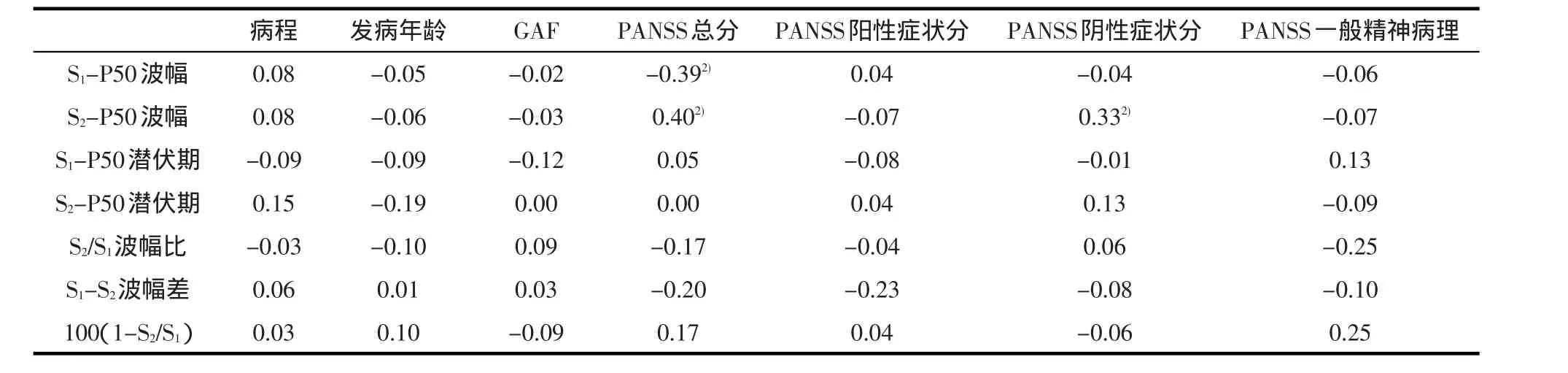
表3 缺陷组的感觉门控P50同临床特征之间的相关性(r)1)
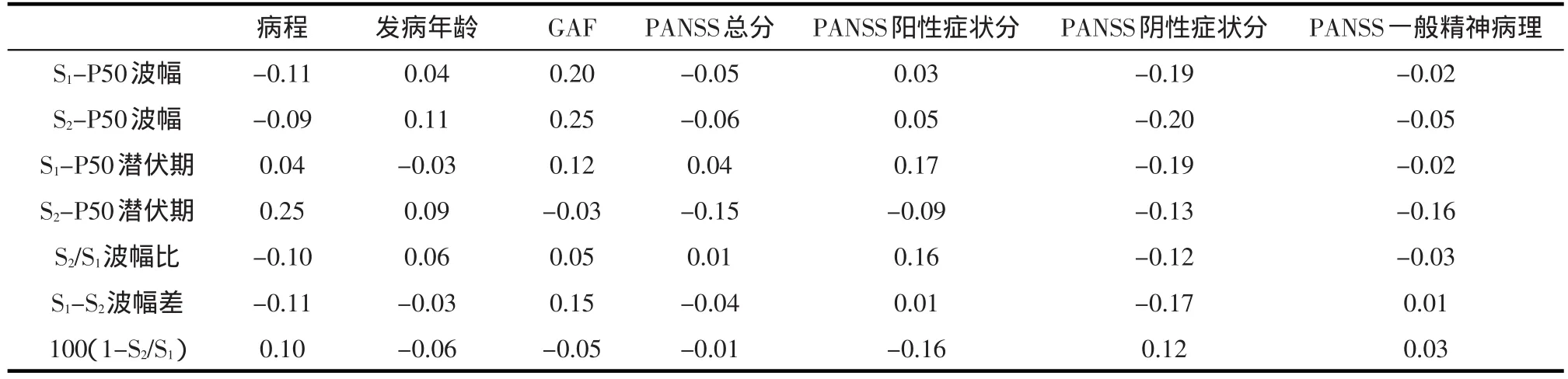
表4 非缺陷组的感觉门控P50同临床特征之间的相关性(r)1)
3 讨论
尽管荟萃分析发现精神分裂症患者存在感觉门控P50缺陷[12],但是该疾病具有很高异质性,因此,研究结果不一致[5]。而通过区分亚型可以一定程度降低异质性。Carpenter等[6]提出的缺陷型和非缺陷型精神分裂症的分型方法,强调前者主要临床特点是阴性症状持续存在,而且是首要的或原发的,并非继发于焦虑、抑郁、幻觉、妄想、思维障碍或药物因素等,而且在临床稳定期这类症状仍然存在,这在一定程度上提高了研究对象的同质性。
本研究中,同对照组比较,缺陷组患者表现出了感觉门控P50的缺陷,而非缺陷组并未表现出感觉门控P50的缺陷。有运用P300研究也发现,缺陷型患者主要表现为N1成分的异常,而非缺陷型患者主要表现为P3成分的异常,并认为缺陷型可能表现为注意信息处理的早期阶段异常,而非缺陷型可能是晚期阶段的异常[13]。另有研究发现,N1成分的异常与阴性认知维度的缺损有关[14]。由于P50是出现于35~90ms之间的诱发电位成分,主要反应信息处理的前注意阶段[1],本研究结果也提示两类亚型可能存在不同的注意缺损机制。本研究发现,尽管缺陷组较非缺陷组患者的疾病严重程度更重,但偏相关分析提示,两组感觉门控P50的缺陷与其疾病严重程度之间均无相关性,这也提示,两组患者之间表现出的感觉门控P50的差异并不是由病情严重程度不同导致的,这与多数针对精神分裂症的研究结果一致[8,19]。两组之间的差异可能是由其固有的神经病理缺损导致,但还需要进一步的研究证实。另外,脑源性分布发现,感觉门控P50的发生可能来源于前额叶背外侧皮质、颞上回和丘脑[15]。本研究中仅缺陷组患者表现出了感觉门控P50的缺陷,因此,也提示上述脑区可能是缺陷型患者的中枢独立受损区域。但另有研究发现,缺陷与非缺陷患者均存在感觉门控P50的缺陷[8-9],结果与本研究不一致,可能与样本量以及研究纳入均为服药的患者有关。
目前大量研究发现,精神分裂症患者的感觉门控P50抑制与疾病严重程度和临床特征无关[16-19]。家系研究也发现,无论是首发精神分裂症还是其健康一级亲属均存在感觉门控P50抑制缺陷,认为P50抑制可能是精神分裂症的遗传素质指标[3,20]。本研究结果也提示缺陷组的感觉门控P50的抑制独立于疾病严重程度和临床特征之外,可能是其素质性标记。
目前,针对P50抑制缺陷是由于S1-P50波幅降低还是S2-P50波幅增高,或者二者同时存在,存在较多争议[16,19-21]。本研究偏相关分析发现,缺陷组的S2-P50波幅与PANSS阴性症状分正相关,而S1-P50波幅与PANSS总分负相关,由于缺陷型精神分裂症患者的阴性症状是原发的,持续稳定存在,而且大量研究也发现,无论是典型还是非典型抗精神病药物对精神分裂症原发的阴性症状均无效[8-9]。因此,提示缺陷型精神分裂症患者感觉门控P50抑制的缺陷在早期可能是由于S1-P50波幅降低和S2-P50波幅增高的共同作用。而在后期,S1-P50波幅可能会逐渐恢复正常,但是S2-P50波幅可能会持续增高,从而导致缺陷型精神分裂症患者感觉门控P50抑制缺陷持续存在,因此,我们也认为S2-P50波幅更可能是缺陷型精神分裂症患者的素质性标记。关于P50潜伏期成分的研究发现,慢性稳定期的精神分裂症存在S1-P50潜伏期的延长[8,21],但是首发精神分裂症并未表现出相应延长[19-20]。另有研究发现[8],抗精神病药物会延长精神分裂症的S1-P50潜伏期。因此,本研究中缺陷组的P50潜伏期未表现出延长,可能与患者为首发未服用抗精神病药物有关。
本研究也存在一定不足,样本量偏小,仅为横断面研究,诱发电位指标单一。下一步需要扩大样本量,并对感觉门控P50成分以及抑制指标进行纵向随访,以明确其可能的变化规律以及作为素质性标记的可能性,同时联合反映不同心理活动阶段和过程的多种诱发电位指标,更全面了解两类亚型的神经病理机制。
[1]Sánchez-Morla EM,Santos JL,Aparicio A,et al.Neuropsychological correlates of P50 sensory gating in patients with schizophrenia[J].Schizophr Res,2013,143(1):102-106.
[2]Olincy A,Braff DL,Adler LE,et al.Inhibition of the P50 cerebral evoked response to repeated auditory stimuli:Results from the Consortium on Genetics of Schizophrenia[J].Schizophr Res,2010,119(1-3):175-182.
[3]Dalecki A,Croft RJ,Johnstone SJ,et al.An evaluation of P50 paired-click methodologies[J].Psychophysiology,2012,48(12):1692–1700.
[4]Patterson JV,Hetrick WP,Boutros NN,et al.P50 sensory gating ratios in schizophrenics and controls:a review and data analysis[J].Psychiat Res,2008,158(2):226-247.
[5]Louchart-de la CS,Levillain D,Menard JF,et al.P50 inhibitory gating deficit is correlated with the negative symptomatology of schizophrenia[J].Psychiat Res,2005,136(1):27-34.
[6]Carpenter Jr WT,Heinrichs DW,Wagman AMI.De fi cit and non-defi cit forms of schizophrenia:the concept[J].Am JPsychiatry,1988,145(5):578-583.
[7]Kirkpatrick B,Buchanan RW,Breier A,et al.Case identifi cation and stability of the deficit syndrome of schizophrenia[J].PsychiatRes,1993,47(1):47-56.
[8]Santos JL,Sánchez-Morla EM,Aparicio A,et al.P50 gating in deficit and nondeficit schizophrenia[J].Schizophr Res,2010,119(1-3):183-190.
[9]Arango C.Neurobiological substrates in deficit and non deficit schizophrenia[J].Eur Psychiat,2011,26,(1):2069.
[10]王湘,姚树桥,樊旭辉,等.缺陷型精神分裂症诊断量表中文版的信效度研究[J].中国临床心理学杂志,2005,13(4):392-395.
[11]Kirkpatrick B,Buchanan RW,McKenney PD,et al.The Schedule for the Deficit Syndrome:an instrument for research in schizophrenia[J].Psychiat Res,1989,30(2):119-123.
[12]deWilde OM,Bour LJ,Dingemans PM,et al.A meta-analysis of P50 studies in patients with schizophrenia and relatives:differences in methodology between research groups[J].Schizophr Res,2007,97(1-3):137-151.
[13]Mucci A,Galderisi S,Kirkpatrick B,et al.Double dissociation of N1 and P3 abnormalities in defi citand nondefi cit schizophrenia[J].Schizophr Res,2007,92(1-3):252-261.
[14]Boutros NN,Broskhaus DA,Gjini K,et al.Sensory-gating de fi cit of the N100 mid-latency auditory evoked potential in medicated schizophrenia patients[J].Schizophr Res,2009,113(2-3):339-346.
[15]Williams TJ,Nuechterlein KH,Subotnik KL,etal.Distinctneural generators of sensory gating in schizophrenia[J].Psychophysiology,2011,48(4):470-478.
[16]Szendi I,Racsmány M,Cimmer C,et al.Two subgroups of schizophrenia identified by systematic cognitive neuropsychiatricmapping[J].Eur Arch Psy Clin N,2010,26(3):257-256.
[17]Thaker GK.Neurophysiological endophenotypes across bipolar and schizophrenia psychosis[J].Schizophrenia Bull,2008,33(4):760-773.
[18]Sanchez-Morla EM,Garcia-Jimenez MA,Barabash A,et al.P50 sensory gating deficit is a common marker of vulnerability to bipolar disorder and schizophrenia[J].Acta Psychiat S cand,2008,117(4):313-318.
[19]王俊清,叶兰仙,许崇涛.首发精神分裂症的P50感觉门控与临床症状的关系[J].中国神经精神疾病杂志,2010,36(10):607-611.
[20]万晓娜,蒋廷云,江丽云,等.首发精神分裂症患者及其一级亲属感觉门控P50研究[J].中国神经精神疾病杂志,2007,33(9):544-547.
[21]王东,朱孔美,谭淑平,等.稳定期慢性精神分裂症患者听觉感觉门控诱发电位P50特点[J].中国心理卫生杂志,2011,25(7):556-560.
P50 auditory sensory gating in first episode deficit and non-deficit schizophrenia.
LIZhe,DENGWei,LIN Yin,LIMingli,LIYinfe,LIU Xiang,ZHENG Zhong,LITao.The Mental Health Center,West China Hospital,Sichuan University,28Dianxin Nan Road,Chengdu 610041.China.Tel:028-85422633.
ObjectiveTo detect the P50 auditory sensory gating in the firstepisode deficitand non-deficitschizophrenia and the relationship between P50 and clinical variables.MethodsN ihon Kohden evoked brain potentialsmachinewere used tomeasure P50 in 60 patientswith non-deficit schizophrenia(NDS),47 patientswith deficit schizophrenia(DS)and 60 unrelated healthy controls(HC).Conditioning(S1)-testing(S2)stimulus paradigm was used to record the P50.The clinical status of patients with schizophrenia was determined using the Positive and Negative Syndrome Scale(PANSS).The social,occupational,and psychological functioning status was assessed using the Global Assessment of Functioning Scale(GAF).Partial correlationswere computed to explore associations between the P50 and the clinical da-tawhen controlling for gender etc.in NDSand DS.ResultsAmong DS,NDSand HC groups,therewere significant differences in S2-P50 amplitude[(3.76±1.69)vs.(2.16±1.20)vs.(2.13±0.94)],S2/S1ratio[(0.82±0.11)vs.(0.43±0.10)vs.(0.40±0.06)],S1-S2amplitude[(0.78±0.49)vs.(2.77±1.49)vs.(3.19±1.18)],and 100(1-S2/S1)ratio[(17.59±10.58)vs.(57.32±9.79)vs.(60.41±5.79)](allP<0.01).DSgroup showed significantly higher S2-P5 amplitude than NDSgroup(P<0.01)and HC group(P<0.01).DSgroup also showed significantly higher S2/S1ratio,lower S1-S2amplitude,and lower 100(1-S2/S1)ratio than NDSgroup(P<0.01)and HC group(P<0.01).In partial correlation analysis,S2amplitude of DSgroup correlated positively with PANSS total score(r=0.40,P=0.01)and PANSS subscale of negative symptoms(r=0.33,P=0.02).S1amplitude of DSgroup correlated negativelywith PANSS total score(r=-0.39,P=0.01).No correlation was found between P50 suppression and clinical variables in DSgroup(P>0.05).Whereas,no correlationswere found between the components of P50,P50 suppression and clinical variables in NDSgroup(P>0.05).ConclusionGeneralized abnormalities of P50 existed in deficit schizophrenia,whereas they did notexisted in non-deficit schizophrenia.The two subgroups of schizophreniamay exist different neuropathological changes.P50 suppressionmay represent the traitmarker of deficit patientswith schizophrenia.
Schizophrenia Deficit Non-deficit Sensory gating Auditory evoked potential P50
R749.3
A
10.3936/j.issn.1002-0152.2013.04.006
☆ 国家自然科学基金项目(编号:81130024);科技部“十二五”支撑计划(编号:2011BAZ02530);教育部博士点基金(编号:20110181110014)
* 四川大学华西医院心理卫生中心(成都 610041)
**四川大学华西医院神经生物检测中心
(E-mail:xuntao26@hotmail.com)
2012-12-07)
(责任编辑:肖雅妮)
·会讯·
- 中国神经精神疾病杂志的其它文章
- 国内外重症肌无力临床结局评价常用量表介绍与评价☆
- 脑干海绵状血管瘤的手术治疗进展☆

